快速高分离液相色谱/四级杆串联飞行时间质谱分析山楂籽中的主要黄酮成分
潘广彦, 朱传合, 乔聚林, 郑振佳
(山东农业大学食品科学与工程学院,山东泰安 271018)
快速高分离液相色谱/四级杆串联飞行时间质谱分析山楂籽中的主要黄酮成分
潘广彦, 朱传合, 乔聚林, 郑振佳
(山东农业大学食品科学与工程学院,山东泰安 271018)
采用快速高分离液相色谱/四级杆串联飞行时间质谱(RRLC/Q-TOF MS)联用技术进行山楂籽中的黄酮类化合物分析方法研究.山楂籽黄酮经超声辅助提取后,选用Welch Materials C18柱(250 mm×4.6 mm,5 μm),流动相组成分别为0.1%甲酸水溶液和乙腈,梯度洗脱.在正离子模式下,经飞行时间质谱分离并检测了15种黄酮成分.结果表明,快速分离液相-四级杆串联飞行时间质谱联用技术可以快速准确鉴定样品中的黄酮成分.
快速高分离液相色谱/四级杆串联飞行时间质谱;山楂籽;黄酮
山楂是蔷薇科山楂属植物,是我国传统中药与水果.现代药理研究表明,山楂中黄酮类化合物具有很好的医疗和保健作用[1].传统注重果实、叶方面的研究,但近几年随着提取工艺和检测手段的提高,对山楂籽的研究有了很大进展,尤其是山楂籽中的黄酮,对心血管系统有良好的治疗保健作用,是开发黄酮的优质资源[2-4].目前,山楂及其副产品中黄酮的检测方法有分光光度法、高效液相色谱法、高效毛细管电泳法、薄层色谱法等[5-9].但是,以上检测方法中分析操作检测时间较长,而且测定的结果容易受到干扰,稳定性差,往往不能满足快速鉴定分析的要求.
飞行时间质谱具有检测灵敏度高,测定化合物质荷比精确,离子扫描范围宽等优点[10-11],是一种新兴且发展迅速的质谱技术.为了进一步提高灵敏度或分辨率,飞行时间质谱与气相色谱、液相色谱、电泳、离子阱及其他质谱联用等技术已成为研究的热点.近年来,快速分离液相-四级杆串联飞行时间质谱联用技术已被广泛应用于天然产物、中药复方分析、生命科学等领域[12-15],逐渐成为植物活性成分定性定量分析的有力的工具,是近几年来应用最广的质谱分析技术之一.
本研究采用快速高分离液相色谱/四级杆串联飞行时间质谱(rapid resolution liquid chromatography/quadrupole-time offlightmass spectrometer,RRLC/Q-TOF MS)联用技术,对山楂籽中的黄酮类化合物进行快速的分析鉴定.该技术操作简便、快速、准确,而且无需对照品,有利于在生产中对山楂籽黄酮类产品的质量控制,为山楂副产品资源的深度开发、综合利用及延长产业链提供技术支持.
1 仪器与试剂
Agilent 1200RRLC/6520型快速高分离液相/四级杆-飞行时间串联液质联用仪,美国安捷伦公司;乙腈为色谱纯,HPLC级甲酸,美国Tedia公司;甲醇为分析纯,实验用水为去离子超纯水;山楂籽(山楂产自泰安),经软化打浆后冲洗晾干,粉碎至60目待用.
2 实验
2.1 样品制备
准确称取山楂籽粉末1.0 g,于50 mL具塞试管木糖-8-C-葡萄糖芹菜素[vicenin 1(6-C-xylosyl-8-C-glucosyl apigenin)]、大波斯菊苷(7-O-glucoside apigenin)、6-C-hexoside-8-C-pentosideApigenin、6-C-阿拉伯糖-8-C葡萄糖芹菜素(isoschaftoside)、6-C-葡萄糖-8-C-阿拉伯糖芹菜素(schaftoside)、8-甲氧基山萘酚(8-methoxy kaempferol).中,加入10 mL甲醇,混匀,室温下超声提取15 min,3 500 r/min 离心 15 min,取上清液,过 0.22 μm 滤膜,作为实验样品.
2.2 液质联用分析条件
2.2.1 色谱条件
色谱柱为 Welch Materials C18(250 mm×4.6 mm,5 μm);流动相A为乙腈,流动相B为体积分数是0.1%甲酸的水溶液;流速1 mL/min;进样体积20 μL;柱温30℃;检测波长260 nm.流动相线性梯度洗脱如表1.
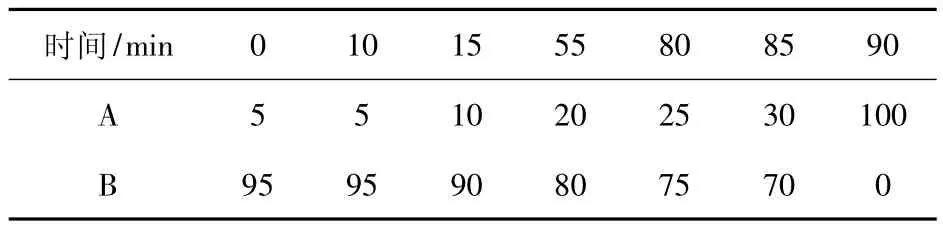
表1 线性梯度洗脱表Tab.1 Procedure of linear gradient elution %
2.2.2 质谱条件
离子源ESI,正离子模式扫描,质量扫描范围100~1 000m/z,毛细管电压4 000 V,四极杆温度100℃,雾化压力3.45×105Pa(50 psi),干燥气流量10 L/min,干燥器温度350℃,碎裂电压175 V.
3 结果与讨论
3.1 条件优化
实验发现在流动相体系中加入适量甲酸可有效抑制酸性化合物的拖尾,更利于增强质谱信号,从而提高灵敏度.实验考察了甲酸的添加量,结果发现在水中添加体积分数0.1%甲酸有效的抑制酸类物质的拖尾现象.质谱检测分别采用了正、负离子2种扫描模式进行分析,结果发现正离子模式下峰面积更大、质谱响应更强,比负离子模式更加灵敏,因此本实验采用正离子模式进行检测.山楂籽提取液RRLC/Q-TOF MS的总离子流图见图1.
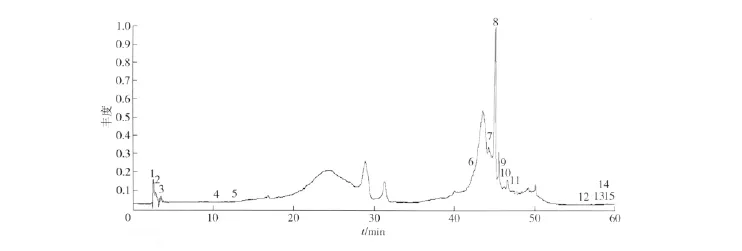
图1 山楂籽提取液的总离子流图Fig.1 Total ion chromatogram of extracts of hawthorn seed
3.2 山楂籽中黄酮类化合物的分析
本实验采用RRLC/Q-TOF获得了山楂籽醇溶性成分的分子离子峰及其精确分子量,见图2.根据得到山楂籽醇溶性化合物的精确相对分子质量,结合山楂植物化学成分研究报道,参考相关文献收集了山楂植物中黄酮类化合物共60个[16],并以此为依据对15种黄酮类化合物进行鉴定.根据图2由文献推断山楂籽黄酮的成分如下.
峰1(图2f)获得 m/z 433.146 6[M+H]+质谱信号,峰2(图2l)获得m/z 579.150 9[M+H]+质谱信号,峰3(图2e)获得m/z 433.146 4[M+H]+质谱信号,峰4(图2k)获得m/z 579.149 9[M+H]+质谱信号,峰6(图2n)获得 m/z 611.243 0[M+H]+质谱信号,峰7(图2o)获得m/z 615.242 9[M+H]+质谱信号,峰8(图2h)获得m/z 565.206 0[M+H]+质谱信号,峰9(图2d)获得m/z 417.153 6[M+H]+质谱信号,峰10(图2j)获得m/z 565.2065[M+H]+质谱信号,峰11(图2i)获得m/z 565.2061[M+H]+质谱信号,峰12(图2g)获得 m/z 547.360 4[M+H]+质谱信号,峰15(图2c)获得m/z 317.208 5[M+H]+质谱信号,根据文献[17-18]推断其分别为:异牡荆素(iso-vitexin)、牡荆素-2″-O-鼠李糖苷(vitexin-2″-O-rhamnoside)、牡荆素(vitexin)、牡荆素-4'-O-鼠李糖苷(vitex-in-4'-O-rhamnoside)、木犀草素类-3',7-二葡萄糖糖苷(luteolin-3',7-diglucoside)、2″-O-鼠李糖荭草素(2″-O-rhamnoside-orientin)、6-C-

图2 山楂籽黄酮的质谱图Fig.2 Mass spectra of hawthorn seed extracts
峰5(图2a)获得m/z 433.146 4[M+H]+质谱信号,峰13(图2m)获得 m/z 581.431 7[M+H]+质谱信号,根据文献[19]推断其分别为:儿茶精(catechin)、柚皮苷(tectoridin).
峰14(图2b)获得m/z 611.243 0[M+H]+质谱信号,根据文献[20]推断其为:异鼠李素(isorhamnetin).
山楂籽中的黄酮成分液相保留时间、质谱分子离子峰、分子量实验测定值和理论值如表2,通过比较可以看出分子量实验测定值和理论值相差很小,说明推导结果的准确可信.
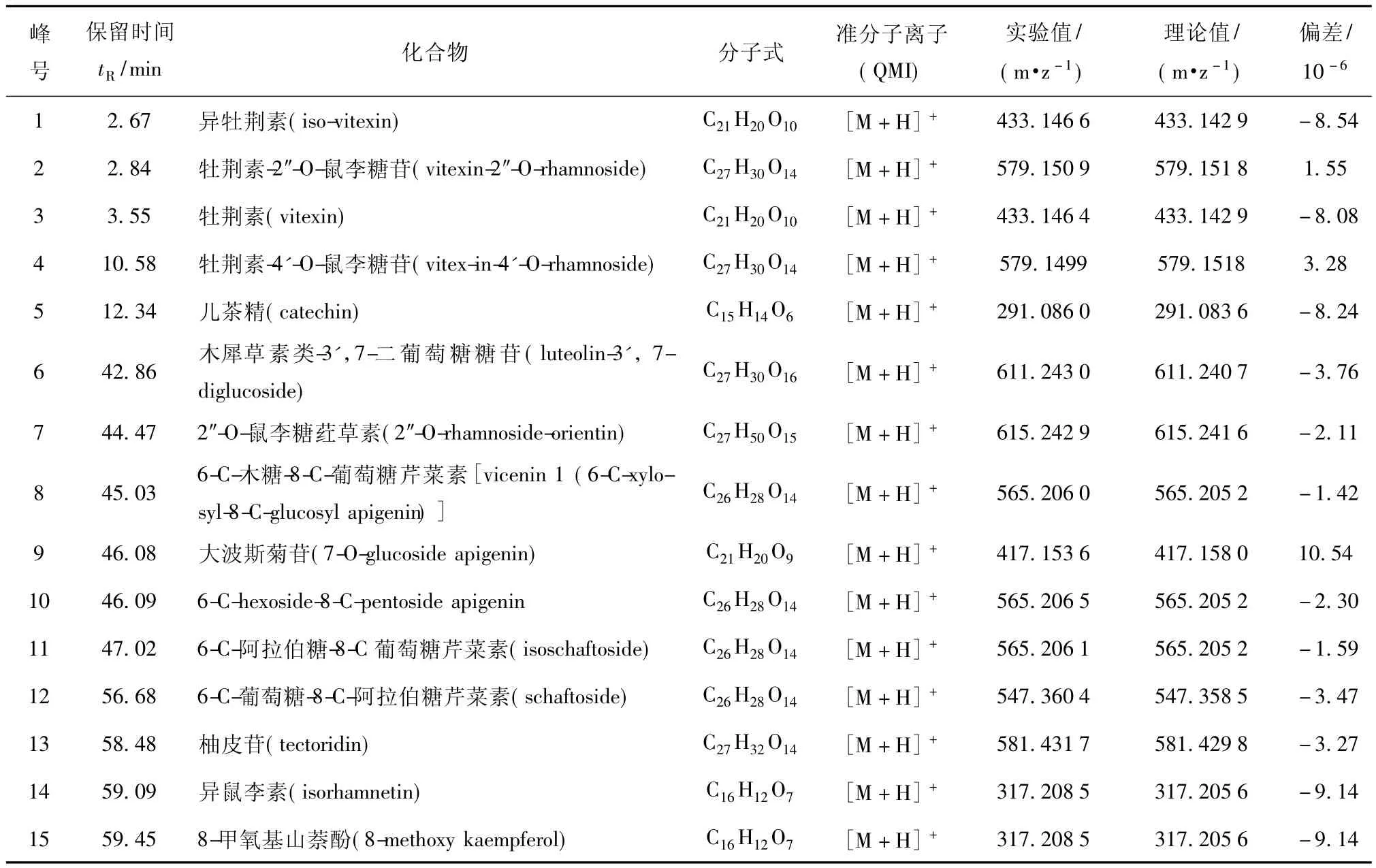
表2 山楂籽提取液中黄酮的RRLC/Q-TOF MS分析Tab.2 RRLC/Q-TOF MS accurate mass measurements of flavones in extract of hawthorn seed
4 结论
本研究采用快速液相-四级杆串联飞行时间质谱联用技术,对山楂籽中的黄酮种类进行快速的分析鉴定,建立了快速分析鉴定山楂籽中15种主要黄酮成分的方法.该方法具有操作简便准确、无需对照品、试剂消耗少、测定周期短等优点,并为山楂植物中黄酮类化合物成分分析提供了一种新的有效、可靠的方法,对植物中有效成分的准确分析鉴定具有重要的意义.
[1]刘荣华,邵峰,邓雅琼.山楂化学成分研究进展[J].中药材,2008,31(7):1100-1103.
[2]陈坚,陈代鸿.山植果肉、核、叶中总黄酮的含量测定与比较[J].基层中药杂志,1999,13(4):8-9.
[3]文开新,王成章,严学兵,等.黄酮类化合物生物学活性研究进展[J].草药科学,2010,27(6):115-122.
[4]Peter C,Peter D,Marcel H.Estimation of daily human intake of food flavonoids[J].Plant Food Hum Nutr,2007,62:93-98.
[5]陈勇,甄汉深,董艺.广山楂及其叶质量分析研究[J].时珍国医国药,1999,10(7):511-512.
[6]孙立立,谢鸿霞,孙敬勇,等.比色法测定山楂中总黄酮的含量[J].中成药,2001,23(10):748-750.
[7]王福成,豆文太,朱文学.HPLC测定山楂精中牡荆素,牡荆苷-2″-O-鼠李糖苷.金丝桃苷.芦丁的含量[J].中成药,2002,24(2):122-124.
[8]许红蕾,周婷婷,范国荣.山楂叶化学成分的HPLCDAD/ESI-MS分析[J].药学实践杂志,2009,27(1):40-42.
[9]郑有飞,石春红,汪本友.天然黄酮物质提取技术和分析方法的研究进展[J].分析科学学报,2009,25(1):102-107.
[10]李文龙,陈军辉,殷月芬,等.加速溶剂提取-高效液相色谱-电喷雾飞行时间质谱联用分析莲子心中生物碱[J].分析化学,2008,36(1):79-82.
[11]韩超,陈军辉,刘劼,等.高效液相色谱-电喷雾飞行时间质谱分析太子参中环肽类化合物[J].分析化学,2006,34(12):1719-1722.
[12]叶茂,谢国祥,赵爱华,等.超高效液相色谱-飞行时间质谱法测定苦参素注射液中苦参碱和氧化苦参碱[J].中国中药杂志,2008,33(12):1398-1401.
[13]何忠梅,孙佳明,张辉,等.固相萃取-高效液相色谱-电喷雾串联质谱法分析芍药和酒芍药的水溶性化学成分[J].分析化学,2009,37(8):1201-1205.
[14]郑振佳,王晓,王明林,等.固相萃取-快速分离液相-四级杆串联飞行时间质谱联用分析荷叶中的生物碱[J].中草药,2011,42(6):1066-1068.
[15]郑振佳,初玉圣,迟炳海,等.快速分离液相-四级杆飞行时间串联质谱分析大豆中的异黄酮成分[J].食品科学,2011,32(6):233-236.
[16]郭永学,李楠,杨美燕,等.山楂属植物黄酮成分及其分析方法研究进展[J].中成药,2005,27(1):112-115.
[17]Nikolov N,Seligmann O,Wagner H,et al.Neue Flavonoid-Glykoside and crataegus monogyna and Crataegus pentagyna[J].Planta Med,1982,44(1):50-53.
[18]Dauguet J C,Bert M,Dolley J,et al.8-Methoxykaempferol 3-neohesperidoside and other flavonoids from bee pollen of Crataegusmonogyna[J].Phytochemist,1993,33:1503-1505.
[19]刘霞,赵淑春,程宏,等.山楂黄酮类成分的分析测定[J].吉林农业大学学报,1997,19(3):50-52.
[20]袁冬梅,李一婧.山楂叶中黄酮含量的高效液相色谱法测定[J].中国酿造,2007(12):66-68.
(责任编辑:李 宁)
Analysis of Flavonoids in Hawthorn Seed using Rapid Resolution Liquid Chromatography-Quadrupole-Time of Flight Mass Spectrometer
PAN Guang-yan, ZHU Chuan-he, QIAO Ju-lin, ZHENG Zhen-jia
(College of Food Science and Engineering,Shandong Agricultural University,Tai'an 271018,China)
In the paper,a novel method for flavonoids analysis in Hawthorn seed was investigated using rapid resolution liquid chromatography/quadrupole-time of flight mass spectrometer(RRLC/Q-TOF MS).The flavonoids compounds from Hawthorn seed were extracted by ultrasound-assisted extraction technology and then separated using Welch Materials C18column(250 mm ×4.6 mm,5 μm).Water containing 0.1%formic acid and acetonitrile was used as mobile phase.Time-of-flight mass spectrometer(TOF/MS)was applied for qualitative analysis under positive ion mode.Fifteen of the major flavones of hawthorn seed were identified.In conclusion,this method can be used to determine the flavones of Hawthorn seed rapidly.
RRLC/Q-TOF MS;hawthorn seed;flavone
TS207.3
A
1671-1513(2012)06-0052-05
2012-04-25
山东省科技攻关计划项目(2009GG10009047);泰安市专项计划项目.
潘广彦,男,硕士研究生,研究方向为食品科学;
朱传合,男,副教授,主要从事食品深加工及食品生物技术方面的研究.通讯作者.

