CXCR4和MMP-9在胃癌组织中表达及其意义
徐 斌 韩绍伟 周笑珍 蒋 平 李利义
胃癌是消化道最常见的恶性肿瘤之一,其发病率和病死率均居我国消化道恶性肿瘤的首位。淋巴及腹膜转移是其最常见的转移方式,与胃癌的复发及预后关系密切[1]。研究证实,趋化因子受体4(CXC chemokine receptor 4,CXCR4)与其配体CXCLl2间的相互作用在包括胃癌在内的多种肿瘤的发生、发展和转移中发挥着重要的作用[2]。肿瘤的发展和转移过程中必然破坏细胞外基膜(ECM),而基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)是一种能降解ECM及其他基质成分的重要蛋白酶,在促进肿瘤侵袭和转移过程中发挥重要作用。本研究采用免疫组织化学的方法研究胃癌组织中趋化因子受体CXCR4和MMP-9的表达情况,并探讨其与胃癌临床病例分期的关系及两者的相关性。
材料与方法
1.材料:76例胃癌组织标本取自2009年1月~2010年12月在笔者医院普外科行手术切除术患者,其中男性52例,女性24例,年龄26~79岁,平均年龄57.0±1.8岁。所有病例均术前及术后经病理学证实,术前均未行放化疗。肿瘤分期按照2002年国际抗癌联盟(UICC)颁布的胃癌TNM分期方案。术后10min内每份标本取材于肿瘤组织,癌旁正常胃组织(距肿瘤组织边缘>5cm,做正常对照),全部标本取材后迅速置于10%中性甲醛中固定,备用。
2.试剂:鼠抗人CXCR4抗体购至美国Sigma公司,兔抗人MMP-9抗体购自美国Epitomics公司,免疫组化S-P试剂盒购自德国宝灵曼公司。
3.方法:(1)CXCR4和MMP-9蛋白表达的检测:采用S-P法进行免疫组织化学染色。具体步骤:所有标本经10%中性甲醛固定,常规石蜡包埋后制备5μm厚连续切片。常规脱蜡、水化,0.3%的H2O2去离子水孵化15min灭活内源性过氧化物酶活性。组织抗原修复10min(用pH 6.0的0.01mol/L柠檬酸缓冲液,于微波炉中94℃加热,每次5min,共2次),正常羊血清封闭,分别加入CXCR4(工作浓度1∶50)和MMP-9(工作浓度为 1∶150),37℃ 孵育 2 ~3h,PBS 充分洗涤(5min×3次);滴加生物素标记的二抗,室温37℃孵育30min,PBS再次冲洗(5min×3次);滴加辣根酶标记的链霉卵白素,室温37℃孵育30min,PBS漂洗后DAB显色;苏木精复染、脱水、透明、封片。操作过程中严格质控。用已知阳性的胃癌切片作为阳性对照,用PBS代替一抗,作为阴性对照。
(2)结果判断:CXCR4和MMP-9均为胞膜或胞质表达,以细胞膜和(或)细胞质呈棕黄或棕褐色者为阳性细胞,随机计数10个高倍视野(×400),每个视野读取200个细胞计数阳性细胞数,计算阳性率,并取平均值。所有切片均用盲法计数。阳性表达判断参照Mattern等[3]的计数方法,按染色强度及阳性细胞率来计算评分。染色强度:无着色为0分,浅黄色为1分,浅棕色为2分,深棕色为3分;阳性细胞率:阳性率<1%为0分,阳性细胞率<25%为1分,阳性细胞率25% ~50%为2分,阳性细胞率>50%为3分。染色强度及阳性细胞率评分之和即为最后得分:0~1分为阴性(-),2~3分弱阳性(+);4~5分为阳性(++);>5分为强阳性(+++)。
4.统计学方法:应用SPSS 15.0统计软件对实验数据进行分析。采用Fisher确切概率法分析CXCR4和MMP-9表达与患者临床病理特征之间的相关性;CXCR4与MMP-9相关性检验采用Spearman等级相关分析。p<0.05为差异有统计学意义。
结 果
1.CXCR4和MMP-9在不同胃组织中的表达情况:CXCR4在癌旁正常胃组织中无阳性表达,在76例胃癌组织中有42例表达阳性,表达率为55.26%(图1)。MMP-9在癌旁正常胃组织阳性表达率为15.79%(12/76),在胃癌组织中阳性表达率为67.11%,差异有统计学意义(p<0.000)(图2)。各组肿瘤组织切片经PBS代替特异性一抗作为空白对照,肿瘤组织镜下均无阳性表达。
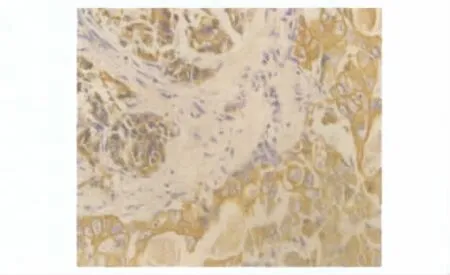
图1 CXCR4在胃癌组织中的表达(×400)
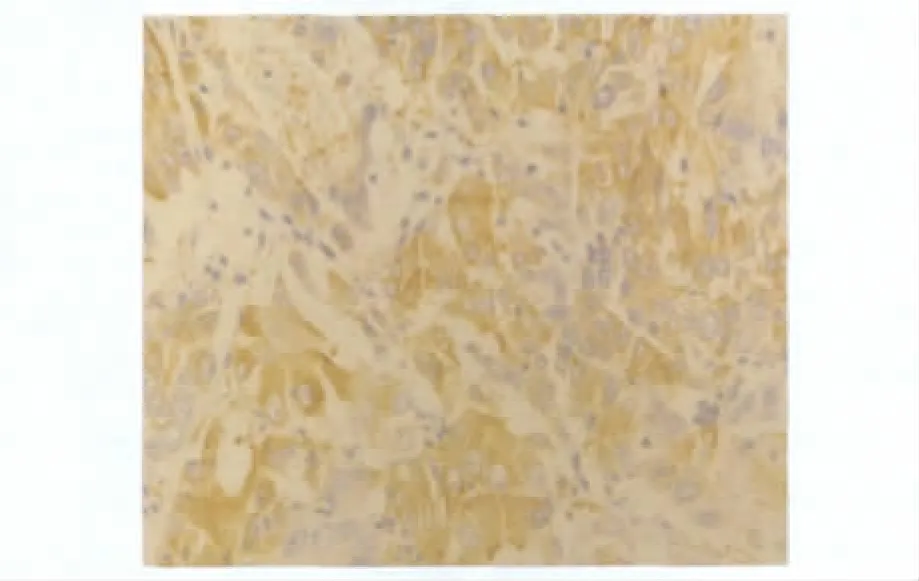
图2 MMP-9在胃癌组织中的表达(×400)
3.CXCR4和MMP-9表达与胃癌临床病理因素的关系:CXCR4和MMP-9的阳性表达水平与胃癌的组织分化程度、浸润深度、淋巴结转移、腹膜转移密切相关(p<0.05),而与患者性别、年龄、肿瘤大小、肿瘤部位无关(P>0.05)(表1)。
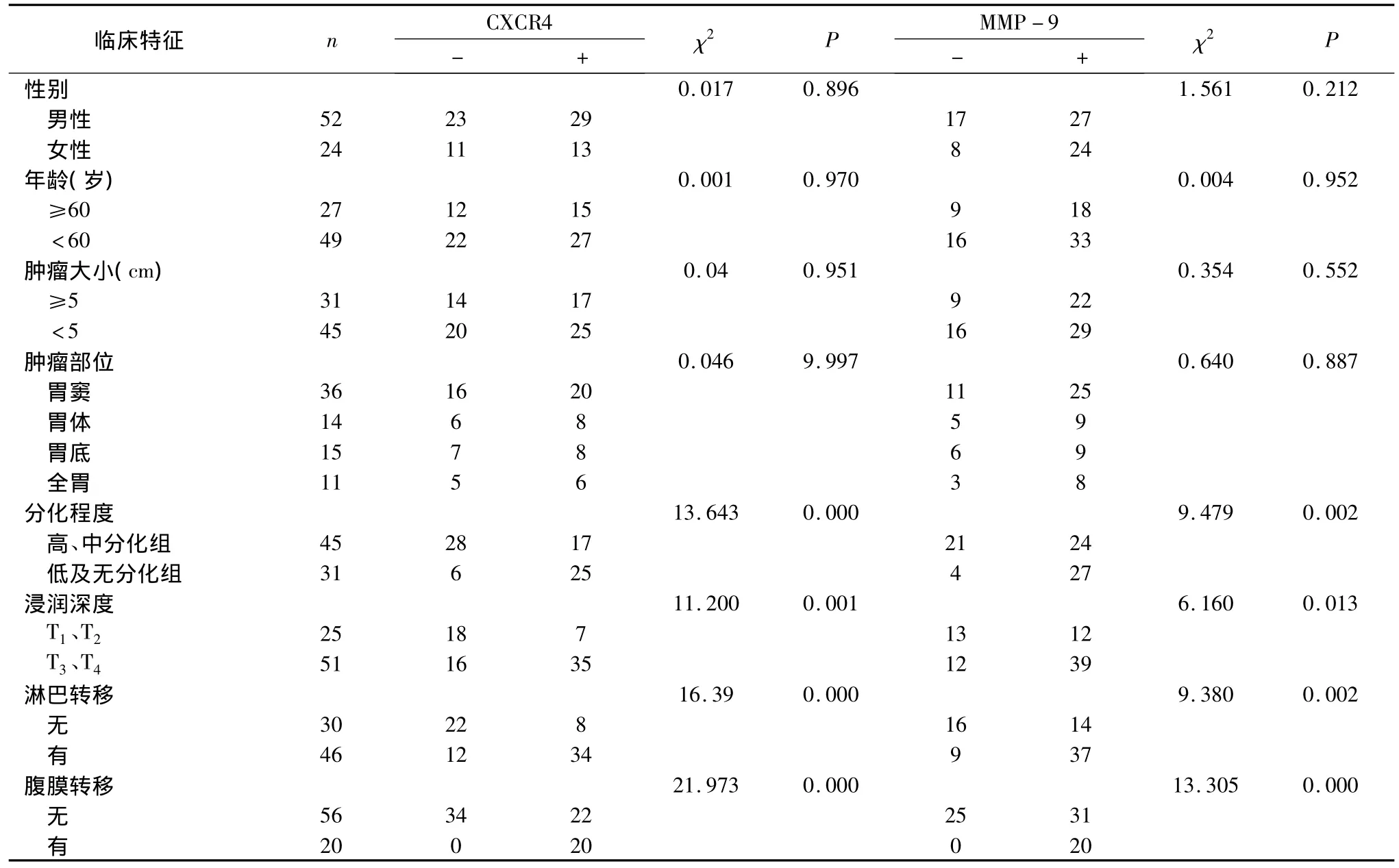
表1 CXCR4、MMP-9蛋白表达与胃癌的临床病例参数的关系
3.胃癌组织中CXCR4与MMP-9表达的关系:胃癌组织CXCR4的阳性表达水平与MMP-9的阳性表达水平呈正相关(r=0.406,P=0.000)(表2)。
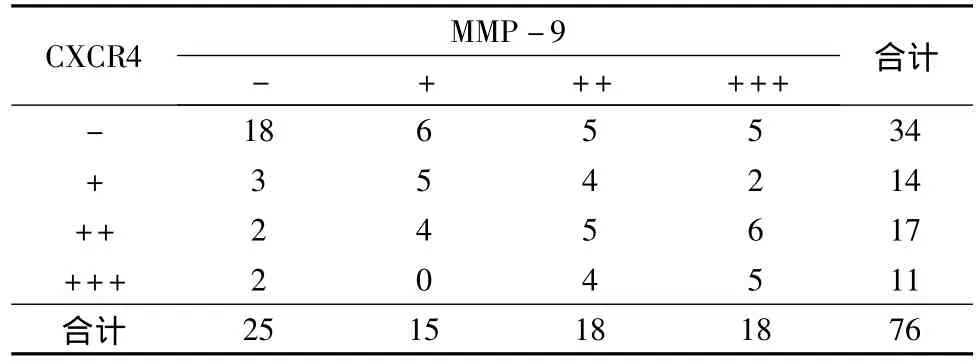
表2 胃癌中CXCR4与MMP-9表达的关系
讨 论
侵袭和转移是恶性肿瘤的主要生物学特性,是肿瘤患者致死的主要原因,亦是判断患者预后和确定治疗方案的重要依据。趋化因子是可受化学诱导物及细胞因子调节、并能刺激细胞趋化运动的一类低分子蛋白质。在正常和病理状态下细胞沿着趋化因子浓度增加的信号向趋化因子源处的迁徙。研究表明,不同肿瘤细胞高表达特异的趋化因子配体,而一些靶器官则相应的高表达其趋化因子受体,肿瘤细胞沿着趋化因子信号向相应的靶器官转移,凭借趋化因子配体和受体的特异性结合,最终完成特异性转移可能与肿瘤的浸润和转移有关[4]。
CXCR4是一个编码352个氨基酸且高度保守的G蛋白偶联7次跨膜受体,CXCL12又称基质细胞衍生因子 -1(stromal cell-derived factor-1,SDF-1),属于CXC族趋化因子成员。趋化因子CXCLl2与其特异性受体CXCR4所构成的CXCL12/CXCR4生物学轴(CXCL12/CXCR4 biological axis)在多种肿瘤的浸润与转移中发挥重要作用[5]。有研究表明,人乳腺癌细胞系和乳腺癌组织中高表达趋化因子受体CXCR4,而在乳腺癌最常见的转移部位如淋巴结、肺、肝等则高表达其配体CXCL12,并且来自这些组织的蛋白提取物对乳腺癌细胞有明显的趋化作用[6]。这一现象在非小细胞肺癌、前列腺癌、胰腺癌中亦得到证实[7~9]。Yasumoto 等[10]发现胃癌组织中 CXCR4的表达增高,提示CXCR4参与了肿瘤的发生和发展。本研究显示,CXCR4在胃癌组织中的阳性表达明显高于正常胃组织,提示CXCR4在胃癌的发生和发展中可能起重要作用。本研究还发现,CXCR4的阳性表达与胃癌的组织分化程度、浸润深度、淋巴结转移及腹膜转移密切相关,提示CXCR4阳性表达与胃癌组织的恶性程度、浸润、转移关系密切。说明CXCR4表达高的癌细胞更容易侵入淋巴管,形成淋巴结转移;CXCR4表达高的癌细胞可以藉趋化因子配体与受体间相互作用,促进其浸润性生长和转移。
细胞外基质(extracllular matrix,ECM)的降解和基膜的破坏是肿瘤浸润和转移的先决条件。基质金属蛋白酶(MMP-s)能降解ECM,破坏基膜,促进肿瘤血管新生,在恶性肿瘤的发生、发展过程中起重要作用[11]。MMP-9是MMP家族重要成员之一,可降解细胞外多种基质成分,如Ⅳ型胶原、蛋白多糖、层黏蛋白及纤维连接蛋白等,并通过降解、破坏肿瘤的细胞外基质和基膜、促进新生血管生成,从而促进肿瘤细胞侵犯邻近器官的组织、淋巴管和小血管向远处转移[12]。研究显示,MMP-9在胃黏膜的表达是胃癌发生的晚期事件,是胃黏膜上皮细胞发生恶变的标志[13]。MMP-9的过度表达对胃癌的发生、发展起重要作用,其表达与肿瘤的浸润和转移密切相关[14,15]。在本研究结果现显示,MMP -9 在人胃癌组织的阳性表达率明显高于正常胃组织,且与胃癌的组织分化程度、浸润深度、淋巴结转移、腹膜转移有关。说明MMP-9表达较高的肿瘤组织具有较强的侵袭和转移能力;肿瘤的侵袭伴随基膜的破坏;MMP-9可以用来反映胃癌恶性程度的高低,并且能够成为评估胃癌预后的一个指标。
分析CXCR4和MMP-9在胃癌组织中表达的相关性,实验结果提示CXCR4的阳性表达同MMP-9的阳性表达呈正相关。因此笔者推测两者在胃癌的发生、发展中存在协同作用。其可能的机制如下:①CXCR4介导MMP-9分泌,而MMP-9进一步降解Ⅳ型胶原纤维而破坏基膜和诱发新生血管形成,从而促进肿瘤细胞侵袭和转移:Samara等发现CXCR4可通过诱导细胞内钙离子动员,活化细胞外信号调节激酶(ERK-1/2),介导MMP-9的分泌;②CXCR4通过激活MMP-9活性促进肿瘤侵袭、转移:Brand等等对结直肠癌细胞的研究发现CXCLl2与CXCR4通过相互作用激活ERK-1/2、SAPK/JNK,Akt和MMP-9,进一步介导肌动蛋白细胞骨架的重组,最终促进肿瘤的侵袭和转移;③CXCR4和MMP-9存在共同的信号通路:Helbig等研究发现细胞外信号激活转录因子NF-κB可直接上调CXCR4的表达,Farina等发现NF-κB也可以促进MMP-9酶原的分泌,因此,二者可能存在共同的信号通路,通过共同的信号通路促进肿瘤的发生和发展。
综上所述,CXCR4和MMP-9的阳性表达同胃癌分化程度,肿瘤浸润深度,淋巴结转移和腹膜转移之间的密切相关。CXCR4的阳性表达和MMP-9的阳性表达呈正相关,二者在促进胃癌的发展过程中具有协同作用。联合检测CXCR4和MMP-9可能对判断胃癌的预后有重要参考价值。
1 吴亮亮,梁寒,王晓娜,等.胃癌根治术后复发转移临床相关因素分析[J].中华消化杂志,2011,31(1):17 -20
2 Kucia M,Reca R,Miekus K,et al.Trafficking of normal stem cells and metastasis of cancer stem cells involve similar mechanisms:pivotal role of the SDF-1-CXCR4 axis[J].Stem Cells,2005,23(7):879-894
3 Mattern J,Koomagi R,Volm M.Associalion of vascular endothelial growth factor expression with intratumoral microvessel densilv and tumour cell proliferation in human epidermoid lung carcinoma[J].Br J Cancer,1996,73(7):931 -934
4 Balkwill F.Chemokine biology in cancer[J].Semin Immunol,2003,15(1):49-55
5 吕明,赵文华.CXCL12-CXCR4生物学轴在肿瘤侵袭与转移中的研究进展[J].国际肿瘤学杂志,2008,35(2):90-92
6 Muller A,Homey B,Soto H,et al.Involvement of chemokine receptors in breast cancer metastasis[J].Nature,2001,410(6824):50 -56
7 Phillips RJ,Burdick MD,Lutz M,et al.Thestromal derived factor-1/CXCL12-CXC chemokine receptor 4 biological axis in non-small cell lung cancer metastases[J].Am JRespir Crit Care Med,2003,167(12):1676-1686
8 Marchesi F,Monti P,Leone BE,et al.Increased survival,proliferation,and migration in metastatic human pancreatic tumor cells expressing functional CXCR4[J].Cancer Res,2004,64(22):8420-8427
9 Wang Z,Ma Q,Liu Q,et al.Blockade of SDF -1/CXCR4 signalling inhibits pancreatic cancer progression in vitro via inactivation of canonical Wnt pathway[J].Br J Cancer,2008,99(10):1695 -1703
10 Yasumoto K,Koizumi K,Kawashima A,et al.Role of the CXCL12/CXCR4 axis in peritoneal carcinomatosis of gastric cancer[J].Cancer Res.2006,66(4):2181-2187
11 Khasigov PZ,Podobed OV,Gracheva TS,et al.Role of matrix metalloproteinases and their inhibitors in tumor invasion and metastasis[J].Biochemistry(Mosc),2003,68(7):711-717
12 Roomi MW,Monterrey JC,Kalinovsky T,et al.Distinct patterns of matrix metalloproteinase-2 and -9 expression in normal human cell lines[J].Oncol Rep,2009,21(3):821-826
13 姬瑞,周永宁,任涛文,等.MMP-9在胃癌及其淋巴结组织中表达的临床意义[J].中国肿瘤临床,2010,37(7):377-380
14 Davies B,Waxman J,Wasan H,et al.Levels of matrix metalloproteases in bladder cancer correlate with tumor grade and invasion[J].Cancer Res,1993,53(22):5365 -5369
15 霍志军,陈道瑾,李小荣,等.乳腺癌和纤维瘤中RECK-mRNA和MMP9-mRNA的表达差异及意义[J].中国普通外科杂志,2007,16(1):69 -72

