BMP-7在大鼠肝纤维化组织中的动态表达和意义
朱碧红 陈永平 戴志娟 叶 超 程 瑗 王晓东
肝纤维化(hepatic fibrosis,HF)是肝脏对各种慢性肝损伤的代偿反应所形成的一种肝脏瘢痕组织,并导致细胞外基质(extracellular matrix,ECM)、细胞群和细胞因子的复杂改变,是各种慢性肝病(如病毒性、酒精性、药物性、胆汁郁积性肝病和非酒精性脂肪肝等)发展的共同途径,也是进一步向肝硬化发展的必经之路[1,2]。骨形态发生蛋白(bone morphogenetic p rotein,BMP)是一类细胞因子,属于转化生长因子TGF-β超家族的一员[3]。骨形态发生蛋白7(BMP-7)亦称成骨蛋白1(osteogenic protein 1,OP-1),其拮抗组织纤维化作用在肾、心肌、肺等多种组织中已被证实,但至今为止,BPM-7与肝纤维化的关系,国内外鲜见报道[4]。本研究通过建立大鼠肝纤维化模型,动态观察BMP-7的表达情况,初步探讨BMP-7在肝纤维化发生、发展过程中的作用,为进一步研究其作用机制打下基础。
材料与方法
1.实验动物与分组:42只健康雄性SD大鼠,清洁级,质量200~250g,由中国医学科学院上海实验动物中心提供。按随机数字表法分为两组:对照组6只,肝纤维化模型组36只。
2.实验动物模型制备:实验前12h禁食。对照组每周前3天每天1次腹腔内注射0.9%氯化钠溶液0.2ml/100g,连续4周。将二甲基亚硝胺(DMN,购自日本WAKO生物公司)溶解于0.9%氯化钠溶液使其最终浓度为0.5%,按0.2ml/100g的剂量腹腔内注射,每周前3天每天1次,连续4周建立肝纤维化模型。
3.取材:造模后4 天、1、2、4、6、8 周按随机数字表随机取6只大鼠,留取肝组织,一部分在10%中性甲醛溶液中固定,石蜡包埋,制备组织切片;另取部分肝组织立即液氮冻存,以备RT-PCR检测。
4.肝组织病理学观察:取肝组织石蜡切片行常规HE染色及Masson染色(染色试剂盒均购自福州迈新公司),光学显微镜下观察组织损伤情况。
5.RT-PCR测定肝组织BMP-7 mRNA的表达水平:肝组织研磨,Trizol抽提RNA。引物由上海捷瑞生物公司合成,检索Pubmed上相关大鼠基因核苷酸序列全长,采用软件primer5.0分析设计引物序列。BMP-7上游引物:5'-CTGAGGAGGGCTGGTTGGTATT -3',下游引物:5'- TGGTGGCGTTCATGTAGGAGTT -3',产物长度474bp;β -actin上游引物:5'- GAGAGGGAAATCGTGCGTGAC -3',下游引物:5'- CATCTGCTGGAAGGTGGACA -3',产物长度452bp。RTPCR试剂盒购自大连宝生物工程有限公司,严格按试剂盒说明书操作,分别反转录和PCR扩增。BMP-7基因扩增参数,94℃ 5min;94℃ 30s,57℃ 30s,72℃ 30s,32 个 循 环;72℃5min。β -actin 基因扩增参数,94℃ 5min;94℃ 30s,61℃ 30s,72℃ 30s,22个循环;72℃ 5min。将5μl RT -PCR 产物加1μ1 6×上样缓冲液在含0.5μg/ml溴化乙锭的2%琼脂糖凝胶上电泳,在凝胶成像系统上显像,并用Gel-Pro 3.1软件分析RT-PCR产物电泳条带,与相应的内参基因吸光度比值作为目的基因mRNA的相对含量。
6.ALT、AST、ALB测定:采用全自动生化分析仪测定不同时间点大鼠血清ALT、AST和ALB水平的变化。
7.统计学方法:数据经SPSS 17.0软件处理,计量资料以均数±标准差表示,采用单因素方差分析(One-way ANOVA)进行多组均数间的比较,方差齐性者两两比较采用LSD法,方差不齐者进行Dunnett's T3检验。p<0.05为差异有统计学意义。
结 果
1.病理学观察:对照组大鼠肝组织质地柔软,表面光滑;肝纤维化模型组大鼠肝脏质地坚韧,表面粗糙,颜色灰暗,有些可见颗粒状小结节。HE染色及Masson染色后光学显微镜下观察:对照组大鼠肝小叶结构正常,肝细胞索排列规则有序,肝板以中央静脉为中心呈条索状向四周放射状排列,板间有不规则肝窦,仅于汇管区和中央静脉周围有少许胶原纤维存在。肝纤维化模型组多数小叶结构破坏或消失,由汇管区和中央静脉伸出粗大胶原纤维条索分割、包绕肝小叶,肝细胞索排列紊乱,肝细胞浊肿明显,坏死出血较多。纤维隔内有大量炎性细胞浸润,见图1。
2.肝纤维化模型组血清ALT、AST和ALB的变化:造模后4天,ALT、AST 已显著升高(P <0.05),在4周达最高峰,而后渐渐下降,但每个时间点均显著高于对照组水平(p<0.05)。AST值的变化曲线大致上与ALT一致,见表1。与对照组比较,造模后2周,ALB开始下降(p<0.05),且在6周达最低谷。

图1 对照组与肝纤维化模型组大鼠肝组织病理图(Masson染色 ×100)

表1 各组大鼠血清学检测结果(x±s)
3.RT-PCR测 BMP-7 mRNA结果:BMP-7 mRNA在对照组大鼠和肝纤维化模型组大鼠肝组织中均有表达。与对照组相比,肝纤维化模型组4天时BMP-7 mRNA表达显著减少(p<0.05)。1~2周与对照组差别无显著性(均P>0.05),1周与4天比较差异无显著性(P>0.05),2周与4天比较显著升高(p<0.05)。4周较对照组显著升高,达高峰(p<0.05)。6周较对照组显著升高(p<0.05),较4周下降(p<0.05)。8周较6周有显著下降(p<0.05),与对照组无显著差异(P>0.05)。见表2、图2。
表2 各组大鼠肝组织BMP-7 mRNA水平变化

表2 各组大鼠肝组织BMP-7 mRNA水平变化
IOD为积分光密度。模型组各时间点与对照组比较,A p<0.05;模型组各时间点与模型组4周比较,B p<0.05;模型组各时间点与模型组4天比较,C p<0.05;模型组6周与模型组8周比较,D p<0.05
6 2.13113 ±0.25775肝纤维化模型组4 天 6 1.72476 ±0.21199AB 1 周 6 1.91393 ±0.29671B 2 周 6 2.43084 ±0.09363BC 4 周 6 4.58104 ±0.37906AC 6 周 6 3.55517 ±0.30825ABC 8 周 6 1.92141 ±0.26457比值对照组组别 鼠数(只)BMP-7/β-actin IOD BD
讨 论
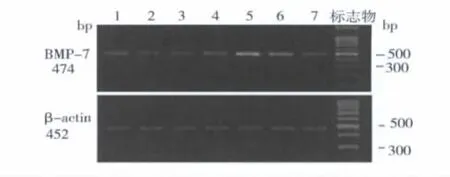
图2 反转录-聚合酶链反应检测各组大鼠BMP-7 mRNA的表达
BMP-7是一种分泌型多功能蛋白,分布范围极其广泛,主要分布在骨骼、肾、肾上腺、前列腺、膀胱等处,相对分子质量约为35kDa,在细胞内以前体形式合成,前体分子经蛋白水解酶酶解后再通过二硫键结合形成成熟的二聚体分子,可以释放到细胞外与机体各处靶细胞表面特殊的受体结合,介导Smad细胞间信号,激活特殊的基因发挥作用[5]。目前对BMP-7的研究大多集中在肾脏、骨骼系统、眼、心脏、肺等方面。Wang等[6]在肾病研究的实验中发现,BMP-7具有刺激或诱导基质金属蛋白酶-2(MMP-2)降解ECM的作用。Schnabl等[7]研究显示,BMP-7在鼠晶状体上皮细胞向间充质细胞转变(EMT)过程中,阻止晶状体纤维组织的形成。还有研究发现,BMP-7具有能够减少炎症因子的释放、维持细胞内环境稳定的作用[8,9]。
肝纤维化是指肝细胞发生坏死及炎症刺激时,肝脏中胶原蛋白等ECM的增生与降解失去平衡,进而导致肝脏内纤维结缔组织异常沉积的病理过程。炎症反应也参与肝纤维化过程[12]。本研究通过腹腔内注射DMN建立大鼠肝纤维化模型。实验中发现,BMP-7 mRNA在对照组大鼠和肝纤维化模型组大鼠肝组织中均有表达。与对照组相比,模型组4天时BMP-7 mRNA表达显著减少。1~2周与对照组差别无显著性,1周与4天比较差异无显著性,2周与4天比较显著升高。4周较对照组显著升高,达高峰。6周较对照组显著升高,较4周下降。8周较6周有显著下降,与对照组无显著差异。这与张立英等研究发现的在四氯化碳诱导的大鼠肝纤维化中,BMP-7的表达随着时间和纤维化程度的加重而减少相符合,考虑BMP-7可能参与肝纤维化的发生、发展过程,并与肝纤维化的严重程度密切相关。研究表明BMP-7可以减少肿瘤坏死因子α刺激产生的多种促炎性因子表达,如IL-6、IL-1、单核细胞趋化蛋白1、1L-8、内皮素2和结缔组织生长因子的表达,以起到抗炎症作用[8]。实验显示BMP-7在DMN造模早期出现下降,考虑可能与炎症早期肝细胞急性损伤时BMP-7大量消耗以减少炎性因子的释放,减轻炎症反应造成的实质细胞损伤有关。
肝纤维化是慢性肝脏疾病的共同病理表现,存在复杂的细胞因子网路调控。随着分子生物学的进展,BMP-7的细胞和分子机制已是世界研究热点,但到目前为止尚未完全明了。许多研究表明BMP-7通过Smad途径从基因水平直接拮抗TGF-β的作用。本实验结果表明,BMP-7参与肝纤维化的发生、发展过程,但BMP-7影响TGF-β/Smad通路的具体作用位点,拮抗肝纤维化的具体机制尚需值得进一步探索,有待于我们更多的研究。
1 Tsukada S,Parsons CJ,Rippe RA.Mechanisms of liver brosis[J].Clinica Chimica Acta,2006,364(1 -2):33 -60
2 Friedman SL.Molecular mechanisms of hepatic fibrosis and principles of therapy[J].Gastroenterol,1997,32(3):424 -430
3 Heldin CH,Miyazono K.TGF-βsignaling from cell membrane to nucleus through SMAD proteins[J].Nature,1997,390(6659):465 -471
4 Weiskirchen R,Meurer SK,Gressner OA,et al.BMP -7 as antagonist of organ fibrosis[J].Front Biosci,2009,14:4992 - 5012
5 Chen D,Zhao M,Mundy GR.Bone morphogenetic proteins[J].Growth Factors,2004,22(4):233 -241
6 Wang SE,Wu FY,Shin I,et al.Transforming growth factor β(TGF -β)-Smad target gene protein tyrosine phosphatase receptor type kappa is required for TGF - β function[J].Mol Cell Bio1,2005,25(11):4703-4715
7 Schnabl B,Kweon YO,Frederick JP,et al.The role of Smad in mediating mouse hepatic stellate cell activation[J].Hepatology,2001,34:89-110
8 Gould SE,Day M,Jones SS,et al.BMP -7 regulates chemokine,cytokine,and hemodynamic gene expression in proximal tubule cells[J].Kidney Int,2002,61(1):51 -60
9 Marumo T,Hishikawa K,Yoshikawa M,et al.Epigenetic regulation of BMP7 in the regenerative response to ischemia[J].J Am Soc Nephrol,2008,19(7):1311 -1320

