二烯丙基二硫诱导人胃癌MGC803细胞分化的差异蛋白质分析
刘 瑶,向姝霖,袁静萍,3,何 洁,谢锦云,陈 平,梁宋平,苏 琦
(1.南华大学肿瘤研究所,湖南省高校肿瘤细胞与分子病理学重点实验室,湖南衡阳 421001;2.湖北省疾病预防控制中心食品药品安全性评价研究所,湖北武汉 430079;3.武汉市中心医院病理科,湖北武汉 430014;4.湖南师范大学生命科学学院,湖南长沙 410081)
胃癌是最常见恶性肿瘤之一,发生率与死亡率分别占全球恶性肿瘤的8%与10%,而我国胃癌死亡率为25.2/10万,占恶性肿瘤的23.2%,是欧美发达国家的4.2~8.0倍[1-2]。二烯丙基二硫(diallyl disulfide,DADS)是大蒜的一种脂溶性有效成分,对肺癌、乳腺癌、结肠癌和白血病等肿瘤均有明显的抑制作用,是一种有开发潜力的抗肿瘤药物[3-6]。我们先前的研究证实,DADS可体内外明显抑制人胃癌细胞增殖与诱导向正常细胞分化,但其分子机制尚未完全阐明[7]。本文研究DADS诱导人胃癌MGC803细胞分化过程中蛋白质的差异表达,进一步寻找胃癌分化的相关蛋白质及肿瘤相关标记物,为胃癌的诊断和治疗提供靶点。
1 材料与方法
1.1 材料
1.1.1 细胞培养 MGC803细胞(山东师范大学生物系建株,为人胃低分化粘液腺癌,本实验室保存)用含体积分数为10%小牛血清的RPMI1640培养基,37℃、5%CO2温箱中培养。取对数生长期细胞用于实验。
1.1.2 试剂 DADS为Fluka公司产品(d420=1.0,
Mr 146.28);小牛血清为杭州四季青公司产品;RPMI1640培养基为Gibco公司产品;二硫苏糖醇、尿素、CHAPS、固相pH梯度干胶条(IPG strip pH 3~10,18 cm)、IPG 缓冲液(pH 3 ~10)、覆盖液、蛋白银染试剂盒、低分子量标准蛋白质购自Amersham Biosciences公司;丙烯酰胺、甲叉双丙烯酰胺、Tris、SDS、甘氨酸、硫代硫酸钠、碳酸氢氨、胰蛋白酶、PMSF、甘油等购自上海生工;乙腈为国产色谱纯;TPCK处理的胰蛋白酶、基质α-羟基肉桂酸、碘乙酰胺、三氟乙酸、铁氰化钾等购自Sigma公司。
1.1.3 仪器 IPGphor等电聚焦仪为Pharmacia公司产品;Voyager-DETM STR-MALDI-TOF-MS质谱仪为Applied Biosystem公司产品;垂直电泳仪、PDQuest软件为Bio-Rad公司产品;Speedvac公司的冷冻干燥离心机;Sigma公司的超速低温离心机;清华紫光的凝胶扫描仪。
1.2 方法
1.2.1 细胞总蛋白的制备 30 mg·L-1的DADS处理24 h后,4℃预冷的PBS洗涤3次,吸净PBS,加入细胞裂解液(8 mol·L-1urea+4%CHAPS+40 mmol·L-1Tris+1%DTT+1 mmol·L-1PMSF+0.5%IPG buffer pH 3~10)冰盒上4℃静置30 min,用细胞刮匙刮取并收集裂解液,15 000 r·min-14℃离心15 min,取少量上清液用Bradford法测定总蛋白质的浓度,其余上清液置-80℃冰箱内保存备用。
1.2.2 第一向固相pH梯度等电聚焦 将含细胞总蛋白200 μg提取液与水化液(8 mol·L-1urea+4%CHAPS+18 mmol·L-1DTT+0.5%IPG buffer pH 3~10+痕量溴酚蓝)充分混合,以总体积350 μl加入IPG胶槽。将IPG干胶条去保护膜后胶面朝下,置入胶槽中,驱除气泡,并覆盖一层石蜡油,置于IPGphor等电聚焦仪的电极板上,水化和聚焦在20℃自动进行,总电压为37 920 Vh,其中在30 V水化 14 h,500 V 1 h,1 000 V 1 h,8 000 V 4 h 30 min。等电聚焦结束后立即取出IPG胶条分别于20 ml平衡液 A(50 mmol·L-1Tris-HCl pH 6.8+6 mol·L-1urea+30%甘油+1%SDS+0.2%DTT)和20 ml平衡液B(50 mmol·L-1Tris-HCl pH 6.8+6 mol·L-1urea+30%甘油+1%SDS+3%碘乙酰胺+痕量溴酚蓝)中各平衡15 min。
1.2.3 第二向垂直SDS-PAGE电泳 在灌好的SDS-PAGE胶面上加入1%的琼脂糖,然后将平衡后的胶条面朝外转移至胶的顶部,并且避免气泡产生,在胶的一端放入吸有低分子量Marker的滤纸片,安装好电泳槽后先用250 V 25mA电泳,待溴酚蓝迁移至浓缩胶(4.8%)和分离胶(12.5%)的界面时,换用500 V 50mA电泳至溴酚蓝前端到达底部约1 cm处停止电泳。整个过程用12℃循环水冷却。
1.2.4 蛋白质银染 按照蛋白质银染试剂盒的操作手册进行适当修改,依次经过固定(40%乙醇+10%冰乙酸)30 min;敏化(30%乙醇+0.2%硫代硫酸钠+6.8%乙酸钠);洗涤3次,每次5 min;银染(0.25%硝酸银)20 min;洗涤2次,每次1 min;显影(2.5%碳酸钠+0.0074%甲醛)2~5 min至斑点清晰为止;最后加入1.46%EDTA-Na2·H2O终止10 min。凝胶经扫描后用保鲜膜4℃保存。
1.2.5 凝胶图像分析 将经过银染的凝胶通过扫描成像,用PDQuest软件对图像进行背景消减、斑点检测、斑点匹配、量化等分析。
1.2.6 质谱样品的制备 在凝胶上选取重复性好、边界清楚的差异蛋白质点,切割后放入1.5 ml的Eppendorf管中用100 mmol·L-1硫代硫酸钠和30 mmol·L-1铁氰化钾(1 ∶1)脱色,100 mmol·L-1的碳酸氢铵+10 mmol·L-1的DTT于57℃还原1 h,再用100 mmol·L-1的碳酸氢铵 +55 mmol·L-1碘乙酰胺烷基化30 min,用 TPCK-处理的胰蛋白酶(100 g/700 L)37℃ 酶解 28 h,加入 100 μl 0.1%TFA震荡混匀,12 000 r·min-1离心5 min,取上清用Millipore公司的ZipTipTMC18微柱进行脱盐,与饱和的CCA基质液混合,点样于不锈钢点样板上,空气中自然干燥后准备上质谱分析。
1.2.7 质谱分析 样品置Voyager-DETMSTR-MALDI-TOF-MS质谱仪上分析,采用线性模式,正离子谱测定,离子源加速电压1为20 kV,加速电压2为18.85 kV,N2激光波长为337 nm,脉冲宽度为3 ns,离子延迟提取100 ns,真空度4×10-7Torr,质谱信号单次扫描累加50次,并用基质峰和胰蛋白酶自动降解离子峰作为内标校正质谱峰,获得肽质量指纹图。
1.2.8 生物信息学分析 将获得的肽质量指纹图数据通过 MS-FIT软件上 http://prospector.ucsf.edu/ucsfhtml3.4/masfit.htm、http://www.expasy.ch及http://www.ncbi.nlm.nih.gov网站进行查询。
1.2.9 统计学分析 实验数据均采用Student T-test法进行分析,数值用±s表示。
2 结果
2.1 DADS处理MGC803细胞总蛋白质的双向电泳银染图谱 Fig 1是DADS处理MGC803细胞前后的总蛋白质的双向电泳银染图谱。经扫描成像及PDQuest软件分析,对照组与处理组蛋白质点数分别为(576±14)个与(583±4)个。蛋白质点与参考胶的匹配结果,对照组与处理组平均匹配点分别为(434±24)个与(413±8)个(n=3),其平均匹配率分别为76%和70%。
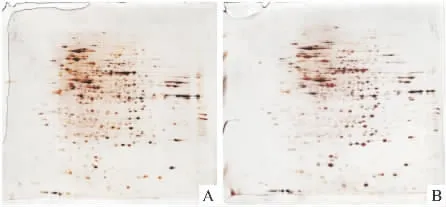
Fig 1 Images of 2DE of MGC803 cells proteome treated with DADS stained by silver
2.2 DADS处理MGC803细胞总蛋白质的双向电泳银染图谱的差异点分析 经PDQuest软件进行匹配分析,在两组图谱中有421个蛋白质斑点匹配,有200个点未匹配,其中与对照组相比相差2倍以上的有291个,相差10倍以上的有61个(Fig 2)。

Tab 1 Upregulated proteins of differentiation in MGC803 cells induced by DADS
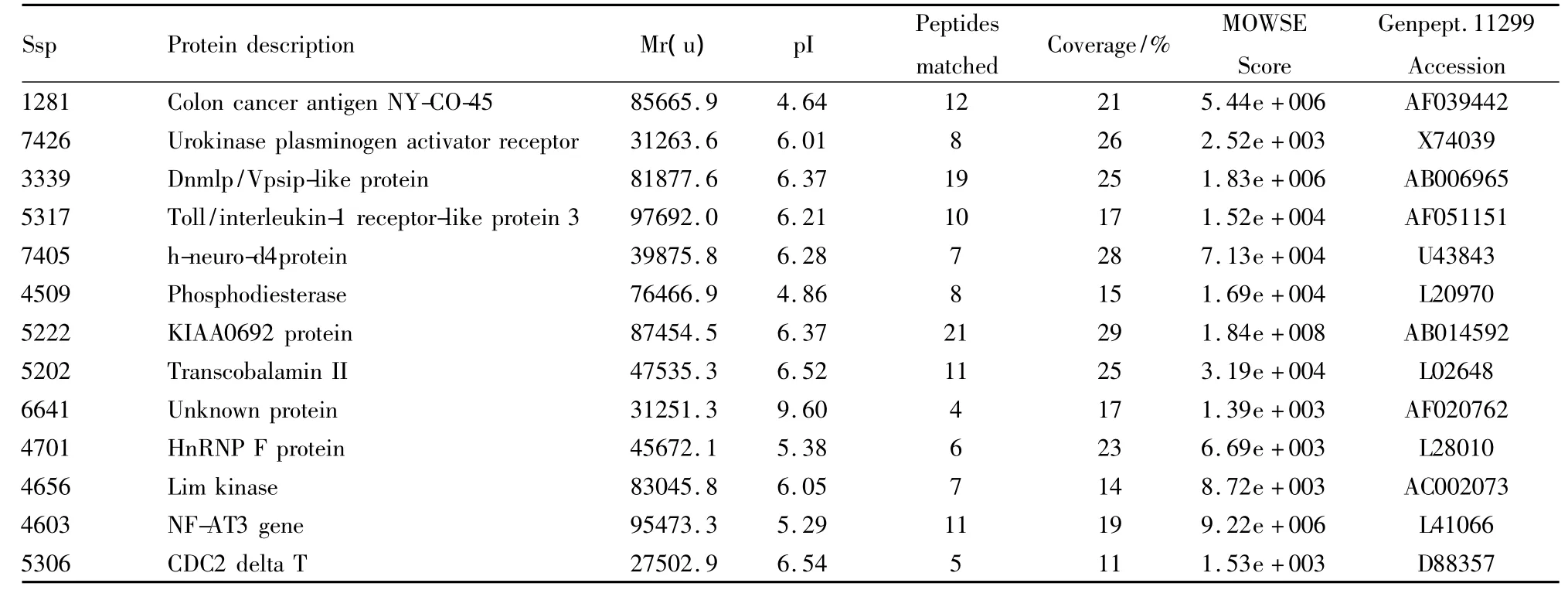
Tab 2 Downregulated proteins of differentiation in MGC803 cells induced by DADS
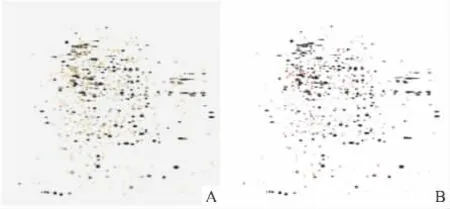
Fig 2 Matching spots in treated and untreated MGC803 cells by DADS
2.3 差异蛋白质点的原位酶解和质谱分析 从PDQuest软件分析的差异点中选取部分重复性好、界限清楚的蛋白质点进行原位酶解后上质谱测定其肽质量指纹图谱,并经MS-FIT软件搜索相关数据库,初步鉴定结果有24个蛋白质点(Fig 3、4,Tab 1、2)。
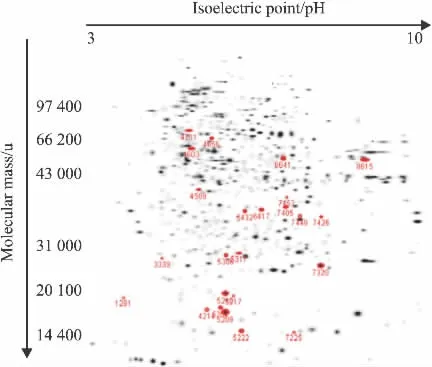
Fig 3 Distribution of 24 disparate points analyzed by PDQuest software
3 讨论
我们已证实,DADS可抑制人胃癌MGC803细胞增殖,诱导ALP比活性与Con A凝集率下降,细胞骨架蛋白合成增加与重组,细胞GJIC恢复,细胞异型性下降,表面微绒毛减少,核变小,核浆比降低,常染色质增加,异染色质减少,具有向正常细胞分化倾向。机制与 G2/M阻滞,调节 ATR/Chk1/Cdc25C/cyclin B1、激活p38、抑制 ERK/AP-1通路,上调组蛋白乙酰化、p21 WAF1等有关[7-10]。
Fig 4 Peptide mass fingerprinting of differential expression proteins
采用蛋白质组学技术是寻找疾病相关蛋白质、发现疾病标志分子的有效途径。本研究在DADS诱导人胃癌MGC803细胞分化过程中,发现24个与细胞分化、肿瘤转移、细胞凋亡、细胞周期、细胞免疫及代谢等相关的蛋白质,其中,gastric mucin、nM23、RORα、MHC DR-beta-1 chain、TCR 等上调,CDC2、uPAR、LIMK等下调。
CDC2(CDK1)是一种细胞周期依赖性蛋白激酶,CDK1与Cyclin B1复合物的活化是G2期进入M期的必要条件。我们已经证实,DADS阻滞MGC803细胞在G2/M期与影响CDK1/cyclin B1复合物形成有关[8,10]。本实验发现 DADS 处理的MGC803细胞CDC2表达下调,进一步验证上述结论。
胃粘膜蛋白MUC5AC是胃粘膜上皮分化的重要标志。研究证明,MUC5AC在正常胃粘膜高表达,而胃癌表达降低,且与侵袭与转移相关,提示MUC5AC可作为胃癌进展的重要预后参数[11]。本研究显示,DADS可上调MGC803细胞胃粘液蛋白,表明DADS可诱导胃低分化粘液癌细胞向正常胃粘膜分化。
nM23是一种抑制肿瘤转移因子。大量研究表明nM23表达与肿瘤的转移、分级、预后等密切相关。本实验结果表明经DADS处理的nM23蛋白表达上调,胃癌细胞的转移性下降。
RORα是核受体超家族中的一员,广泛分布于机体各组织,具有多种重要的生理功能。近年来,RORα在肿瘤中的作用成为研究的热点之一。本研究显示,DADS可上调RORα。研究表明,nm23等基因的启动子存在RORα反应元件,RORα磷酸化可通过削弱Wnt/β-catenin信号途径,发挥抑制肿瘤作用。因此,RORα具有重要的抗肿瘤作用,是肿瘤治疗的一个可能的潜在靶点[12]。
uPAR是一种糖基磷脂酰肌醇锚定的蛋白质,与uPA结合可调控ECM蛋白水解,活化Src、FAK、Rac、ERK/MAPK和JAK/STAT等信号途径,在细胞增殖、侵袭和转移起着重要作用。近年来,发现uPAR在肿瘤趋向性、上皮-间质转变与胞葬作用等具有新功能,并可能成为治疗肿瘤的靶点[13]。本研究显示DADS可下调uPAR,推测DADS可能通过减少uPAR表达而抑制胃癌的迁移与侵袭。
LIMK家族主要有LIMK1和LIMK2,在肿瘤迁移侵袭过程中起着非常重要的作用。LIMK1可通过Rho-ROCK1/PAK1-LIMK1-Cofilin通路,影响肌动蛋白细胞骨架结构以及细胞形态、黏附与侵袭转移。LIMK1在许多肿瘤组织中高表达并参与肿瘤生长、血管形成及迁移侵袭过程[14]。本研究显示,DADS能下调MGC803细胞LIMK,可能与抑制胃癌侵袭转移有关。我们已证明,DADS可抑制人结肠癌细胞迁移、侵袭与下调 LIMK1有关[15]。
在免疫应答过程中,由MHC-抗原肽-TCR三分子复合物传递抗原信息,启动T细胞激活和免疫应答,MHC是TCR的配体。Toll/Interleukin-1 receptor-like3(TLR3)可通过激活NF-kappaB参与免疫调节。本研究显示,DADS可上调MGC803细胞HLADR-beta-1与TCR,下调 TLR 3,表明 DADS可能通过增强免疫效应,发挥抗肿瘤的作用。
此外,本研究在DADS诱导MGC803细胞分化中还发现下调CA antigen NY-CO-45、Dnmlp/Vpsiplike protein、h-neuro-d4 protein、phosphodiesterase、KIAA0692 protein、transcobalamin Ⅱ、HnRNP F protein、NF-AT3及一种未知蛋白,上调X-linked inhibitor of apotosis、proteinkinase、Malate dehydrogenase precursor、Kruppel-related zinc finger protein、Snake venomlike protease与endothelial cell protein C/APC receptor等16个蛋白,作用机制尚需进一步研究。
综上所述,DADS诱导MGC803细胞分化中有许多不同功能的蛋白质从多种途径参与了这一过程。尚需进一步对其它差异蛋白质点进行鉴定与确证,以筛选并获得与胃癌分化相关的分子标志物,为进一步发现相关标记物以及胃癌的诊断和治疗提供靶点。
[1]孙秀娣,牧 人,周有尚,等.中国胃癌死亡率20年变化情况分析及其发展趋势预测[J].中华肿瘤杂志,2004,26(1):4-9.
[1]Sun X D,Mu R,Zhou Y S,et al.Analysis of mortality rate of stomach caner and its trend in twenty years in China[J].Chin J Oncol,2004,26(1):4-9.
[2]Jemal A,Bray F,Center M M,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[3]Hui C,Jun W,Ya L N,et al.Effect of Allium sativum(garlic)diallyl disulfide(DADS)on human non-small cell lung carcinoma H1299 cells[J].Trop Biomed,2008,25(1):37-45.
[4]Lei X Y,Yao S Q,Zu X Y,et al.Apoptosis induced by diallyl disulfide in human breast cancer cell line MCF-7[J].Acta Pharmacol Sin,2008,29(10):1233-9.
[5]Huang Y S,Xie N,Su Q,et al.Diallyl disulfide inhibits the proliferation of HT-29 human colon cancer cells by inducing differentially expressed genes[J].Mol Med Report,2011,4(3):553-9.
[6]Yi L,Ji X X,Lin M,et al.Diallyl disulfide induces apoptosis in human leukemia HL-60 cells through activation of JNK mediated by reactive oxygen[J].Pharmazie,2010,65(9):693-8.
[7]Ling H,Zhang L Y,Su Q,et al.Erk is involved in the differentiation induced by diallyl disulfide in the human gastric cancer cell line MGC803[J].Cell Mol Biol Lett,2006,11(3):408-23.
[8]Yuan J P,Wang G H,Ling H,et al.Diallyl disulfide-induced G2/M arrest of human gastric cancer MGC803 cells involves activation of p38 MAP kinase pathways[J].World J Gastroenterol,2004,10(18):2731-4.
[9]向姝霖,肖晓岚,苏 琦,等.DADS体内诱导人胃癌细胞分化作用中组蛋白乙酰化的变化[J].中国药理学通报,2006,22(1):55-9.
[9]Xiang S L,Xiao X L,Su Q,et al.Role of histone acetylation in the differentiation of human gastric cancer cell induced by DADSin vivo[J].Chin Pharmacol Bul,2006,22(1):55-9.
[10]Ling H,Wen L,Ji X X,et al.Growth inhibitory effect and Chk1-dependent signaling involved in G2/M arrest on human gastric cancer cells induced by diallyl disulfide[J].Braz J Med Biol Res,2010,43(3):271-8.
[11]Ilhan Ö,Han Ü,Önal B,Celik S Y.Prognostic significance of MUC1,MUC2 and MUC5AC expressions in gastric carcinoma[J].Turk J Gastroenterol,2010,21(4):345-52.
[12]赵晓红,苏 琦.维甲酸相关孤核受体α与Wnt信号途径及肿瘤的关系[J].国际病理科学与临床杂志,2011,31(3):234-7.
[12]Zhao X H,Su Q.Retinoid acid receptor related orphan receptor α and Wnt signaling pathway and tumor[J].Inter J Pathol Clin Med,2011,31(3):234-7.
[13]冯梅燕,廖前进,苏 琦.uPAR与肿瘤的研究新进展[J].国际病理科学与临床杂志,2011,31(1):49-53.
[13]Feng M Y,Liao Q J,Su Q.Advance in research on UPAR and tumor[J].Inter J Pathol Clin Med,2011,31(1):49-53.
[14]马艳华,史 玲,苏 琦.LIM激酶与肿瘤[J].国际病理科学与临床杂志,2009,29(6):490-3.
[14]Ma Y H,Shi L,Su Q.LIM kinase and tumor[J].Inter J Pathol Clin Med,2009,29(6):490-3.
[15]史 玲,苏 坚,廖前进,等.二烯丙基二硫下调LIMK1抑制人结肠癌SW480细胞迁移与侵袭[J].中国药理学通报,2011,28(2):200-5.
[15]Shi L,Su J,Liao Q J,et al.Diallyl disulfide inhibits migration and invasion in human Colon cancer SW480 cells by downregulating expression of LIMK1[J].Chin Pharmacol Bul,2011,28(2):200-5.

