黄芪注射液对脑缺血/再灌注大鼠海马组织JNK-3表达的影响
刘莎莎,高维娟,钱 涛,张 霞
(1.承德医学院病理生理学教研室,河北承德 067000;2.河北化工医药职业技术学院,河北石家庄 050026)
缺血性脑血管疾病是临床常见且严重威胁人类健康的一类疾病,其中脑缺血/再灌注损伤(ischemia-reperfusion injury,IRI)是缺血性脑血管病发病的重要病理生理过程。在缺血性脑血管疾病的发生发展过程中,细胞凋亡是神经元损伤的发生机制之一,其中c-Jun氨基末端激酶(c-Jun N terminal kinase,JNK)信号通路在脑缺血/再灌注损伤过程中尤其是程序性细胞死亡过程中发挥着重要的调控作用[1]。黄芪注射液(astragalus injection)为临床治疗缺血性脑血管病的常用药物,可抑制细胞凋亡的发生[2]。本课题组前期实验也证实黄芪注射液可抑制全脑缺血/再灌注大鼠海马神经元凋亡,并且对离体培养的缺氧缺糖/复氧复糖大鼠海马神经元凋亡有抑制作用[3],但黄芪注射液是否通过抑制JNK信号通路上的关键激酶JNK3而起作用,尚未见报道。本研究通过建立全脑缺血/再灌注大鼠模型观察黄芪注射液对脑缺血/再灌注大鼠海马组织JNK3蛋白及其mRNA表达的影响,探讨黄芪注射液抑制细胞凋亡的分子机制。
1 材料与方法
1.1 实验动物 SPF级健康♂ SD大鼠258只,体重(220~280)g,由天津山川红实验动物科技有限公司提供,许可证号:SCXK(津)2009-0001。
1.2 试剂和仪器 兔抗大鼠JNK3多克隆抗体购自美国Bioworld公司;兔抗大鼠JNK3单克隆抗体购自美国Cell Signaling公司;小鼠抗大鼠β-actin购自美国Santa Cruz公司;免疫组化试剂盒购自北京中杉金桥公司;JNK3引物由上海基康生物技术有限公司设计合成;TRIzol购自美国Invitrogen公司;RTPCR试剂盒购自大连宝生物公司;BCA蛋白定量试剂盒购自北京索莱宝科技有限公司;HRP-DAB底物显色试剂盒购自北京天根生化科技有限公司;黄芪注射液由成都地奥九泓制药厂生产,20 ml/支(每1 ml相当于 2 g生药),生产批号:国药准字Z51021776;其它试剂为国产分析纯。TDL-40B离心机:上海安亭科学仪器制造厂产品;DYY-6B型稳压稳流电泳仪:北京六一仪器厂产品;光学显微镜:日本OLYMPUS公司生产;石蜡切片机:德国LEICA公司生产。
1.3 实验分组 SD大鼠适应性饲养1周后随机分为4组:假手术组、模型组、黄芪注射液组和黄芪注射液溶剂对照组,各组根据再灌注后不同时间点再分为0、0.5、2、6、24、72 h 和120 h 7 个亚组,每个亚组12只动物。
1.4 模型制备 采用改良的Pulsinelli’s 4VO(four vessel occlusion,4vo)法制备脑缺血/再灌注动物模型:大鼠于术前12 h禁食,4 h禁水,4%水合氯醛腹腔注射麻醉。将大鼠俯卧位固定于固定台上,在枕骨后切开皮肤,逐层钝性分离暴露双侧第1颈椎横突翼小孔,用直径0.5 mm的电凝针烧灼双侧翼小孔内的椎动脉,造成永久性闭塞,缝合切口。24 h后将大鼠乙醚麻醉,仰卧固定,行腹侧颈正中切口,分离双侧颈总动脉,以“4”号丝线穿线备用,待大鼠清醒后用微型动脉夹夹闭双侧颈总动脉造成脑缺血,30 min后松开微动脉夹恢复血流,缝合切口。模型成功标准为:双侧颈总动脉夹闭后1 min内动物意识丧失;眼球变白,双侧瞳孔散大,对光反射消失;翻正反射消失。凡不符合上述标准者或再灌注期间出现全身强直、抽搐等异常反应或死亡者都被视作不成功。假手术组只做皮肤切口和组织分离。黄芪注射液组缺血前30 min腹腔注射黄芪注射液[12 g(生药)·kg-1],其中 24、72、120 h 组手术后每隔24 h追加给药1次,以确保稳定的血药浓度。黄芪注射液溶剂对照组腹腔注射与黄芪注射液等量的无菌去离子水。
1.5 标本制备 于再灌注后的相应时点从每组大鼠中随机选取6只,4%水合氯醛腹腔注射麻醉,4%多聚甲醛灌注固定,取视交叉后4 mm与小脑前之间的部分即海马脑组织,自动脱水机脱水,石蜡包埋,冠状切片,制成4 μm厚连续切片;其余各组大鼠4%水合氯醛腹腔麻醉后,迅速断头处死,在低温修块台上分离出双侧海马组织,置于Eppendorf管中,-80℃保存,备用。
1.6 HE染色观察大鼠海马CA1区病理学改变
脑缺血/再灌注后120 h从各组大鼠中取6只大鼠的海马组织切片进行HE染色,光镜下观察海马CA1区病理学改变。
1.7 免疫组化法检测海马组织JNK3的表达 从每组大鼠中取6只大鼠的海马组织切片,采用SP法检测JNK3的表达,具体操作依据试剂盒说明书进行。兔抗大鼠JNK3多克隆抗体按1∶75稀释;PBS代替一抗作阴性对照。选用Med6.0软件测定阳性反应物灰度值:在切片的海马CA1区各选取3个测量点,首先测定各点的颗粒细胞层灰度值,再用该测量值减去相应的背底灰度值后求平均值,即为大鼠海马CA1区JNK3表达的免疫反应灰度值。
1.8 Western blot法检测海马组织JNK3蛋白表达 从每组取6只大鼠的海马组织(-80℃保存),提取总蛋白,用BCA法进行蛋白定量,取25 μg样品,以12%的SDS聚丙烯酰胺凝胶电泳分离,分离的蛋白用半干电转移法转移到PVDF膜上,5%BSA封闭过夜,兔抗大鼠JNK3单克隆抗体(1∶1 000稀释),4℃摇床孵育2 h。山羊抗兔二抗(1∶5 000稀释),4℃摇床孵育1 h。洗膜后,采用化学发光法显色,用凝胶分析软件Quantity one进行定量分析。
1.9 RT-PCR法检测海马组织JNK3 mRNA的表达 从每组取6只大鼠的海马组织(-80℃保存),用TRIzol一步法提取RNA,按TaKaRa RNA PCR kit(AMV)说明逆转录为cDNA。内参照GAPDH引物序列上游 5'-TGGTCTACATGTTCCAGTATGACT-3',下游5'-CCATTTGATGTTAGCGGGATCTC-3',扩增片段长度为134 bp,JNK3引物序列上游5'-CGGATTCCGAGCACAATAAAC-3',下 游 5'-AGGGTCGTACCAAACGTTGATGT-3',扩增片段长度为137 bp。扩增条件:95℃预变性3 min;94℃ 30 s;56℃ 30 s;72℃ 40 s,循环30次;最后于72℃延伸3 min。用2%琼脂糖凝胶电泳鉴定PCR产物,实验重复6次。用凝胶分析软件Quantity one进行定量分析。
2 结果
2.1 HE染色观察大鼠海马CA1区病理学改变HE染色结果显示:假手术组组织形态无异常改变,海马CA1区神经元排列整齐,均匀,细胞结构完整;而模型组大鼠海马组织出现明显的病理改变,镜下可见海马CA1区神经元排列紊乱,界限不清楚,正常细胞结构消失,固缩成三角形或不规则型;与模型组相比,黄芪注射液组病理变化得到一定程度的改善,海马神经元排列较整齐,细胞结构较完整,而黄芪注射液溶剂对照组则无明显改变,见Fig 1。
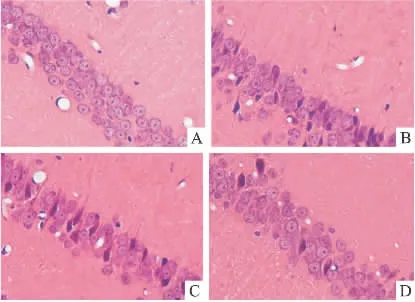
Fig 1 Pathological changes in hippocampus CA1 zone of rats 120 h after cerebral ischemia reperfusion in different groups(×400)
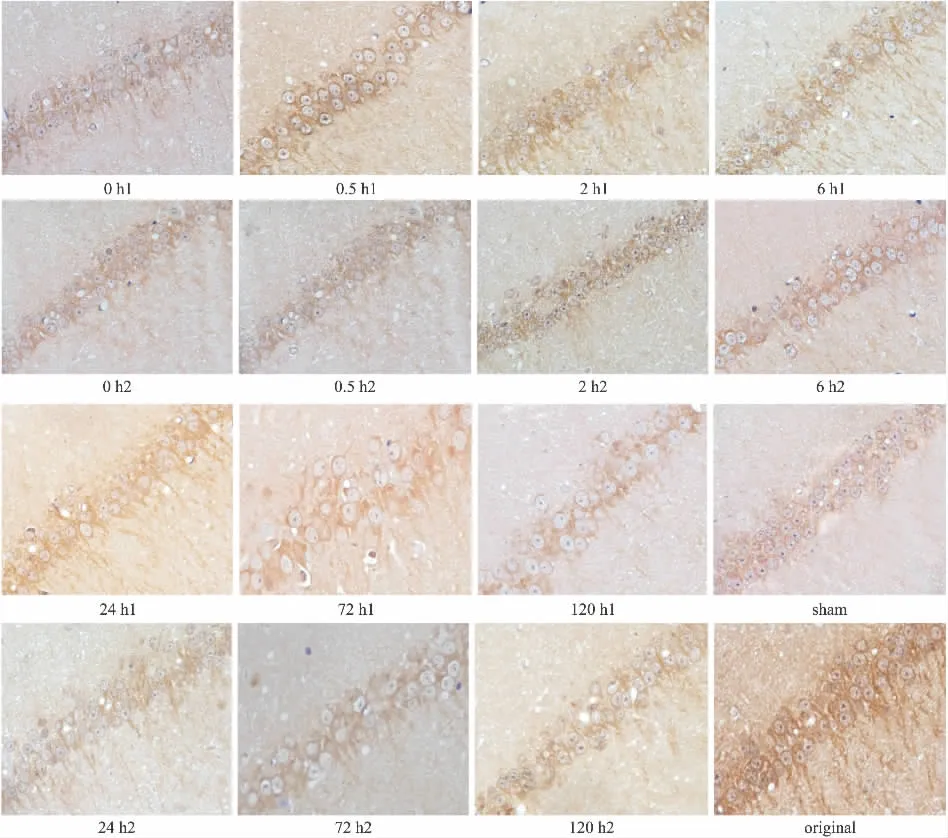
Fig 2 Effect of astragalus injection on expression of JNK3 protein in hippocampus of cerebral ischemia reperfusion rats(×400)
2.2 免疫组化法检测海马组织JNK3蛋白表达免疫组化染色结果:阳性反应为胞质黄染,胞核内有少许棕黄色颗粒。与假手术组比,模型组于再灌注0、0.5、2、6、24 h 和72 h JNK3 的表达均明显增高(P<0.05),120 h组与假手术组比差异无显著性(P>0.05);与模型组比,除120 h外,黄芪注射液组各时间点JNK3的表达均降低(P<0.05),而黄芪注射液溶剂对照组无差异(P>0.05),见Fig 2、Fig 3。
2.3 黄芪注射液对脑缺血再灌注大鼠海马组织JNK3蛋白表达的影响 Western blot实验结果显示:除120 h外,与假手术组比模型组各时间点JNK3蛋白表达平均灰度值均增高(P<0.05);与模型组比,黄芪注射液组除120 h外的各时间点JNK3蛋白表达灰度值均降低(P<0.05),而黄芪注射液溶剂对照组则无差异(P>0.05),见Fig 4、5。
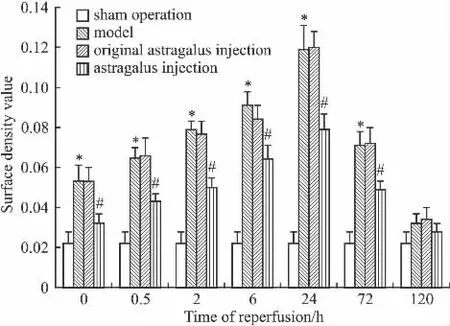
Fig 3 Effect of astragalus injection on surface density value of JNK3 protein in hippocampus of cerebral ischemia reperfusion rats(±s,n=6)
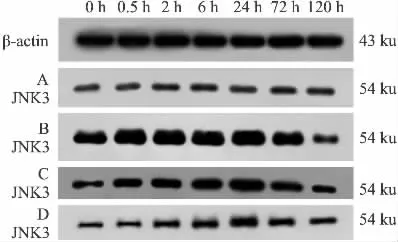
Fig 4 Effect of astragalus injection on expression of JNK3 protein in hippocampus of cerebral ischemia reperfusion rats
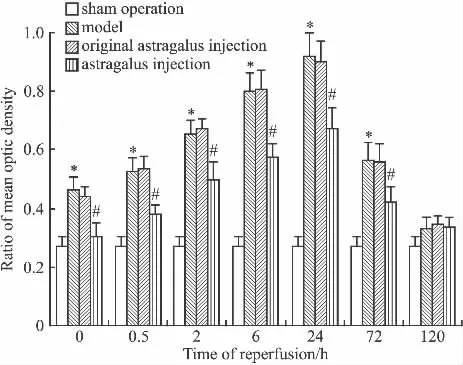
Fig 5 Effect of astragalus injection on mean optic density of JNK3 protein in hippocampus of cerebral ischemia reperfusion rats(±s,n=6)
2.4 黄芪注射液对脑缺血/再灌注大鼠海马组织JNK3 mRNA表达的影响 RT-PCR结果显示:JNK3 mRNA表达同JNK3蛋白表达趋势相一致,见Fig 6、7。
3 讨论
脑缺血后恢复脑血流是治疗脑缺血最关键的方法,但再灌注后可加重缺血脑组织的损伤,而这种损伤以细胞凋亡为主。王凤章等报道[4-5],细胞凋亡是颞叶CA1区神经细胞缺血/再灌注后的主要死亡形式。细胞凋亡的发生需要一个把细胞外刺激信号转导至细胞核内部的传递者,而JNK信号转导通路在这一过程中发挥着重要的作用[6]。
Fig 6 Effect of astragalus injection on expression of JNK3 mRNA in hippocampus of cerebral ischemia reperfusion rats
c-jun氨基末端激酶(JNKs)家族是MAPKs家族成员之一,属于进化上保守的丝氨酸/苏氨酸蛋白激酶。在脊椎动物,有3种编码JNK的基因jnk-1、jnk-2和 jnk-3[7],其相应的编码产物 JNK1和 JNK2在各种组织细胞中广泛表达,而JNK3则主要表达于脑组织[8]。在钙离子超载、氧自由基等应激刺激下,位于胞质中的JNK3被激活后迅速转位入胞核,调节c-jun等凋亡相关的转录因子。JNK可调控ATF2内在的组蛋白乙酰基转移酶活性和泛素介导的AP-1蛋白降解,提高转录因子的稳定性[9],从而引发JNK下游底物caspase等的凋亡级联反应。
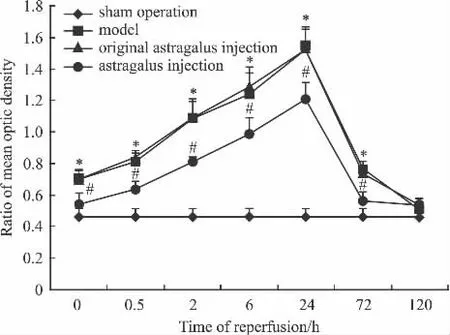
Fig 7 Effect of astragalus injection on mean optic density of JNK3 mRNA in hippocampus of cerebral ischemia reperfusion rats(±s,n=6)
黄芪是中医治疗脑血管病的常用药物,药理学研究表明黄芪能明显提高脑缺血/再灌注大鼠脑组织内超氧化物歧化酶(SOD)、一氧化氮合酶(NOS)和一氧化氮(NO)含量,清除氧自由基,增加微循环灌注等,从而有效对抗脑缺血/再灌注损伤[10]。黄芪注射液为中药黄芪提取物制成的针剂,具有益气养元、扶正祛邪、通脉养心、健脾利湿等功效。赖真等[11]研究表明黄芪注射液能减少大鼠脑缺血/再灌注后的神经元凋亡。
本实验采用4VO法建立脑缺血/再灌注大鼠模型,HE染色观察海马组织病理学改变,并分别从蛋白和基因水平观察黄芪注射液对脑缺血/再灌注大鼠海马组织JNK3表达的影响。实验结果显示:脑缺血/再灌注后120 h模型组出现明显的病理改变,表明4VO法可成功模拟脑缺血/再灌注损伤。免疫组化结果显示:假手术组可见JNK3轻度表达,且主要位于胞质,而模型组可在胞质及胞核内同时发现JNK3阳性产物的表达,提示脑缺血/再灌注后,激活的JNK3发生核转位,进而通过激活一系列下游转录因子介导神经元凋亡。黄芪注射液可明显降低脑缺血再灌注后 0、0.5、2、6、24 h和 72 h各时间点JNK3蛋白及mRNA的表达,表明黄芪注射液可抑制脑缺血/再灌注大鼠海马组织JNK3 mRNA表达,从而减少JNK3蛋白表达,从而抑制神经元凋亡,这可能是其对脑缺血/再灌注损伤起保护作用的分子机制之一。实验发现脑缺血/再灌注120 h组JNK3的表达与假手术组比差异无显著性,说明黄芪注射液在脑损伤的早期用药疗效较好。
[1]闫凤霞,高维娟,钱 涛,等.黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元caspase-3表达的影响[J].中国药理学通报,2010,26(7):898-903.
[1]Yan F X,Gao W J,Qian T,et al.The effect of astragalus injection on the expression of caspase-3 after hypoxia/hypoglycemia and reoxygenation in hippocampal neurons of rats[J].Chin Pharmacol Bull,2010,26(7):898-903.
[2]李维祖,明 亮,何 婷,等.黄芪提取物对大鼠海马神经元迟发性死亡的影响[J].中国药理学通报,2005,21(5):584-7.
[2]Li W Z,Ming L,He T,et al.Effects of extract of astragalus on hippocampal delayed neuronal death in rats[J].Chin Pharmacol Bull,2005,21(5):584-7.
[3]张雅丽,高维娟,闫凤霞,等.黄芪注射液抑制缺氧缺糖后复氧复糖大鼠海马神经细胞凋亡的研究[J].中国老年学杂志,2009,29(7):793-6.
[3]Zhang Y L,Gao W J,Yan F X,et al.Astragalus inhibition after oxygen-glucose deprivation and reoxygenation of rat hippocampus complex sugar apoptosis[J].China Gerontol J,2009,29(7):793-6.
[4]王凤章,李 巍.小鼠颞叶缺血再灌注后海马CAl区细胞凋亡及行为学实验研究[J].中国临床康复,2002,6(9):2861-2.
[4]Wang F Z,Li W.Study of neurocyte apoptosis of rats hippocampus CA1 zone[J].Chin J Clin Rehabil,2002,6(9):2861-2.
[5]Zhao J,Pei D S,Zhang Q G,et al.Down-regulation Cde42 attenuates neuronal apoptosis through inhibiting MLK3/JNK3 cascade during ischemic reperfusion in rat hippocampus[J].Cell Signal,2007,19(4):831-43.
[6]Kuan C Y,Whitmarsh A J,Yang D D,et al.A critical role of neural specific JNK3 for ischemia apoptosis[J].Proc Natl Acad Sci USA,2003,100(25):15184-9.
[7]Bogoyevitch MA.The isform-specific functions of the c-jun N terminal kinases(JNKs):differences revealed by gene targeting[J].Bioessays,2006,28(9):923-34.
[8]Ye D Q,Gao W J,Yan F X,et al.Astragalus injection inhibits c-Jun N terminal kinase mRNA expression following oxygen-glucose deprivation and reintroduction in rat hippocampal neurons[J].Neural Regen Ras,2009,4(11):879-84.
[9]Praveen K R,Farzana R,Jack B,et al.Role of the JNK signal transduction pathway in inflammatory bowel disease[J].World J Gastroenterol,2008,4(2):200-2.
[10]陈晓春,薛 茜.大鼠脑缺血再灌注损伤及黄芪对脑细胞保护作用的实验研究[J].陕西医学杂志,2004,33(11):974-6.
[10]Chen X C,Xue Q.Rat cerebral ischemia-reperfusion injury and Astragalus on the protection of brain cells in rats[J].Shanxi Med J,2004,33(11):974-6.
[11]赖 真,姚灿坤,程少冰,耿小茵.黄芪对脑缺血再灌注后的神经细胞凋亡的影响及机究[J].中国中医急症,2008,17(11):1565-9.
[11]Lai Z,Yao C K,Cheng S B,et al.Study of radix astragali on neuronal apoptosis in reperfused local cerebral ischemia brains[J].JETCM,2008,17(11):1565-9.

