结缔组织生长因子、转化生长因子β1真核表达载体的构建及对硬皮病的FB凋亡的影响
马慧群,闫小宁,张彩晴,袁景奕
(1.西安交通大学西北医院,西安710003;2.陕西省中医医院,西安 710003;3.解放军323医院,西安710068)
系统性硬皮病(systemic scleroderma,SSc)发病的一个重要环节是纤维细胞(fibroblasts,FB)胶原合成异常增多,而多种细胞因子对皮肤FB的胶原代谢具有显著的调节作用[1],其中转化生长因子β1(transforming growth factor-β1,TGF-β1)、结缔组织生长因子(connective tissue growth factor,CTGF)的作用最为重要。本研究通过阳离子脂质体LipofectamineTM2000基因转染的方法,构建CTGF、TGF-β1真核表达载体,并观察转染和未转染细胞增殖变化以及凋亡情况,探讨CTGF、TGF-β1对SSc和正常皮肤FB的影响,为进一步研究CTGF、TGF-β1在SSc发病机制中的作用及干预策略奠定实验基础。
1 材料与方法
1.1 主要材料与试剂 LipofectamineTM2000试剂盒与RPMI1640培养基购自美国Invitrogen公司;Opti-MEM誖I低血清培养基购自美国Gibco ERL公司;CTGF、TGF-β1质粒由远泰公司设计并合成,0.25%胰蛋白酶购自美国Amersca公司;Annexin VFITC&PI凋亡检测试剂盒购自美国ADL公司;碘化丙锭、RNA酶购自晶美生物公司;10%胎牛血清购自杭州四季青公司。
1.2 方法
1.2.1 SSc患者皮损及正常对照取材情况 6例病程<3年的进展期SSc患者 (符合美国风湿病学会1980年分类标准),分别在局麻下切取上臂逐渐扩大的硬化皮损边缘的皮肤组织。8例正常对照者皮肤取自整形外科手术者,两组取材患者的性别、年龄及部位基本匹配,入选者均知情同意。
1.2.2 成纤维细胞的分离和培养 将组织剪成1~3 mm2左右的组织块。用PBS缓冲液清洗组织块3次;将组织块按照一定间距转入培养瓶内。轻轻将培养瓶翻转过来,将适量培养液加到非细胞生长面上,注意翻瓶时勿令组织小块流动,塞好瓶塞置37℃温箱培养2 h左右,使小块微干涸。从微箱中取出培养瓶,开塞,46度斜持培养瓶,箱瓶底脚部轻轻注入培养液少许,然后缓缓再把培养瓶翻转过来,让培养液慢慢覆盖附于瓶底上的组织小块置温箱中静止培养。待细胞从组织块游出量增后,再补加培养液细胞,分离细胞。将分离出的细胞使用10%新生胎牛血清DMEM培养液,37℃下置于5%CO2培养箱中。待细胞融合至80%,用0.25%胰酶消化传代后接种(细胞密度5×104)于培养瓶或孔板,待细胞融合至约70%后分组为正常FC组、硬皮病FC组CTGF FC组、TGF-β1 FC组用于实验。
1.2.3 细胞转染
1.2.3.1 LipofectamineTM2000复合物的准备 以250 uL Opti-MEM誖 Ⅰ稀释 10 μL LipofectamineTM2000,轻轻混匀,室温下孵育。250μL Opti-MEM誖 I稀释4 μg DNA质粒,混匀。混合稀释的DNA质粒和稀释的LipofectamineTM2000,在室温下孵育。
1.2.3.2 DNA质粒的转染 使用LipofectamineTM2000转染DNA质粒。于转染前一天,4~5×104细胞接种在6孔板上,2 mL含FBS的基础培养基。将CTGF、TGF-β1 DNA 质粒 LipofectamineTM2000复合物各自加入到对应的每一个包含成纤维细胞和培养基的孔中,48 h后进行荧光检测转染率。荧光显微镜下,随机选择10个视野,分别计数细胞总数及发绿色荧光的细胞,估算转染率。转染率=(绿色荧光细胞数/总细胞数)。每组实验重复3次,取均值。
1.2.4 细胞凋亡形态观察 用细胞爬片法,将无菌盖玻片放入24孔培养板中,每孔加入1.0×104/mL细胞,待细胞爬片面积超过70%时,弃培养液,加入各组实验血清,每组设 3个复孔;48 h后,按Hoechst33258试剂盒说明书进行染色,然后在荧光显微镜下观察细胞形态,并拍照。
1.2.5 细胞的凋亡检测 使用Annexin V-FITC&PI凋亡检测试剂盒检测FB凋亡情况:在室温下,以300×g离心 5~10 min,收集细胞。预冷 1×PBS(4 ℃)50 μL 重悬细胞 1 次,300×g离心 5~10 min,洗涤细胞。用事先配好的标记液轻轻重悬细胞,105~106细胞/100 μL孵育液,在暗处,室温下孵育15 min,再在每份标本中加入10 μL PI。每100 μL孵育液中加入冷的Binding Buffer稀释,15 min内进行流式检测。流式细胞仪计数细胞,计算凋亡率。每组实验重复3次,取均值。
1.4 统计学分析 应用SPSS 17.0软件。实验结果用(±s)表示,2组间均数比较采用独立样本t检验;计数资料采用率或比表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 细胞形态学观察 正常成纤维细胞原代接种培养24 h内倒置显微镜下即可见胞核为多突的纺锤形或星形的扁平细胞,细胞核呈规则的卵圆形,位于细胞中央呈放射状或栅栏状排列,见图1。

2.2 荧光显微镜下绿色荧光蛋白CTGF和TGF-β1转染硬皮病组成纤维细胞的效果 与正常组基因转染相比,成纤维细胞明显增多,形态发生变化,细胞突消失。携带绿色荧光蛋白CTGF、TGF-β1基因的硬皮病成纤维细胞中绿色荧光蛋白基因表达的产物更明显,大部分呈团块状,多数细胞核重叠,见图2。CTGF、TGF-β1 基因转染率为分别为,(85.7±2.1)%,(66.9±3.3)%,与正常组比较差异有统计学意义(P<0.05)。提示 CTGF、TGF-β1在硬皮病成纤维细胞中成功表达,且CTGF组转染率明显高于TGF-β1组,见表1。
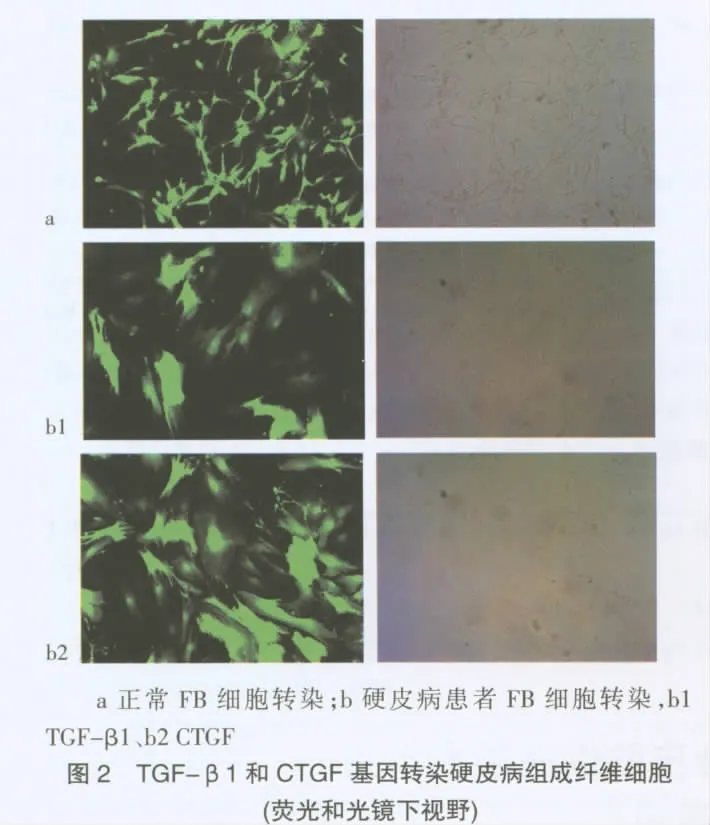
表1 各组细胞转染率 (±s)
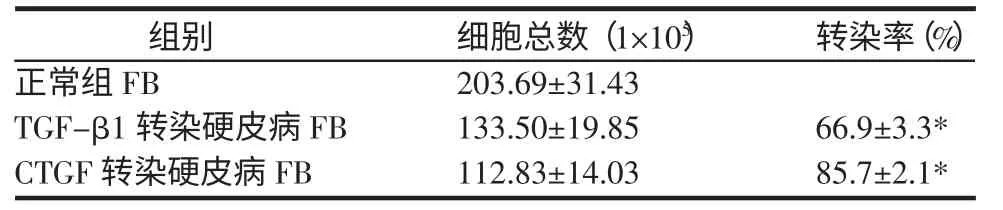
表1 各组细胞转染率 (±s)
注:*P<0.05,与正常组比较。
组别正常组FB TGF-β1转染硬皮病FB CTGF转染硬皮病FB细胞总数(1×105)203.69±31.43 133.50±19.85 112.83±14.03转染率(%)66.9±3.3*85.7±2.1*
2.3 流式结果 细胞形态学观察:作用48 h后,各组均可见大量细胞为正常成纤维细胞,呈亮绿色荧光,核内染色质均匀,小部分核染色质和呈固缩或圆柱状,细胞形态改变或细胞核聚集、边缘化、核碎裂等典型细胞凋亡形态。凋亡率分析:相比正常组,其他各组细胞细胞凋亡率均降低,其中以硬皮病转染组凋亡率最低凋亡率降低(χ2=7.927,χ2=7.85,P<0.05),TGF-β1 和 CTGF 转染硬皮病组FB细胞凋亡率明显降低(χ2=9.33,χ2=9.84,P<0.01),见表 2。
表2 各组细胞凋亡率 (±s)

表2 各组细胞凋亡率 (±s)
注:与正常组FC相比,硬皮病组及TGF-β1和CTGF转染正常FC细胞凋亡率降低(χ2=7.927,χ2=7.85,P<0.05),TGF-β1 和 CTGF 转染硬皮病组 FC 细胞凋亡率明显降低(χ2=9.33,χ2=9.84,P<0.01)。
组别正常组FC硬皮病组FC TGF-β1转染正常FC CTGF转染正常FC TGF-β1转染硬皮病FC CTGF转染硬皮病FC细胞总数(1×105)233.85±18.41 136.00±5.22 186.83±4.93 118.17±21.16 129.33±7.75 122.17±5.75细胞凋亡率6.52%4.33%*4.25%*3.55%3.33%2.79%
3 讨论
系统性硬皮病(SSc)的主要特点是成纤维细胞合成胶原增多,分解减少,大量胶原纤维在皮肤、肺、消化道等组织器官中沉积,组织器官纤维硬化,出现功能障碍。转化生长因子β(TGF-β)是重要的促纤维化细胞因子之一,在SSc中有广泛的细胞活性,可诱导成纤维细胞、Ⅰ型胶原、Ⅲ型胶原、纤维粘连蛋白等ECM的基因转录及蛋白合成,并直接促进成纤维细胞的增生[3-5]。CTGF是TGF-β重要的下游因子之一,具有促进细胞增殖和迁徙,能促使Ⅰ、Ⅲ型胶原、FN等合成及产生ECM基质,促进纤维化的进程,在皮肤和内脏的纤维化进展中起重要作用[6-8]。我们前期大量的工作研究发现CTGF蛋白Ⅰ型胶原和基因在正常小鼠中不表达或很少表达,在硬皮病小鼠模型中有表达[9],表达量随皮肤和肺组织纤维化程度不同而不同。结缔组织生长因子在正常成纤维细胞中很少表达,而在TGF-β的诱导下能高度表达[10]。
脂质体作为技术较为成熟的非病毒载体可作为有效替代物。脂质体介导的细胞转染是通过脂质体DNA复合物与细胞融合将DNA导入细胞,具有高效、简便、对细胞损伤小和容易重复等优点[11]。Invitrogen公司的LipofectamineTM2000已被成功用于多种细胞的转染中,不但可用于DNA的转染,还可用于siRNA,miRNA等小分子核苷酸的转染[12-13]。
本研究将外源性CTGF、TGF-β基因成功转染体外培养的正常成纤维细胞和硬皮病成纤维细胞,成功构建了CTGF、TGF-β1真核表达载体,并观察到基因表达产物对成纤维细胞凋亡的抑制作用。试验中比较各组细胞凋亡情况结果显示,硬皮病组、CTGF、TGF-β转染正常成纤维细胞组细胞凋亡率较正常组降低,说明在硬皮病的发病中成纤维细胞的凋亡受到抑制,同时表明转化生长因子和结缔组织生长因子在硬皮病的发病过程中起重要作用。CTGF、TGF-β1真核表达载体的成功构建为进一步研究CTGF、TGF-β1在SSc发病机制中的作用及干预策略奠定实验基础。研究中选用含绿色荧光蛋白做为报告基因,直观地观察在一定波长下激发的绿色荧光在活细胞中的表达,利用此载体具有可瞬时表达产物及所表达产物便于快速检测的特点,可以尽早了解转移基因的情况。
[1]Varga J. Systemic sclerosis:an update[J]. Bull NYU Hosp Jt Dis,2008,66:198-202.
[2]吕小岩,李明,翁孟武.转化生长因子对硬皮病成纤维细胞影响的研究进展[J].国外医学皮肤性病学分册,2002;28(4):245-248.
[3]Boder WA,Noble NA.Transforming growth factorβ in tissue fibrosis[J].New Engl J Med,1994,331:1286-1292.
[4]Karukonda SR,Flynn TC,Boh EE,et al.The effects of drugs on wound healing:part 1[J].Int J Dermatol,2000,39:250-257.
[5]Kissin EY,Lemaire R,Korn JH,et al.Transforming growth factor beta induces fibroblast fibrillin-1 matrix formation[J].Arthritis Rheum,2002,46:3000-3009.
[6]Shimo T,Nakanishi T,Kimura Y,et al.Inhibition of endogenous expression of connective tissue growth factor by its antisense oligonucleotide and antisense RNA suppresses proliferation and migration of vascular endothelial cells[J].Biochem(Tokyo),1998,124:130-140.
[7]Blom IE,van Dijk AJ,Wieten L,et al.In vitro evidence for differential involvement of CTGF,TGF beta,and PDGF-BB in mesangial response to injury[J].Nephrol Dial Transplant,2001,16:1139-1148.
[8]Babic AM,Chen CC,Lau LF.Fisp12/mouse connective tissue growth factor mediates endothelial cell adhesion and migration through integrity alphavbeta3,promotes endothelial cell survival,and induces angiogenesis in vivo[J].Mol Cell Biol,1999,19:2958-2966.
[9]闫小宁,冯捷,张彩晴,等.硬皮病小鼠CTGF、I型胶原含量及其相关性分析[J].陕西医学杂志,2007,36(7):783-785.
[10]Kubo M,Ihn H,Yamane K,et al.Up regulated expression of transforming growth factor beta receptors in dermal fibroblasts of skin sections from patients with systemic sclerosis[J].J Rheumatol,2002,29:2558-2564.
[11]Madry H,Reszka R,Bohlender J,et al.Efficacy of cationic liposome mediated gene transfer to mesangial cells in vitro and in vivo[J].J Mol Med,2001,79:184-189.
[12]Wu YC,Yenw Y,Lee TC,et al.Heat shock protein inhibitors,17-DMAG and KNK437,enhance arsenic trioxide-induced mitotic apoptosis[J].J Toxicol Appl Pharm,2009,236:231-238.
[13]Yang W,Paschen W.Conditional gene silencing in mammalian cells mediated by a stress-inducible promoter[J].J Biochem Biophys Res Commun,2008,365:521-527.

