快中子与DES复合诱变选育高产木聚糖酶黑曲霉菌株
韩冰莹 陈 光 王 刚 费卓群
(吉林农业大学生命科学学院,吉林长春 130118)
饲料原料中含有较多的木聚糖(Xylan),木聚糖在动物体内难以被吸收利用,使进食动物消化道中的食糜体积变大,黏度增加,阻碍营养物质的吸收。食糜在消化道中的滞留会使动物生长减慢,严重降低生产性能[1]。木聚糖酶(xylanase)是一类能够降解木聚糖的复合酶系,以内切的方式降解木聚糖分子中β-1,4木糖苷键[2]。木聚糖酶的研究对于木聚糖的利用有着重大意义,在饲料工业中具有广阔的应用前景[3-4]。国外对于木聚糖酶的研究较多,国内的研究较少且所产木聚糖酶活力不高。本文通过快中子与硫酸二乙酯复合诱变黑曲霉AS3.350,筛选出一株高产木聚糖酶的黑曲霉,得到最佳的诱变条件,为诱变技术应用于微生物的品种改良提供依据。
1 材料与方法
1.1 材料
1.1.1 菌种
AS3.350购自中科院微生物研究所。
1.1.2 中子源
中子源是利用高压倍加器使离子源产生的氘离子加速轰击氘靶产生的14Mev快中子。该设备由东北师范大学辐射技术研究所提供。
1.1.3 试剂
pH值5.0柠檬酸缓冲液、DNS试剂、pH值4.5醋酸缓冲液、pH值6.0磷酸缓冲液、D-木糖溶液、硫酸二乙酯(DES)。
1.1.4 仪器
电子天平(德国赛多利斯股份公司)、PB-10型数字酸度计(德国赛多利斯股份公司)、低温高速离心机(美国Sigma公司)、培养箱(上海新苗医疗器械制造有限公司)、722型光栅分光光度计(山东高密彩虹分析仪器有限公司)。
1.1.5 培养基
① PDA 培养基:葡萄糖 20 g、KH2PO41 g、Mg-SO4·7H2O 1.5 g、马铃薯 200 g、琼脂粉 20 g、蒸馏水1 000 ml,pH 值自然;
② 液体发酵培养基:KH2PO426 g、CaCl25 g、Mg-SO4·7H2O 10 g、FeSO4·7H2O 0.16 g、酵母膏 10 g、麸皮20 g、Tween-80 5 ml,pH 值 5.0;
③ 刚果红初筛培养基[5-6]:酵母膏10 g、麸皮20 g、KH2PO426 g、CaCl25 g、MgSO4·7H2O 10 g、FeSO4·7H2O 0.16 g、琼脂粉 20 g、刚果红 0.3 g,pH 值 5.0;
④ 种子培养基:K2HPO41 g、KCl 0.5 g、NaNO32 g、MgSO40.5 g、FeSO40.01 g、蔗糖 30 g、琼脂 20 g、蒸馏水1 000 ml,pH值自然。
1.2 菌种培养
1.2.1 菌种活化
取贮藏的黑曲霉AS3.350用PDA斜面培养基活化2代。
1.2.2 菌种培养
取活化后的2代黑曲霉AS3.350于液体发酵培养基中,250 ml三角瓶装液量50 ml,摇床中28℃、200 r/min振荡培养60 h。
1.2.3 发酵培养
5%的接种量接种种子液至发酵培养基,装液量为50 ml/250 ml,28 ℃、200 r/min条件下振荡培养 108 h。
1.3 菌悬液的制备
用生理盐水将PDA斜面培养基中的2代黑曲霉AS3.350孢子洗脱下来,置于三角瓶中并放入玻璃珠,摇床上200 r/min振荡1 h,用无菌纱布过滤孢子悬液,用血球计数板计算孢子个数,用生理盐水稀释一定倍数,使孢子浓度保持在 107~108个/ml[7-8]。
1.4 筛选方法
1.4.1 初筛
将菌悬液涂布于刚果红初筛培养基上培养60 h,用生理盐水进行脱色,挑选水解圈较大的单菌落接种于PDA培养基,以备复筛。
1.4.2 复筛
将初筛得到的菌株接种于液体发酵培养基,摇床中28℃振荡培养60 h,按照一定比例加入到液体发酵培养基中,摇床中28℃振荡培养108 h,测木聚糖酶酶活。
1.5 诱变方法
1.5.1 快中子诱变
以剂量率为0.002 5 Gy/s,剂量为0.15、0.45、0.75、1.50、2.25、3.00、4.50 Gy 处理菌悬液,将辐照后的菌液稀释10-2~10-6,取不同稀释倍数的菌液各0.25 ml涂布于初筛培养基。
1.5.2 硫酸二乙酯(DES)诱变
取0.5 ml DES加入4.5 ml 95%乙醇中制成DES溶液,将DES溶液与菌悬液按一定体积比,比例(DES∶菌悬液)分别为:1∶ 500、1∶ 250、1∶ 200、1∶ 100、30 ℃振荡处理 20、30、40、60 min,加入 2 ml 0.5 mol/l硫代硫酸钠溶液终止反应,并稀释涂布于初筛培养基。通过酶活力确定最佳诱变条件后,用最佳条件对快中子辐照筛选的突变株进行复合诱变。
1.6 突变株的产酶稳定性
将高产突变株在PDA培养基上连续培养6代,将每一代分别接种于发酵液体培养基中,28℃振荡培养108 h,离心取上清液,测木聚糖酶活力,确定突变株经过多次传代后保持产酶稳定性。
1.7 分析方法
1.7.1 粗酶液的制备
将发酵液过滤,滤液在4℃、8 000 r/min条件下离心,上清液即粗酶液。
1.7.2 酶活力的测定
木糖标准曲线的绘制:分别在试管中加入10μmol/ml D-木糖溶液 0.1、0.2、0.3、0.4、0.5、0.6、0.7 ml,补入柠檬酸缓冲液定容至1 ml,再加入3 ml DNS煮沸15 min,取出后迅速冷却,加蒸馏水补至25 ml,以不加木糖溶液的0号管为对照,在540 nm波长处测OD值。木糖含量为横坐标,OD值为纵坐标,绘制标准曲线。曲线方程为:y=0.103 4x-0.045 4(R2=0.993 5)。
木聚糖酶酶活力的测定:将0.9 ml 1%木聚糖底物加入到25 ml具塞试管中,50℃水浴中保温10 min,加入0.1 ml经柠檬酸-磷酸氢二钠缓冲液适当稀释的酶液,在50℃水浴中反应10 min,加入3 ml DNS终止反应,并煮沸15 min,取出后迅速冷却,补蒸馏水至25 ml,混匀后在540 nm波长处比色。对照管中的酶液灭活后加入[8-9]。
酶活力单位定义:50℃、pH值5.0的条件下,每分钟每毫升待测酶液分解底物释放出1 μmol还原糖的量为一个酶活力单位(U)。
酶活力(U)=D×V1×CX/T×V2[10]。
式中:D——酶液稀释倍数;
V1——比色管定容体积(ml);
CX——木糖摩尔浓度(μmol/ml);
V2——酶液体积(ml);
T——酶解时间(min)。
相对酶活力(%)=突变株酶活力/原始菌株酶活力×100。
2 结果与分析
2.1 快中子照射
利用7个不同的辐照剂量对黑曲霉进行诱变,通过快中子辐照菌株的致死率和正突变率可得出最佳诱变条件,见表1。
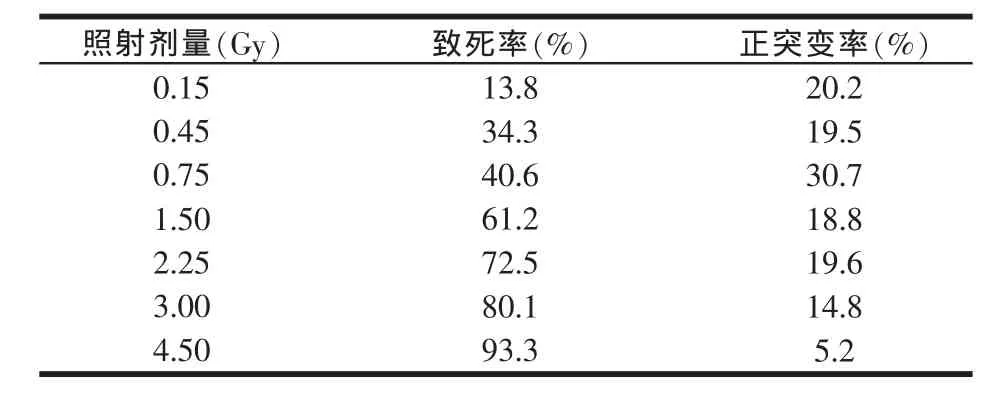
表1 快中子辐照诱变后菌株的致死率和正突变率
如表1所示,当辐照剂量在0.15~4.50 Gy范围内,致死率逐渐增加,正突变率上升后下降,在辐照剂量0.75 Gy时正突变率最高,致死率达到半数,当照射量为4.50 Gy时,快中子辐照黑曲霉的致死率接近100%,因此,0.75 Gy为最佳条件。在快中子辐照剂量为0.75 Gy的条件下,选取10株水解圈相对较大的突变株进行液体发酵培养,测木聚糖酶酶活,以黑曲霉AS3.350为对照组,黑曲霉AS3.350的酶活力为100%,结果见图1。
如图1所示,0.75 Gy快中子诱变的突变株酶活力均有所提高,其中Fn5-2木聚糖酶酶活较原始菌株提高1.72倍,木聚糖酶酶活为134.77 U/ml。说明黑曲霉对快中子敏感,对黑曲霉进行快中子辐照的小剂量刺激能显著提高其产木聚糖酶能力,提高酶活力的变异程度。
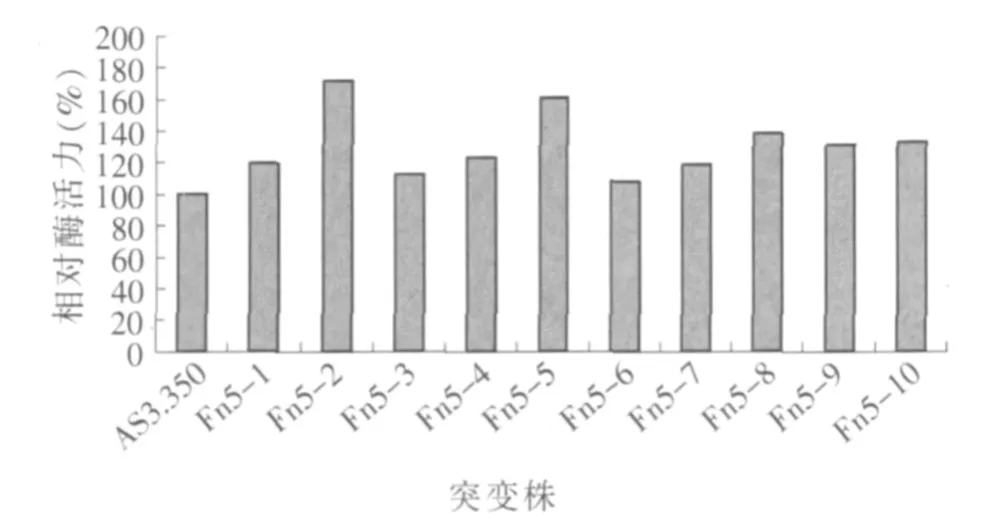
图1 快中子辐照突变株木聚糖酶的相对酶活
2.2 硫酸二乙酯(DES)复合诱变
利用4个不同的体积比(DES∶菌液)对黑曲霉AS3.350进行诱变,通过致死率和正突变率得到最佳诱变条件,见表2。
表2所示,DES对黑曲霉AS3.350的致死率与DES的浓度及诱变时间成正比关系,随着DES与菌液比例的增大及诱变时间的增加,致死率也随之增加。在DES∶菌液为1∶250、诱变时间为20 min的条件下,正突变率最高,为40.5%,得到硫酸二乙酯诱变的最佳条件为:DES∶菌液体积比为1∶250、诱变时间为20 min。

表2 硫酸二乙酯诱变致死率和正突变率(%)
按最佳的DES诱变条件对突变株Fn5-2进行复合诱变,选取8株水解圈大的突变株进行液体发酵培养,测木聚糖酶酶活,以出发菌株AS3.350为对照组,以出发菌株酶活力为100%,结果如图2。

图2 硫酸二乙酯诱变突变株木聚糖酶的相对酶活
如图2所示,突变株Fn5-2经过DES的复合诱变酶活力有所提高,达到了157.07 U/ml,较原始菌株提高了2倍。
3 结论
利用快中子对出发菌株进行诱变,并用DES对突变株进行复合诱变,筛选出一株高产木聚糖酶的黑曲霉菌株DES20-4,木聚糖酶酶活力为157.07 U/ml,是出发菌株的2倍。
我们发现快中子辐照的诱变效果较其他诱变方法好,甚至超过了亚硝基胍(MNNG)这样的强诱变剂,并且比MNNG操作起来更安全。高定华等做了快中子对黑曲霉产糖化酶的诱变效应,正突变率为29.7%,与本次研究接近,但他们采用的剂量较大,致死率过高,我们采用了小剂量取得了良好的效果。
快中子辐照方法进行微生物诱变育种目前很少应用,快中子辐照相对于传统诱变方式来说,快中子的能量较高,次级电离密度较大,能更直接地作用于遗传物质,使DNA合成延迟,细胞分裂受阻,引起基因突变和染色体变异,试验证明,快中子辐照是一种很好的微生物诱变育种方式,适合对微生物进行小剂量刺激。

