抗HIF-1α和survivin基因双靶位miR-RNAi载体的构建及其对胰腺癌细胞的作用
徐孙兵,朱一平,牟一平,朱玲华
(浙江大学医学院附属邵逸夫医院普外科,浙江杭州 310016)
胰腺癌是恶性程度较高的肿瘤之一,具有起病隐匿、早期诊断率低、易转移、对放化疗不敏感等特点。目前,手术是胰腺癌唯一有效的治疗手段,但80%的患者在临床发现时已失去手术机会,因而迫切需要找到一种新的治疗胰腺癌的方法。
随着分子学研究机制的深入,研究者发现多种基因的异常表达与胰腺癌的发生发展密切相关[1]。因此,以这些异常表达基因为靶点的治疗有可能成为治疗胰腺癌的有效方法。研究表明[2],在胰腺癌的基因治疗方案中,多基因联合较以单基因为靶点的治疗策略有更高的抑瘤效率。低氧诱导因子1的α基团(hypoxiainducible factor 1,alpha unit,HIF-1α)和存活素(survivin)在多数胰腺癌细胞中呈现高表达[3-4]。临床和病理研究显示[4-5],HIF-1α 基因的过度表达与胰腺癌血管形成、肿瘤转移以及肿瘤细胞的凋亡抑制显著相关。survivin基因的表达水平与胰腺癌分期、患者预后以及放化疗耐受等密切相关,显示其在胰腺癌的发生发展中起着重要的作用[6-8]。
在基因治疗的手段中,RNA干扰(RNA interference,RNAi)技术具有操作简便、作用稳定、可以多基因为靶点的优势,是目前较为常用和可靠的基因敲除手段。在参与RNAi作用的媒介物中,微小RNA(micro RNA,miRNA,miR)相较于常用的小干扰RNA(small interfering RNA,siRNA)具有无需与靶基因序列完全匹配、基因沉默环节较多和稳定等优势[9]。
鉴于HIF-1α和survivin基因在胰腺癌病理机制中的重要作用,本研究构建了具有联合阻抑HIF-1α和survivin基因表达的双靶位miR-RNAi载体,并利用其转染胰腺癌细胞Panc-1细胞株,评价其对胰腺癌细胞增殖的影响。
1 材料和方法
1.1 主要试剂和材料 胰腺癌细胞Panc-1细胞株(浙江大学医学院附属邵逸夫医院中心实验室保存),RPMI 1640培养液(Cylone公司),Opti-MEM培养液(GIBCO公司),胎牛血清(杭州四季青生物有限公司),MTT粉剂(Amresco公司),二甲基亚砜(Sigma公司),BLOCK-iTTMPolⅡmiR RNAi Expression Vector Kit with EmGFP载体构建试剂盒(Invitrogen公司),PureLink HiPure Plasmid DNA miniprep Kit质粒抽提试剂盒(Invitrogen公司),TRizol试剂(Invitrogen公司),BglⅡ、BamH Ⅰ和XhoⅠ限制性内切酶(New England Biolabs公司),Lipofectamine 2000(Invitrogen公司),M-MLV逆转录酶(Promega公司),兔抗人HIF-1α蛋白多克隆抗体(Bioworld公司),兔抗人Survivin蛋白单克隆抗体(Cell signalling公司),羊抗兔抗体(Bioworld公司)。
1.2 方法
1.2.1 细胞培养及转染 细胞培养:Panc-1细胞于含10%胎牛血清、40 μg/ml链霉素和40 μg/ml青霉素 G的 RPMI 1640培养液,37℃、5%CO2恒温箱中培养。细胞转染:对数生长期的细胞按照每孔5×105个接种于6孔板,培养过夜(覆盖率约80%)。用Opti-MEN培养液轻洗细胞 2次,定容至 1.5 ml。分别用 250μL Opti-MEM 稀释 4 μg 质粒和 10μL lipofectamine 2000试剂,室温孵育 5 min。混合质粒和lipofectamine 2000稀释液,室温静置20 min。混合液加入各孔,培养5 h后,换为RPMI 1640培养液,继续培养。
1.2.2 寡核苷酸序列设计和合成 利用在线设计软件RNAi designer设计寡核苷酸序列:4组对HIF-1α基因的mRNA(NM_181054)匹配的寡核苷酸序列(表1)和4组对survivin基因的mRNA(NM_001012271)匹配的寡核苷酸序列(表2)。阴性序列为实验对照序列,在人类及小鼠基因组中均无同源序列(表1)。由Invitrogen公司合成装载用的DNA单链。

表1 与HIF-1α基因mRNA匹配的寡核苷酸序列(seqI-IV)和对照序列(seqNeg)Table 1 Oligonucleotide sequences matching HIF-1α mRNA and control oligonucleotide
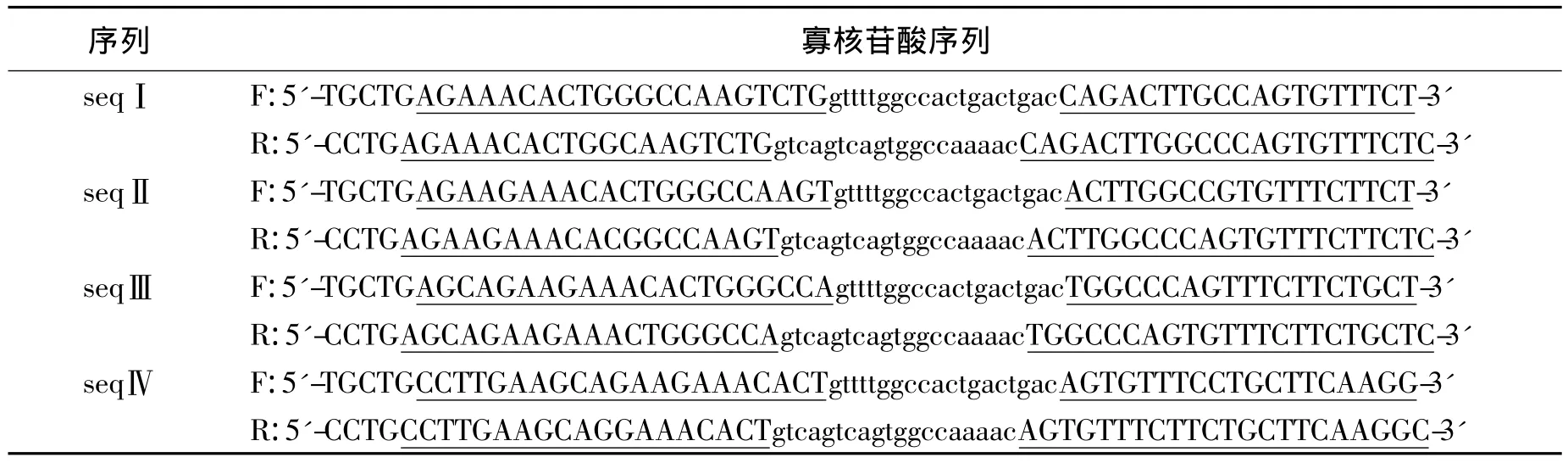
表2 与survivin基因mRNA匹配的寡核苷酸序列Table 2 Oligonucleotide sequences matching survivin mRNA
1.2.3 退火与装载 按照BLOCK-iTTM载体构建试剂盒说明书,将DNA单链用ddH2O稀释到 100 μmol/L。互补单链各 5μL,2μL 10 × 退火缓冲液,8μL ddH2O。95℃ 5 min,室温 20 min,形成双链DNA。将双链DNA用ddH2O稀释至10 nmol/L。在无菌EP管中,依次加入4μL 5 × 连接缓冲液,9μL ddH2O,2μL线性化pcDNA 6.2-GW/EmGFP-miR 质 粒,4μL 10 nmol/L 双链DNA,1μL T4 DNA 连接酶,轻轻混匀,室温反应30 min后置于冰上。
1.2.4 质粒转化、抽提及鉴定 取5μL装载反应液加入100μL的DH5α感受态细胞中,冰上30 min,42℃热休克45 s,再置于冰上2 min,加入1 ml的LB培养基,37℃振荡培养1 h,最后吸取100μL转化液涂布于含 50 μg/ml壮观霉素的LB固体培养基中,37℃培养过夜。挑去4~5个阳性克隆,使用质粒抽提试剂盒抽提,并送Invitrogen公司测序鉴定。
1.2.5 双靶点质粒的串联及鉴定 利用realtime RT-PCR,在抗 HIF-1α基因质粒(anti-H)和抗survivin基因质粒(anti-S)中各筛选出一个基因沉默效率最高的质粒,再通过对pcDNA 6.2-GW/EmGFP-miR质粒特殊限制性内切酶识别位点的酶切和酶切片段的连接,串联出抗HIF-1α和survivin基因双靶位质粒(anti-H+S,图1)。串联质粒转化DH5(感受态细胞,抽提后送Invirtrogen公司测序鉴定。

图1 质粒酶切位点及连接示意图Fig.1 Plasmid restriction sites and chaining diagram
1.2.6 Real-time RT-PCR 检测基因沉默效率按照Trizol说明书收集细胞总RNA。混合5 μg 总 RNA 和 1μL 10 μmol/L oligo dT(16),DEPC 水定容至 10μL,70℃水浴变性 5 min,立即置冰上2 min。加入5μL反转录缓冲液,5μL 10 mmol/L dNTPs,1μL 40 u/μl RNAsin 和 1μL 200 u/μl M-MLV,DEPC 水定容至 25μL。至42℃水浴30 min,99℃水浴5 min破坏反转录酶,立即置冰上2 min,-20℃保存。
Real-time PCR 反应体系:cDNA 2μL,10 ×PCR buffer 2.5μL,25 mmol/L Mg2+2μL,25 mmol/L dNTPs 0.2μL,上游引物(10 μmol/L)0.5μL、sybr green DNA 荧光染料(50 × )0.5μL,下游引物(10 μmol/L)0.5μL、Taq 酶(5 u/μl)0.3μL,用 ddH2O 定容至 25μL。反应条件:95℃ 2 min,95℃ 10 s,60℃ 30 s,70℃ 45 s,40个循环;70℃ 5 min,4℃保持。HIF-1α上游引物为 5'-TCTCAAGGACCACCGCATCT-3',下游引 物 为 5'-GCCAAGTCTGGCTCGTTCTCA-3'。Survivin上游引物为5'-TTGGCAGCAACGACA CAGAA-3',下游引物5'-TCGGAAGGACTAGGT GTCT-3'。内参基因为GAPDH,上游引物为5'-CTTAGCACCCCTGGCCAAG-3,下游引物为5'-GATGTTCTGGAGAGCCCCG-3。
基因沉默效率采用△△Ct来相对定量。根据靶基因和内参基因(GAPDH)的 Ct值(threshold cycle number)计 算 出 △△Ct。△△Ct=(待测样品的目的基因的Ct平均值-待测样本的内参基因的Ct的平均值)-(对照样品的目的基因的Ct的平均值-对照样本的内参基因的Ct的平均值)。靶基因的沉默效率为 1-2-△△Ct。
1.2.7 Western blot检测目的蛋白表达 收集细胞,用组织蛋白裂解液冰上裂解30 min,13 000 r/min离心10 min。取上清加入上样缓冲液混匀,煮沸5 min。25 μg总蛋白经 SDSPAGE电泳(HIF-1α蛋白用10%SDS-PAGE,Survivin蛋白用15%SDS-PAGE)。250 mA恒流2 h后将蛋白电转移到PVDF膜,用含5%脱脂奶粉的封闭液封闭1.5 h,在适当位置剪开PVDF膜(将目的蛋白与GAPDH蛋白分在2张膜上),含目的蛋白的膜加入一抗(HIF-1α抗体1∶1 000,约93 kD;Survivin 一抗 1∶1 000,约 17 kD),4℃孵育过夜,1∶5 000稀释的 HRP标记的羊抗兔抗体室温孵育1 h。含GAPDH蛋白的膜加入1∶5 000稀释的HRP标记抗体,室温孵育1 h。ECL化学发光剂于暗室中曝光和显影。图像采用Quantity One软件进行半定量分析。
1.2.8 MTT法检测Panc-1细胞增殖活性 胰酶消化80%融合状态的细胞,以每孔3×103个接种于5块96孔板,每板分为5组,每组设5个平行孔。5组分别为空白对照组、对照质粒组、anti-H组、anti-S组和anti-H+S组,用相应质粒转染,每孔培养液200μL。转染后即刻取出一块,并每孔加入20μL 5 mg/ml MTT溶液,37℃孵育 4 h,吸弃培养液,加入 150μL的DMSO进行显色,用酶标仪于490 nm波长下检测吸光度(OD490),作为0 h数据,然后每隔24 h取出一块进行相同处理,分析数据和绘制生长曲线。
1.2.9 数据处理 采用 SPSS 15.0统计软件进行数据分析,数据以均数±标准差()表示。应用单因素方差分析进行多组均数间的比较,应用q检验进行两两间均数的比较。统计学检验水准α=0.05。
2 结果
2.1 质粒测序鉴定 将构建完成的anti-H质粒、anti-S质粒和anti-H+S质粒送测序后,比对测序结果与设计序列完全相同,提示质粒构建成功。依据插入序列不同将各质粒依次命名为 anti-H(Ⅰ)-(Ⅳ),anti-S(Ⅰ)-(Ⅳ)。其中anti-H+S质粒由anti-H(Ⅰ)和anti-S(Ⅱ)串联而成。
2.2 Real-time RT-PCR检测靶基因的沉默效率
2.2.1 anti-H质粒对HIF-1α基因的沉默效率将anti-H质粒和对照质粒分别转染Panc-1细胞,24 h后收获细胞进行Real-time RT-PCR,检测HIF-1α基因mRNA的表达情况。4组质粒对 HIF-1α基因的沉默效率分别为48%、2%、44%和30%。
2.2.2 anti-S质粒对survivin基因的沉默效率将anti-S和对照质粒分别转染Panc-1细胞,24 h后收获细胞进行Real-time RT-PCR,检测survivin基因mRNA的表达情况。4组质粒对survivin基因的沉默效率分别为72%、75%、58%和59%。
2.2.3 anti-H+S 质粒对 HIF-1α 基因和survivin基因的沉默效率 根据real-time RTPCR结果,选择对靶基因mRNA抑制作用最强的anti-H(Ⅰ)和anti-S(Ⅱ)进行串联。anti-H+S和对照质粒转染panc-1细胞,24 h后收获细胞行Real-time RT-PCR,分别检测HIF-1α和survivin基因mRNA的表达情况,结果显示两者的基因沉默效率分别为53%和42%。
2.3 Western blot检测靶基因蛋白表达 将对照质粒、anti-H(Ⅰ)、anti-S(Ⅱ)和 anti-H+S 转染Panc-1细胞,24 h后收获细胞,提取总蛋白,行Western blot检测靶蛋白表达情况(图2)。anti-H(Ⅰ)、anti-S(Ⅱ)和 anti-H+S转染组靶蛋白表达量与对照质粒转染组相比均明显下降(P <0.05)。anti-H(Ⅰ)和 anti-S(Ⅱ)各自对其靶基因蛋白的下调作用与anti-H+S组相比无显著性差异(P >0.05,表3)。

图2 Western blot检测靶基因蛋白表达Fig.2 Target gene expression detected by Western blot
表3 Western blot检测各转染组靶蛋白表达量(灰度值比)Table 3 Gray value ratio of target proteins
2.4 MTT法检测Panc-1细胞增殖活性 分别用 anti-H(Ⅰ)、anti-S(Ⅱ)、anti-H+S 和对照质粒转染Panc-1细胞。转染后0 h各组增殖活性无显著性差异。24 h起anti-H(Ⅰ)、anti-S(Ⅱ)和anti-H+S组增殖活性低于空白对照组和对照质粒组(P<0.05)。anti-H+S组从72 h起增殖活性明显低于anti-H(Ⅰ)组和anti-S(Ⅱ)组(P <0.05)。而 anti-H(Ⅰ)和 anti-S(Ⅱ)组两者间增殖活性始终没有统计学差异(P>0.05,表4、图3)。

表4 Panc-1细胞各时间点吸光度值Table 4 OD value of Panc-1 cell line at each time point
3 讨论
胰腺癌是常见的消化系统恶性肿瘤,美国国立癌症研究所(SEER)公布的数据显示[10],全美胰腺癌发病率和死亡率分别居所有恶性肿瘤的第10和第4位,并呈逐年增高趋势。而缺乏有效的治疗手段是造成晚期胰腺癌死亡率居高不下的重要原因。受惠于胰腺癌发病机制和基因技术的研究进展,利用RNAi技术联合敲除多个致瘤基因的基因治疗策略已显示出良好的发展前景[2,11-12]。
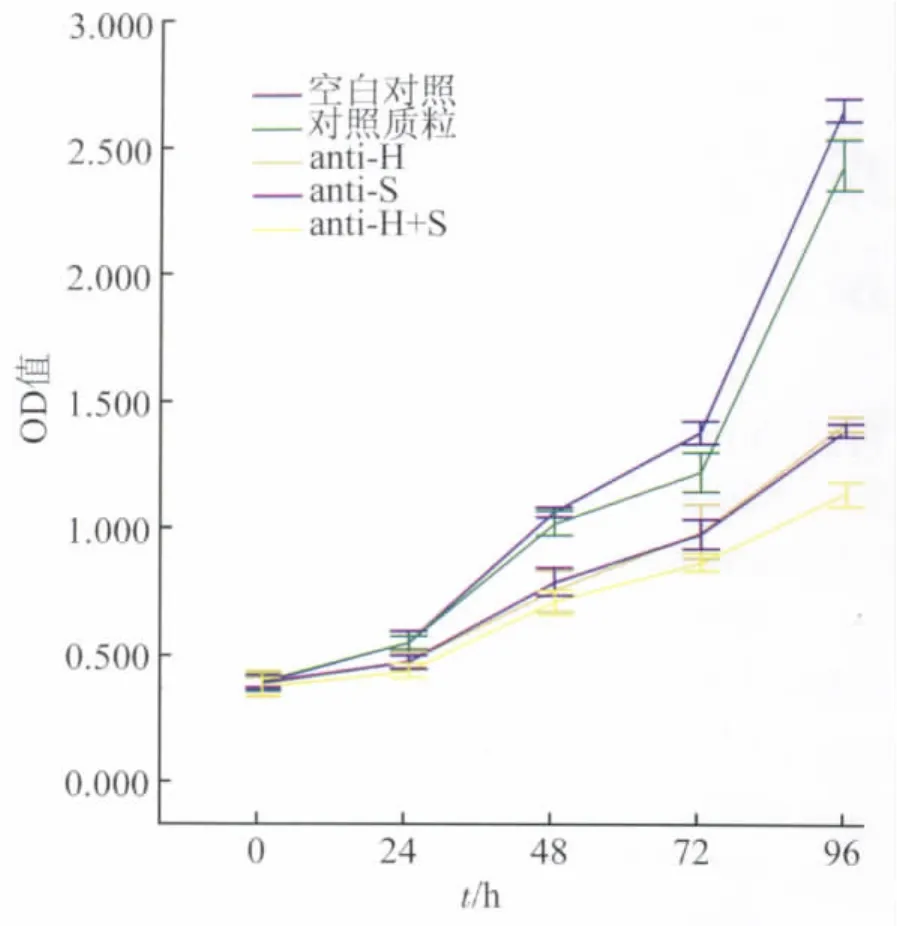
图3 Panc-1细胞生长曲线Fig.3 Growth curve of Panc-1 cell line
胰腺癌的发生与多条细胞通路异常密切相关[1],细胞凋亡信号通路就是其中之一。Jones等[11]对24例胰腺癌样本进行的基因组分析表明,所有胰腺癌细胞都具有与凋亡相关的基因突变。在细胞抗凋亡过程中起着关键作用的是凋亡蛋白抑制因子家族(inhibitor of apoptosis protein,IAP),通过抑制 caspase3、7 和 9 活性来阻断细胞凋亡。Survivin蛋白作为IAP家族中分子量最小的成员,在胰腺正常导管组织、低级别上皮内瘤变、高级别上皮内瘤变到胰腺导管细胞癌病灶中呈稳定的指数增加,提示它与胰腺导管细胞恶变密切相关[3]。而体内外研究也证实[6,8,13-14],通过下调 survivin 表达量,可以显著抑制胰腺癌细胞增殖,诱导其凋亡并能增强放、化疗的敏感性。本研究选择survivin作为基因治疗靶点之一,成功构建了anti-S(Ⅱ)质粒。而real time PCR和Western blot也证实,anti-S(Ⅱ)质粒使Panc-1细胞survivin基因表达量显著降低。生长实验表明,anti-S(Ⅱ)质粒明显抑制了Panc-1细胞的增殖活力。
在胰腺癌发病机制中,除了凋亡信号通路的重要作用,耐缺氧和促血管生成机制也是不可或缺的因素[1]。缺氧状态广泛存在于实体肿瘤中,Koong等[15]早在2000年就证实了胰腺癌瘤体中存在缺氧情况,在7例胰腺癌患者细针穿刺样本中,瘤体氧分压中位数均低于5.3 mmHg,且24% ~90%的样本低于2.5 mmHg;而相邻的正常胰腺组织氧分压介于24~92.7 mmHg,不到9%的样本低于2.5 mmHg。胰腺癌耐受缺氧状态与缺氧激活转录因子(hypoxiaactivated transcription factors)的高表达是分不开的[16]。HIF-1则是这些转录因子中最重要和最常见的成员之一,HIF-1α蛋白在不缺氧的情况下半衰期仅约5 min,而在缺氧组织中较稳定。在正常胰腺组织中 HIF-1α表达较少(36.8%),而在胰腺癌组织中则呈现高表达(70.8%),在 肿 瘤 血 管 周 围 更 加 明 显[4-5]。HIF-1α高表达促进血管内皮生长因子(VEGF)、葡萄糖转运子1(GLUT-1)等生成,增强血管内皮生发作用,增加肿瘤细胞经血液循环转移和播散的风险,是胰腺癌预后的重要指标[16-17]。本研究成功构建了anti-H(Ⅰ)质粒,在转染Panc-1细胞后抑制了细胞的增殖,证实了下调HIF-1α表达量在体外可达到阻抑胰腺癌生长的目的。
胰腺癌的发病机制涉及多条信号通路,单基因治疗策略与基因联合治疗策略相比,在抑瘤效果上居于劣势[2]。单独阻抑survivin、HIF-1α基因或者单基因联合放、化疗的胰腺癌综合治疗实验已见诸报道,并取得一定的治疗效果,但联合阻抑survivin和HIF-1α基因的研究目前尚未见报道。本研究成功构建了anti-S质粒和anti-H质粒,并筛选出两者中基因沉默效果最佳的2个,串联出anti-H+S质粒。anti-H+S转染Panc-1细胞后使survivin和HIF-1α基因的mRNA及蛋白表达量明显下降,显示串联质粒构建成功;生长实验进一步表明,anti-H+S联合阻抑上述2个基因的表达在抑制胰腺癌Panc-1细胞增殖上比单基因阻抑效果更明显。
本研究中利用外源性miRNA在panc-1细胞内介导RNAi作用达到沉默靶基因目的。结果显示,靶基因mRNA和蛋白在质粒转染24 h后即有明显的表达量下调,这可能是由于miRNA具有更为广泛的基因沉默作用,它除了可介导类似于siRNA的mRNA核内降解作用外,还能够在细胞浆内抑制mRNA的翻译过程并诱导其核外降解过程[18]。从基因沉默稳定性来看,生长试验显示,随着时间的延长,处理组与对照组之间的差异更加显著,显示出miRNA表达质粒在Panc-1细胞中瞬时转染作用较为稳定。而对照质粒转染组增殖活性相较于空白对照组有所下降,提示miRNA质粒对细胞存在一定的细胞毒性,这也为将来生物安全性研究提供了基础。
[1]MIHALJEVIC A L,MICHALSKI C W,FRIESS H,et al.Molecular mechanism of pancreatic cancerunderstanding proliferation,invasion,and metastasis[J].Langenbecks Arch Surg,2010,395(4):295-308.
[2]XU J,JIN C,HAO S,et al.Pancreatic cancer:gene therapy approaches and gene delivery systems[J].Expert Opin Biol Ther,2010,10(1):73-88.
[3]BHANOT U,HEYDRICH R,MÖLLER P,et al.Survivin expression in pancreatic intraepithelial neoplasia(PanIN):steady increase along the developmental stages of pancreatic ductal adenocarcinoma[J].Am J Surg Pathol,2006,30(6):754-759.
[4]ZHANG J J,WU H S,WANG L,et al.Expression and significance of TLR4 and HIF-1alpha in pancreatic ductal adenocarcinoma[J].World J Gastroenterol,2010,16(23):2881-2888.
[5]CHENG B Q,SEGERSVARD R,PERMERT J,et al.Pancreatic cancer cells expressing hypoxiainducible factor-1alpha tend to be adjacent to intratumoral blood vessels [J].Eur Surg Res,2010,45(3-4):134-137.
[6]SHEN Y M,YANG X C,SONG M L,et al.Growth inhibition induced by short hairpin RNA to silence survivin gene in human pancreatic cancer cells[J].Hepatobiliary Pancreat Dis Int,2010,9(1):69-77.
[7]THEODOROPOULOS G E,MICHALOPAULOS N V,PANOUSSOPOULOS S G,et al.Effects of caspase-9 and survivin gene polymorphisms in pancreatic cancer risk and tumor characteristics[J].Pancreas,2010,39(7):976-980.
[8]RÜCKERT F,SAMM N,LEHNER A K,et al.Simultaneous gene silencing of Bcl-2,XIAP and survivin re-sensitizes pancreatic cancer cells towards apoptosis[J].BMC Cancer,2010,10:379.
[9]JANKOVIC R,RADULOVIC S,BRANKOVIC-MAGIC M.siRNA and miRNA for the treatment of cancer[J].J BUON,2009,14(1):43-49.
[10]KOHLER B A,WARD E,MCCARTHY B J,et al.Annual report to the nation on the status of cancer,1975-2007,featuring tumors of the brain and other nervous system [J].J Natl Cancer Inst,2011,103(9):714-736.
[11]JONES S,ZHANG X,PARSONS D W,et al.Core signaling pathways in human pancreatic cancers revealed by global genomic analyses[J].Science,2008,321(5897):1801-1806.
[12]TOUCHEFEU Y,HARRINGTON K J,GALMICHE J P,et al.Review article:gene therapy,recent developments and future prospects in gastrointestinal oncology[J].Aliment Pharmacol Ther,2010,32(8):953-968.
[13]KONDURI S,COLON J,BAKER C H,et al.Tolfenamic acid enhances pancreatic cancer cell and tumor response to radiation therapy by inhibiting survivin protein expression [J].Mol Cancer Ther,2009,8(3):533-542.
[14]LIU W S,YAN H J,QIN RY,et al.siRNA directed against survivin enhances pancreatic cancer cell gemcitabine chemosensitivity [J].Dig Dis Sci,2009,54(1):89-96.
[15]KOONG A C,MEHTA V K,LE Q T,et al.Pancreatic tumors show high levels of hypoxia[J].Int J Radiat Oncol Biol Phys,2000,48(4):919-922.
[16]DUFFY J P,EIBL G,REBER H A,et al.Influence of hypoxia and neoangiogenesis on the growth of pancreatic cancer[J].Mol Cancer,2003,2:12.
[17]HOFFMANN A C,MORI R,VALLBOHMER D,et al.High expression of HIF1a is a predictor of clinical outcome in patients with pancreatic ductal adenocarcinomas and correlated to PDGFA,VEGF,and bFGF [J].Neoplasia,2008,10(7):674-679.
[18]LOCHMATTER D,MULLIS P E.RNA interference in mamalian cell systems [J].Horm Res Paediatr,2011,75(1):63-69.

