野生型斑马鱼胚胎中hoxd3基因mRNA的表达谱
舒莉萍,何志旭,姚冬静,马健娟,李 涛,叶芝旭
(贵阳医学院,1.组织工程与干细胞实验中心,2.免疫教研室,3.儿科教研室,贵州贵阳 550004)
hoxd3基因是血管形成和发育的关键基因,其在血管内皮细胞逐渐迁移形成血管的过程中发挥了重要的作用[1],而且其与躯干的形成以及正常形态的维持有关[2]。目前虽然对hoxd3基因的作用机制尚不明确,但是,已有研究表明其在细胞的黏附作用中可能起调控作用[3]。
本研究采用新型模式生物斑马鱼,通过构建并鉴定pCS2+-hoxd3重组质粒,体外转录表达hoxd3基因反义mRNA探针,并运用斑马鱼全胚胎原位杂交技术检测了斑马鱼hoxd3基因在野生型斑马鱼发育过程中的表达情况,从三维立体视角来研究在血管形成以及发育过程中hoxd3基因的表达和可能的作用,为进一步研究hoxd3基因在斑马鱼血管形成和发育过程中的作用机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 野生型斑马鱼成鱼Tuebingen鱼系,由上海生命科学院健康研究所刘廷析研究员馈赠,本实验室繁殖培育。养殖条件:(28±2)℃带有过滤系统的循环水系统养殖,12 h/d光照。
1.1.2 实验试剂 PCR引物由北京诺赛生物科技有限公司合成;E.coli DH5α由本课题组保存,pCS2+质粒载体由上海生命科学院健康研究所刘廷析研究院馈赠,Trizol试剂、逆转录试剂First-strand plus购自Invitrogen公司,高保真KOD-Plus PCR酶购自TOYOBO公司,限制性内切酶EcoRⅠ和XbaⅠ、T4 DNA连接酶以及DNA Marker均购自Fermentas公司,质粒小抽试剂盒购自于Axygen公司。DNA凝胶回收试剂盒购自上海申能生物公司,地高辛RNA标记和检测试剂盒以及NucAwayTMSpin Columns购自Ambion公司,BCIP/NBT购自VECTORLab。
1.2 实验方法
1.2.1 总RNA的提取 收集受精后(0.75~72)小时(hours post-fertilization,hpf)多个时相的Tuebingen野生型斑马鱼胚胎,脱卵膜后置于1.5 ml的Epp管中,加入1 ml Trizol充分匀浆处理,室温静置5 min,经氯仿、异丙醇、75%乙醇洗涤、沉淀、晾干后,加入适量DEPC水溶解,-70℃保存。
1.2.2 RT-PCR克隆hoxd3基因 将提取的总RNA,利用SuperScriptTMⅢ First-Strand Systhesis System kit的随机引物进行反转录,反应在AG22331型热循环仪(eppendorf公司)上按kit操作步骤进行。根据斑马鱼 hoxd3基因的mRNA 序列(NM_131125.1),引入 EcoRⅠ、XbaⅠ酶切位点以及保护碱基设计引物。上游引物Pl:5'-CGGAATTCACCTGCGATGACAAGAGTCC-3',下游引物P2:5'-GCTCTAGAACTCTGTTCCC GGGTACCTT-3'。以逆转录得到的cDNA为模板,进行hoxd3的RT-PCR扩增,扩增条件为:cDNA 合成 40℃ 30 min,94℃ 预变性 2 min,94℃变性30 s;55℃退火30 s,72℃延伸2 min,共30次循环,最后延伸72℃ 10 min,PCR产物大小为450 bp,1%琼脂糖凝胶电泳鉴定。
1.2.3 PCR产物的克隆 将 pCS2+质粒利用钙转法转入E.coli DH5α感受态菌中,通过氨苄抗性筛选出阳性克隆,扩增后运用碱裂解法提取pCS2+质粒DNA后,用EcoRⅠ和 XbaⅠ双酶切,1%琼脂糖电泳后割胶回收。将hoxd3基因的PCR产物用EcoRⅠ和XbaⅠ双酶切,1%琼脂糖凝胶电泳后割胶回收,将回收产物与上述得到的经EcoRⅠ和XbaⅠ双酶切的pCS2+质粒在T4酶的作用下相连接,将连接产物运用钙转法转入E.coli DH5α感受态菌中,经氨苄抗性筛选出阳性克隆并扩增后,运用碱裂解法提取pCS2+-HoxD3重组质粒。
1.2.4 pCS2+-hoxd3重组质粒鉴定和测序 鉴定pCS2+-hoxd3重组质粒:①双酶切鉴定:用EcoRⅠ和XbaⅠ双酶切pCS2+-hoxd3重组质粒,通过1%琼脂糖凝胶电泳判断酶切产物大小;②菌落RT-PCR鉴定pCS2+-hoxd3重组质粒,通过1%琼脂糖凝胶电泳判断扩增产物大小;③序列测定鉴定:将重组质粒送至北京诺赛生物技术公司进行序列测定。
1.2.5 地高辛标记的hoxd3反义mRNA探针制备 将pCS2+-hoxd3重组质粒用EcoRⅠ进行单酶切,经1%琼脂糖凝胶电泳鉴定后,用DNA纯化试剂盒割胶回收得到线性化的pCS2+-hoxd3重组质粒。利用T3体外转录体系,以线性化的pCS2+-hoxd3重组质粒DNA为模板,以地高辛标记的寡核苷酸为原料,经体外转录得到地高辛标记的hoxd3反义mRNA探针后,用NucAwayTMSpin Columns纯化吸附柱回收hoxd3反义mRNA探针,经2%琼脂糖凝胶电泳鉴定后于-70℃保存备用。
1.2.6 斑马鱼全胚胎原位杂交 选取Tuebingen野生型斑马鱼0.75~72 hpf的不同时间点胚胎进行全胚胎原位杂交,用1×PBST溶液洗去固定液,用甲醇进行梯度脱水后,将胚胎置于68℃杂交炉中进行预杂交1 h,加入制备好的地高辛标记的hoxd3反义mRNA探针,于68℃杂交炉中过夜,用不同浓度的SSCT将多余的探针洗去,加入地高辛抗体后过夜,用MABT将多余的抗体洗掉,加入BCIP∕NBT染液对杂交胚胎进行染色,在体视显微镜下观察并记录结果后,用固定液对杂交胚胎进行再固定并且照相。
2 结果
2.1 hoxd3基因RT-PCR结果 在图1中可见到一特异性扩增带,位于200 bp~500 bp,大小与预期的450 bp相符。
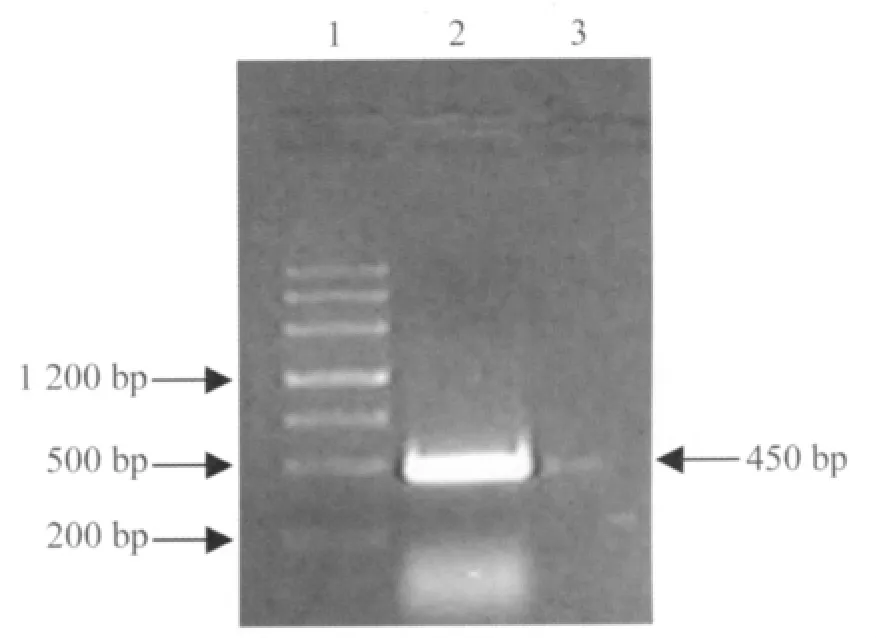
图1 hoxd3基因RT-PCR琼脂糖凝胶电泳结果Fig.1 RT-PCR product analysis of hoxd3 gene
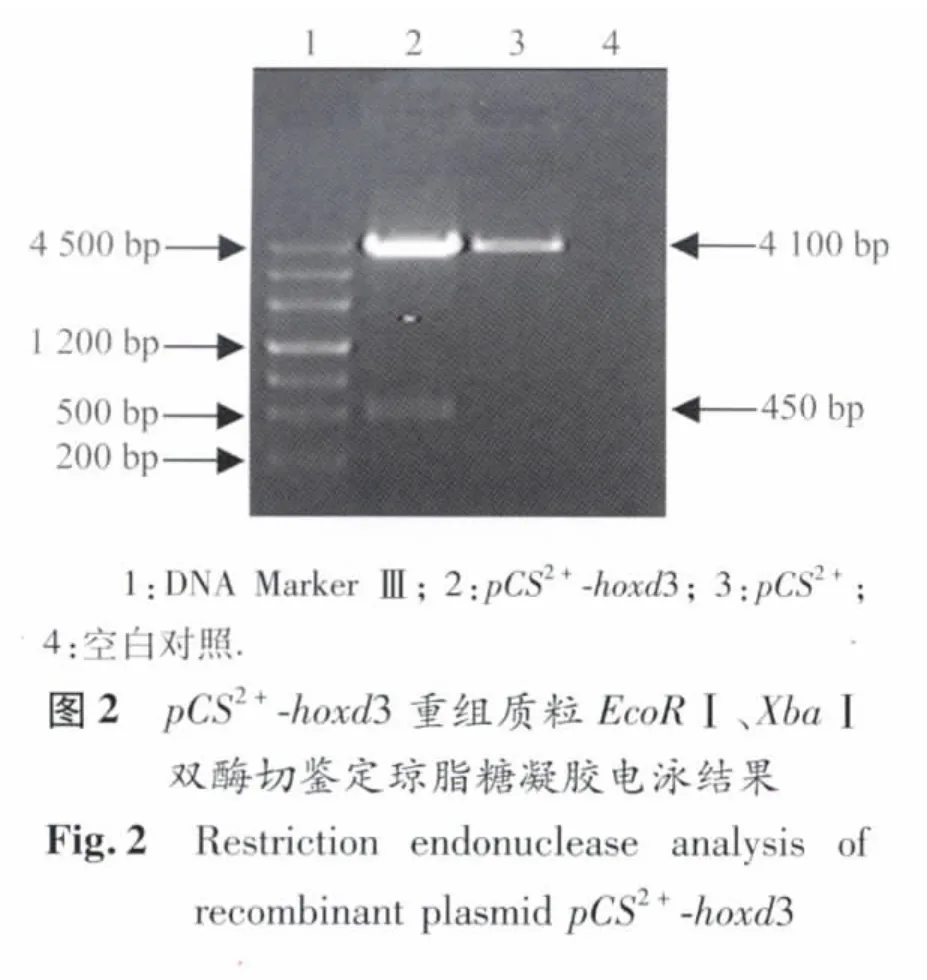
2.2 pCS2+-hoxd3重组质粒酶切鉴定结果 将筛选过的阳性重组质粒通过EcoRⅠ和XbaⅠ双酶切鉴定,将酶切产物用1%的琼脂糖凝胶电泳。图2显示,用EcoRⅠ和XbaⅠ双酶切得到的hoxd3基因片段大小约450 bp,与RT-PCR产物大小一致;另外,得到的另一个DNA片段大小约4 100 bp,与pCS2+质粒EcoRⅠ和XbaⅠ双酶切后产物大小一致。
2.3 pCS2+-hoxd3重组质粒菌落RT-PCR鉴定结果 将筛选过的阳性重组质粒作为模板进行PCR扩增,1%琼脂糖凝胶电泳鉴定,在图3中可见到一特异性扩增带,位于200 bp~500 bp之间,大小与预期的450 bp相符。
2.4 pCS2+-hoxd3重组质粒测序结果 将筛选过的阳性重组质粒经北京诺赛生物有限公司测序,结果经Genbank检索发现与hoxd3基因完全一致(图4)。

2.5 斑马鱼全胚胎原位杂交结果 在Tuebingen野生型斑马鱼24 hpf~72 hpf胚胎的中脑后脑交界处以及后脑中(红色箭头所示)可以观察到hoxd3基因的蓝黑色阳性杂交信号(图5);在36 hpf至72 hpf的斑马鱼胚胎中,可以观察到前脑(黄色箭头所示)、中脑(红色箭头所示)都有hoxd3基因明显的蓝黑色杂交信号;在脊索(蓝色箭头所示)部位,则是从18 hpf开始出现,36 hpf达到高峰,而至48 hpf及其以后的胚胎脊索组织中则几乎观察不到hoxd3基因的表达。由此可见,hoxd3基因在Tuebingen野生型斑马鱼神经系统中是高表达的。
3 讨论
本研究采用新兴模式生物斑马鱼作为实验动物,实验显示其体外受精,胚胎体外发育且通体透明,便于活体观察和研究[4],这些优点为本研究早期血管的形成和发生,以及早期的生长发育提供很好的基础。

图5 hoxd3基因Tuebingen野生型斑马鱼中全胚胎原位杂交结果Fig.5 Whole-mount in situ hybridization with hoxd3 in zebrafish embryos at different hours postfertilization
全胚胎原位杂交技术(whole mount in situ hybridization,WISH)可以从整体水平反映胚胎发育过程中基因表达的时空顺序,常被广泛应用于胚胎发育调控基因表达的研究。该技术简单易行,地高辛所标记的探针具有较高灵敏度,本实验通过设计斑马鱼hoxd3基因的引物,提取斑马鱼胚胎总RNA,成功扩增出hoxd3基因片段,将扩增出来的hoxd3基因片段通过T4连接酶与载体pCS2+质粒进行定向重组,得到pCS2+-hoxd3重组质粒,经过双酶切、菌落PCR以及序列测定鉴定pCS2+-hoxd3重组质粒构建成功,并在此基础上以pCS2+-hoxd3重组质粒为模板进行体外转录,得到了片段为200 bp到500 bp之间的地高辛标记的hoxd3反义mRNA探针,并经斑马鱼全胚胎原位杂交技术检测了hoxd3反义mRNA探针在Tuebingen野生型斑马鱼胚胎早期发育过程中的表达情况。
Hox基因家族最初是由Mcginnis等[3]人在果蝇中发现,是一类与正常胚胎发育密切相关的主要调控基因[5],目前已有研究表明,hoxd3基因在细胞的黏附作用中可能有一定的作用[3],而在细胞、组织及器官的形态发育中发挥着重要作用,若hoxd3基因缺失将会导致严重的肢体以及生殖器官的形态异常[4-6]。本研究证实了hoxd3基因在斑马鱼胚胎的后脑中有明显表达,并首次发现在脊索中也有明显的表达;在斑马鱼胚胎早期发育过程中,hoxd3基因在神经系统的表达十分明显,这说明hoxd3基因与神经系统的发育以及体节的形成是相关的,证实hoxd3基因在组织器官发育过程中可能发挥着重要作用,但其可能的分子机制有待进一步研究。
目前研究表明,Hox基因与胚胎发育过程中的血管形成有着很重要的关系[1,7],其中,hoxd3基因作为Hox基因家族的一员,在血管形成以及发育过程中其是通过影响血管内皮细胞逐渐迁移形成新生的血管而发挥作用的,而且hoxd3基因的持续表达可以使静止的内皮细胞被激活,从而刺激新生血管的形成[1,8-9]。但是,hoxd3基因在血管形成以及发育过程中确切的生物学作用及其分子机制至今尚不是很清楚。本研究在斑马鱼胚胎早期发育过程中未检测到hoxd3基因在血管生成区域的表达,这一结果与在人、老鼠以及其它物种中的研究结果并不完全吻合,而全胚胎原位杂交技术是依靠肉眼观察来分辨基因表达差别的方法,若hoxd3基因在血管生成区域的表达量很低,那使用WISH技术就很难检测到hoxd3基因在血管生成区域的表达,若采用实时荧光定量的PCR方法可解决这一问题。
[1]DAFTARY G S,TAYLOR H S.Endocrine regulation of HOX genes[J].Endocrine Reviews,2006,27(4):331-355.
[2]ACAMPORA D,D'ESPOSITO M,FAIELLA A,et al.The human HOX gene family [J].NucleicAcids Res,1989,17:10385-10402.
[3]TANIGUCHI Y,KOMATSU N,MORIUCHI T.Overexpression of the HOX4A(HOXD3)homeobox gene in human erythroleukemia HEL cells results in altered adhesive properties[J].Blood,1995,85:2786-2794.
[4]FISHMAN M C.Zebrafish-the canonical vertebrate[J].Science,2001,294:1290-1291.
[5]CRUZA C,MAEGAWA S,WEINBERG E S,et al.Induction and patterning of trunk and tail neural ectoderm by the homeobox gene eve1 in zebrafish embryos[J].Proc Natl Acad Sci,2010,107:3564-3569.
[6]SKROMNE I,THORSEN D,HALE M,et al.Repression of the hindbrain developmental program by Cdx factors is required for the specification of the vertebrate spinal cord [J].Development,2007,134:2147-2158.
[7]GRIER D G,THOMPSON A,KWASNIEWSKA A,et al.The pathophysiology of HOX genes and their role in cancer[J].Pathol,2005,205:154-171.
[8]HANSEN S L,MYERS C A,CHARBONEAU A,et al.HoxD3 accelerates wound healing in diabetic mice[J].Pathol,2003,163(6):2421-2431.
[9]UYENO L A,NEWMAN-KEAGLE J A,CHEUNG I,et al.HoxD3 expression in normal and impaired wound healing[J].Surg Res,2001,100:46-56.

