骨质疏松发病过程中骨髓间充质干细胞差异性表达microRNA的筛选及其在干细胞多向分化中的功能
廖 立,杨小红,金 岩
(1.第四军医大学口腔医院口腔组织病理学教研室,组织工程研发中心,陕西西安 710032;2.遵义医学院附属口腔医院口腔修复科,贵州遵义 563003)
雌激素、糖皮质激素等全身性内分泌激素能够影响骨骼的改建。在绝经期后女性超过50%患有不同程度的骨质疏松[1]。骨质疏松的发生现在认同的观点是在骨改建过程中成骨功能与破骨功能的失调所致。雌激素缺乏不仅能够激活辅助 T细胞(T helper,Th),而且能通过RANK/RANKL等途径促进破骨前体细胞向破骨细胞的转化,增强破骨功能[2];同时,雌激素缺乏也能够抑制成骨相关细胞的增殖和分化。有研究认为,骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells,BMMSC)是成骨前体细胞的来源,具有雌激素受体,可以受到雌激素的直接作用,影响增殖和分化相关基因表达;雌激素缺乏还可以活化辅助性T细胞,通过Fas/FasL信号途径间接导致BMMSC的凋亡[3]。但是,相比于对破骨细胞的作用而言,此激素缺乏对于成骨相关细胞的作用机制仍不确定。
我们前期的研究发现,在卵巢切除(ovariectomy,OVX)小鼠骨质疏松模型中BMMSC的分化能力发生了一定的改变。与假手术(sham surgery,Sham)小鼠相比,OVX小鼠BMMSC成骨分化能力减弱,而成脂分化能力增强,其细胞行为的改变与小鼠骨骼的病理表现相一致,提示BMMSC的功能异常在骨质疏松的发生中发挥了重要的作用。部分研究也支持此假设[4-5]。同时,还发现 OVX小鼠 BMMSC虽然在体外培养过程中使用了含雌激素的普通胎牛血清和培养基,但其分化功能却仍存在缺陷,这说明雌激素不仅通过外源性信号即时调控BMMSC的功能,雌激素长时间的缺乏还能对BMMSC造成内源性的损伤,且这种损伤在雌激素水平恢复至正常之后一定时期内是无法完全恢复的。这与近年报道的雌激素缺乏后对乳腺干细胞造成的增殖能力损伤相类似[6-7]。然而,对于雌激素缺乏如何导致BMMSC功能异常的分子机制目前尚不明确。
近年来,microRNA逐渐成为研究的热点,大量研究发现,其作为一种保守而普遍的调控机制,在细胞增殖、分化、凋亡、信号转导等生命过程中均发挥着重要的作用[8-10]。细胞microRNA表达谱的改变将对干细胞的状态和功能造成显著的影响[11-12]。已有研究发现,多种microRNA在BMMSC的分化过程中发挥着重要的调控作用[13-15]。所以,本研究假设在雌激素缺乏的条件下,可能导致 BMMSC内部microRNA表达谱发生一定的改变,并通过调控分化相关靶基因而影响了BMMSC的正常分化,损害正常的成骨功能而导致或加速骨质疏松的发生。
1 材料与方法
1.1 OVX小鼠骨质疏松模型的建立 C57BL/6J近交系小鼠由第四军医大学动物实验中心购买。取30只8周龄小鼠,随机分为2组,以1%戊巴比妥钠麻醉后,从背部开口寻找到双侧卵巢,卵巢切除组(OVX)于子宫颈部结扎后切除卵巢,缝合伤口;假手术组(Sham)仅切除部分脂肪组织,保留卵巢,缝合伤口。置于SPF级动物房饲养3个月后,进行股骨micro CT和组织学检测,验证模型是否建立成功。
1.2 BMMSC体外培养 C57BL/6J小鼠颈椎脱臼后剥取股骨及胫骨,剔除表面肌肉及软组织,以1 ml针管冲洗骨髓后将细胞悬液接种于含10%胎牛血清(fetal bovine serum,FBS)的α-MEM培养基内,37℃、5%CO2培养箱常规培养。每2天半量换液,当细胞密度达到80%后以2×104/cm2的密度传代。
1.3 microRNA芯片筛选 取术后3个月OVX组及sham组小鼠各9只,分别分离股骨及胫骨后按上述方法常规培养BMMSC,待原代细胞密度达到80%后,使用细胞裂解液(LC公司)提取RNA行microRNA微阵列芯片检测(LC-μParafloTM微流体芯片,杭州联川生物信息技术有限公司)。
1.4 BMMSC的成骨成脂诱导 成骨成脂诱导及检测:成脂诱导液为α-MEM,加入10%胎牛血清(杭州四季青),0.5 mmol/L异丁基甲基黄嘌呤(IBMX;Sigma),2 μmol/L 胰岛素(Sigma)和10 nmol/L地塞米松(Sigma)。成骨诱导液为α-MEM,加入10%胎牛血清(杭州四季青),100 nmol/L地塞米松,5 mmol/L甘油磷酸钠和50 μg/ml左旋维生素C(Sigma)。细胞按照2×105/孔接种于6孔板内,待密度达到90%以后加入成脂诱导液和成骨诱导液进行培养。加入诱导液后分别于第1天、第7天和第14天以TRIZOL@Reagent(Invitrogen)提取 RNA。同时,分别对成骨及成脂诱导14 d后的BMMSC进行茜素红、油红染色及相关基因(ALP、OCN、RUNX2、PPAR-γ、LPL)进行 RT-PCR 检测,验证成骨成脂诱导是否成功。
1.5 RT-PCR检测 按照产品使用说明书,使用RT-PCR试剂盒(宝生物工程有限公司,Takara)对所提取RNA进行逆转录反应并用ABI7500 RT-PCR仪进行检测。其中microRNA RT-PCR引物由广州锐博生物科技有限公司订制,其余mRNA RT-PCR引物由上海英潍捷基生物技术有限公司合成。
2 结果
2.1 骨质疏松小鼠BMMSC的microRNA表达谱发生了改变 通过对体外培养的原代小鼠BMMSC进行 microRNA芯片筛查,发现在mirBase 16.0 数据库(www.mirbase.org)中已发现的1032 microRNA中,有305种在BMMSC中表达。其中,第一组芯片中差异性表达的microRNA有34个,第二组芯片中差异性表达的microRNA有95个,第三组芯片中差异性表达的 microRNA有89个。但是,三组芯片中microRNA的差异并非完全一致,通过统计学分析,共有10个microRNA差异明显(表1)。根据文献报道及三组芯片的一致性,选择了5个microRNA进行RT-PCR检测,对芯片结果进行验证,RT-PCR结果与芯片结果基本一致,证明了芯片筛查结果的可靠性及可重复性(图1)。

表1 芯片筛查差异性表达microRNATable 1 The microRNA differentially expressed in micro-array chip
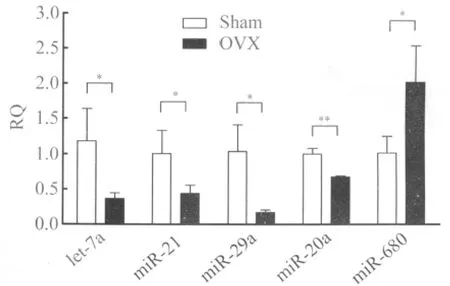
图1 Sham组及OVX组BMMSC中microRNA表达水平Fig.1 The results of microRNA expression level of BMMSCs of Sham group and OVX group
2.2 部分差异性表达microRNA与BMMSC成骨分化过程密切相关 对BMMSC进行成骨分化诱导实验,从不同时间点采集细胞RNA样本。诱导14 d后,通过茜素红染色和RUNX2、ALP、OCN、COL-1基因表达及RT-PCR检测证明成骨诱导实验确实成功(结果未展示)。对不同时间点样本进行RT-PCR检测,发现成骨诱导对部分筛选出的microRNA的表达产生了明显的影响(表 2)。其中,miR-20a、miR-21、miR-29a、let-7a在成骨过程中均呈逐渐下降趋势,成骨诱导14 d后,miR-29a降至诱导前水平的20%左右,miR-20a和let-7a降至原有水平的10%以下,miR-21在诱导第1天后出现一定的上升,随后下降至诱导前水平的60%;而miR-680在成骨分化中呈上升趋势,诱导14 d后较诱导前上升了约12倍。这些结果表明,上述microRNA与成骨分化过程密切相关,可能对分化中关键靶基因发挥了调节作用,影响BMMSC的定向分化。但是,其变化趋势与前期实验观测到的骨质疏松BMMSC的成骨能力下降不完全一致。
2.3 部分差异性表达microRNA与BMMSC成脂分化密切相关 对BMMSC进行成脂分化诱导,从不同时间点采集细胞RNA样本。诱导14 d后,通过油红染色和PPAR-γ、LPL基因表达,以及RT-PCR检测,证明成脂诱导实验确实成功(结果未展示)。对不同时间点样本进行RT-PCR检测,发现其中3个microRNA的表达在成脂诱导过程中发生了明显变化(表3)。其中,miR-680在成脂过程中明显上升,第14天时升高了约8倍。而miR-20a在成脂过程中呈持续性下降去势,在诱导7 d后基本没有表达,降至原有水平的1%以下。miR-29a于成脂诱导1 d时出现了一定程度的上调,但随后明显下调至原水平的10%左右。而miR-21和let-7a在不同样本成脂诱导的重复实验中表达不稳定,趋势不明确(结果未展示)。这些结果均说明上述microRNA与BMMSC成脂过程密切相关,且其变化趋势与前期试验观测到的骨质疏松BMMSC的成脂功能增强相一致。
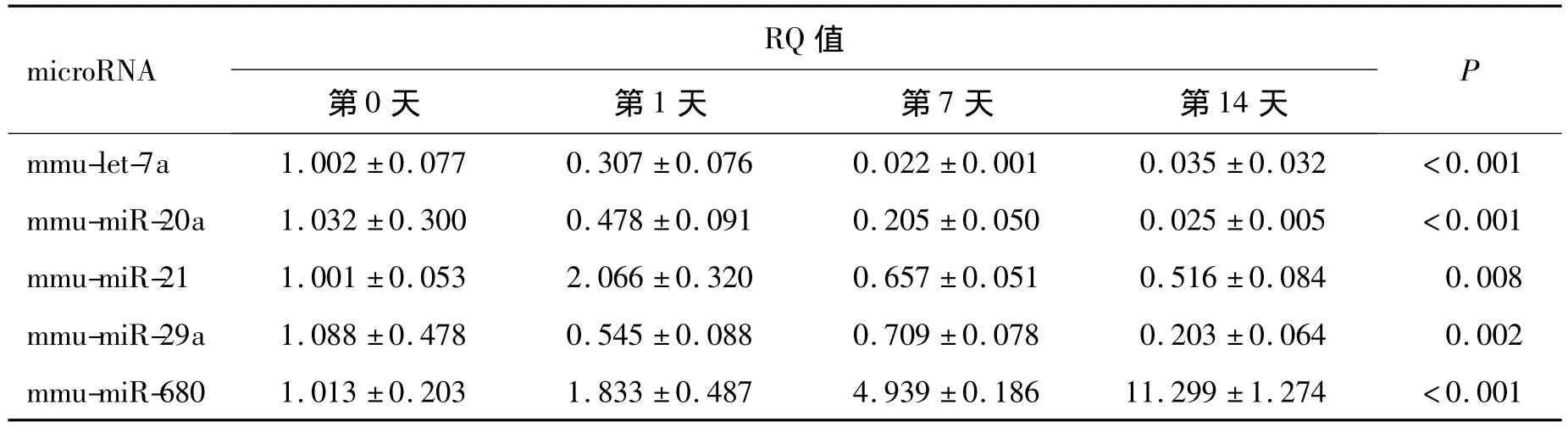
表2 成骨诱导过程中BMMSC的microRNA表达变化Table 2 The expression of microRNA in BMMSC during osteogenesis induction
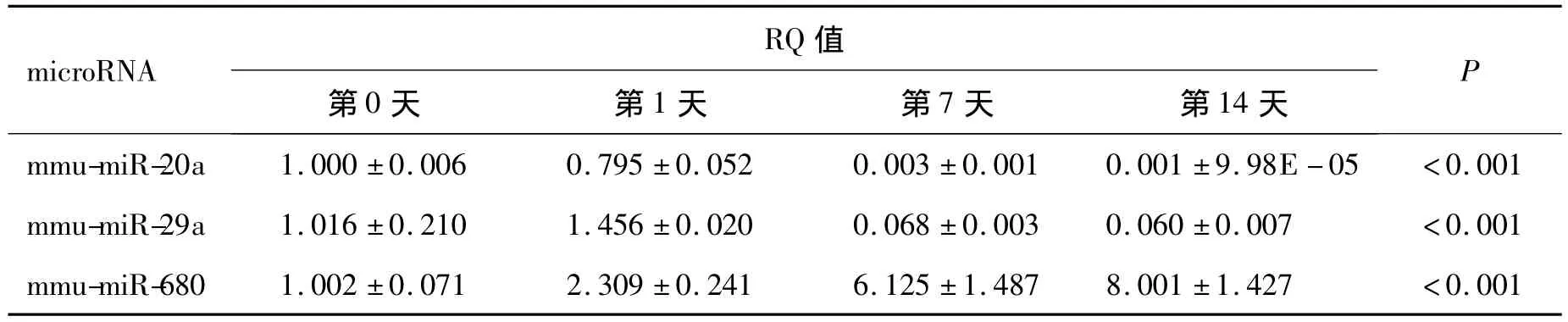
表3 成脂诱导过程中BMMSC的microRNA表达变化Table 3 The expression of microRNA in BMMSC during adipogenesis induction
3 讨论
本研究首次对雌激素缺乏所致骨质疏松BMMSC的microRNA表达谱进行微阵列芯片筛查,发现在骨质疏松下BMMSC microRNA表达谱发生了一定的改变。首先,特定的microRNA仅在特定的细胞内表达,在1 032种已知的小鼠microRNA中仅有305种在BMMSC中表达,且表达的丰度在不同来源BMMSC中相对一致,证明microRNA可以作为细胞的身份标识[16];同时,在芯片筛选结果中,多数microRNA的表达量改变不大,这与近期一些针对BMMSC进行的microRNA芯片筛选结果类似[17-18]。这可能是因为在衰老及骨质疏松等慢性退行性变中,BMMSC并未发生根本的分化或变异,只是功能发生了一定程度的改变,不同于肿瘤或者发育阶段所发生的根本转变时观察到的microRNA表达谱的明显变化。对于这种轻度的改变如何显著调控细胞的功能,可能是通过多个microRNA共同调控一个靶基因,或者是一个microRNA调控一组功能互相协同的microRNA 来实现的[19]。
通过对BMMSC进行成骨成脂诱导并对此过程中特定microRNA的表达进行RT-PCR检测,发现 miR-680、miR-20a、miR-29 在 2 种分化过程中都出现了明显的变化,提示这些microRNA的表达变化与干细胞的分化密切相关。其中miR-680在成骨及成脂过程分化中均上升,提示miR-680可能调控了抑制细胞分化的靶基因,其升高使得这类抑制性靶基因下调,促进细胞的分化进程;而miR-20a和miR-29a在成骨及成脂分化过程中均下降,提示其可能调控的是促进细胞分化的靶基因,其下调使得对这些靶基因的转录后调控减弱,促进其表达,加快分化进程。不过,增殖与分化是2个紧密联系的细胞生命活动,前期实验也提示干细胞在分化过程中增殖将受到明显的抑制,所以也不排除这些microRNA可能与细胞的增殖相关,其影响的是细胞增殖能力的改变。
本实验结果显示,多个microRNA在成骨过程中的改变趋势与其在骨质疏松过程中的变化趋势不一致;而成脂分化过程中的变化趋势与骨质疏松过程中的变化趋势是一致的。这一方面可能是特定microRNA可以调控一系列的靶基因,从而与细胞多种功能相关,其在骨质疏松状态下的变化不一定单纯反映BMMSC成骨分化功能的改变,也可能反映的是干细胞增殖、凋亡或者因子分泌功能的改变[18]。有研究发现,miR-335在成脂和成骨过程中均呈下降趋势,而且其改变不仅对于细胞分化产生影响,还能够同时影响细胞的增殖和迁移能力[20]。另一方面,因为BMMSC成骨成脂这两种分化方向处于一种互相拮抗的状态,如果其成脂功能异常增强将导致骨质疏松,而骨密度异常增高的患者表现出BMMSC的成脂能力缺陷。在成骨及成脂分化的过程中,例如RUNX2、PPAR-γ、TAZ等基因发挥着重要的开关作用,能够控制细胞的分化方向[20]。所以如果microRNA的靶基因是调控成脂分化的关键开关基因,那其在骨质疏松状态中的改变将对于BMMSC的成脂分化起到较强的促进作用,控制其定向分化,这可能抵消此microRNA对于成骨分化的反向调节作用[5]。
我们通过靶基因预测软件(TargetScan,PicTar,Miranda)对所选的差异性表达microRNA的功能进行了初步预测,发现每个microRNA都能够调控大量靶基因,其中部分基因与细胞的增殖、分化、凋亡密切相关。这些基因互相联系,形成一个复杂的细胞命运调控网络,对细胞进行精确调控[21]。由此可以提出一个假设:雌激素通过直接或间接作用维持BMMSC内部特定microRNA表达谱的稳定,后者通过转录后调控控制一系列靶基因的表达稳态,控制BMMSC正常的生物学行为,维持骨改建过程的稳态平衡。当雌激素水平下降后,BMMSC中microRNA表达谱稳态受到破坏,进而引起下游靶基因表达异常,改变BMMSC的生物学行为,最终导致骨质疏松的发生。但是,这些假设还有待后续实验进一步的验证。
[1]SAMBROOK P,COOPER C.Osteoporosis[J].Lancet,2006,367(9527):2010-2018.
[2]BOYLE W J,SIMONET W S,LACEY D L.Osteoclast differentiation and activation [J].Nature,2003,423(6937):337-342.
[3]KRUM S A, MIRANDA-CARBONI G A,HAUSCHKA P V,et al.Estrogen protects bone by inducing Fas ligand in osteoblasts to regulate osteoclast survival[J].EMBO J,2008,27(3):535-545.
[4]MOERMAN E J,TENG K,LIPSCHITZ D A,et al.Aging activates adipogenic and suppresses osteogenic programs in mesenchymal marrow stroma/stem cells:the role of PPAR-gammol/La2 transcription factor and TGF-beta/BMP signaling pathways[J].Aging Cell,2004,3(6):379-389.
[5]MURUGANANDAN S,ROMAN A A,SINAL C J.Adipocyte differentiation of bone marrow-derived mesenchymal stem cells:cross talk with the osteoblastogenic program [J].Cell Mol Life Sci,2009,66(2):236-253.
[6]ASSELIN-LABAT M L,VAILLANT F,SHERIDAN J M,et al.Control of mammary stem cell function by steroid hormone signalling [J].Nature,2010,465(7299):798-802.
[7]JOSHI P A,JACKSON H W,BERISTAIN A G,et al.Progesterone induces adult mammary stem cell expansion [J].Nature,2010,465(7299):803-807.
[8]BARTEL D P.MicroRNAs:genomics,biogenesis,mechanism,and function [J].Cell,2004,116(2):281-297.
[9]KHRAIWESH B,ARIF M A,SEUMEL G I,et al.Transcriptional control of gene expression by microRNAs[J].Cell,2010,140(1):111-122.
[10]PLASTERK R H.Micro RNAs in animal development[J].Cell,2006,124(5):877-881.
[11]KOSIK K S.MicroRNAs and cellular phenotypy[J].Cell,2010,143(1):21-26.
[12]STADLER B M,RUOHOLA-BAKER H.Small RNAs:keeping stem cells in line[J].Cell,2008,132(4):563-566.
[13]HE X,EBERHART J K,POSTLETHWAIT J H.MicroRNAs and micromanaging the skeleton in disease,development and evolution [J].J Cell Mol Med,2009,13(4):606-618.
[14]HUANG J,ZHAO L,XING L,et al.MicroRNA-204 regulates Runx2 protein expression and mesenchymal progenitor cell differentiation [J].Stem Cells,2010,28(2):357-364.
[15]KIM Y J,HWANG S J,BAE Y C,et al.MiR-21 regulates adipogenic differentiation through the modulation of TGF-beta signaling in mesenchymal stem cells derived from human adipose tissue[J].Stem Cells,2009,27(12):3093-3102.
[16]LI X,JIN P.Roles of small regulatory RNAs in determining neuronal identity [J].Nat Rev Neurosci,2010,11(5):329-338.
[17]HACKL M,BRUNNER S,FORTSCHEGGER K,et al.miR-17,miR-19b,miR-20a,and miR-106a are down-regulated in human aging [J].Aging Cell,2010,9(2):291-296.
[18]TOME M,LOPEZ-ROMERO P,ALBO C,et al.miR-335 orchestrates cell proliferation,migration and differentiation in human mesenchymal stem cells[J].Cell Death Differ,2011,18(6):985-995.
[19]CHECK HAYDEN E.Thousands of proteins affected by miRNAs [J].Nature,2008,454(7204):561-562.
[20]ROSEN E D,MACDOUGALD O A.Adipocyte differentiation from the inside out[J].Nat Rev Mol Cell Biol,2006,7(12):885-896.
[21]GANGARAJU V K,LIN H.MicroRNAs:key regulators of stem cells[J].Nat Rev Mol Cell Biol,2009,10(2):116-125.

