小胶质细胞在不同损伤神经环境下CD200R的表达①
张吉娟 罗晓光 冯 昱 禹红梅 任 艳 何志义
(中国医科大学附属第一医院神经内科,沈阳110001)
小胶质细胞是中枢神经系统中最具有代表性的免疫细胞。自1891年首次描述小胶质细胞以来,其在中枢神经系统中的作用越来越受到人们的重视。小胶质细胞在帕金森病、阿尔兹海默病及脑部炎症、缺血等多种神经系统病变中发挥着损伤和修复的双重作用[1-3]。最新研究显示CD200-CD200R通路是中枢神经系统内下调小胶质细胞活化的重要机制[4]。CD200与CD200R结合触发细胞内信号级联放大系统功能,控制并下调单核巨噬细胞系统的活化。CD200是一种跨膜表达的糖蛋白,表达范围较广,主要在神经细胞、胸腺细胞、B细胞、T细胞、血管内皮细胞等[5]。其受体为CD200R,主要表达在单核巨噬细胞系统和少量的T细胞上,具有与其配体CD200非常相似的结构[6]。CD200与 CD200R结合触发细胞内信号级联放大的系统功能,控制并下调单核巨噬细胞系统的活化[7]。
本实验以鼠小胶质细胞瘤细胞(BV2)和鼠嗜铬细胞瘤细胞(PC12)细胞株分别代替小胶质细胞和神经细胞进行传代培养,考察小胶质细胞(BV2)在不同损伤神经环境下CD200R的表达情况。结果发现小胶质细胞(BV2)与损伤神经细胞(PC12)共育后,小胶质细胞CD200R表达增多,细胞状态良好。小胶质细胞与受损神经元之间的直接接触和二者之间的双向交流对于小胶质细胞的CD200R表达至关重要。
1 材料与方法
1.1 PC12及BV2培养及传代 PC12及BV2分别种于PC12培养基(5% 胎牛血清1640,均购自Hyclone公司,美国)及BV2培养基(含10% 胎牛血清DMEM,Hyclone公司,美国)中,其中PC12呈半悬浮状态生长,传代7~8次后,转为贴壁生长。BV2为贴壁细胞。至细胞生长良好时开始实验。
1.2 实验过程及分组
1.2.1 实验过程 以终浓度为500 nmol/L RT损伤PC12细胞,12小时后换新鲜1640培养液,再过12小时后收取上清及PC12细胞;损伤PC12上清与新鲜1640培养液以1∶3的比例用来培养BV2细胞;每孔收集的PC12细胞分成3等份分别与BV2细胞共育。正常培养的PC12细胞培养12小时后收取细胞及上清液,以上述比例用于试验。
1.2.2 具体分组 A、BV2以普通1640孵育作对照;B、BV2以正常PC12上清孵育;C、BV2以受损PC12上清孵育;D、BV2与正常PC12细胞共育;E、BV2与受损PC12细胞共育。
以孔板培养皿和相应尺寸的转移筛网建立两种细胞的共育培养系统,转移筛网孔径8 μm,能允许转移筛网内外的大分子蛋白和液体交流,但不允许细胞通过。共育结束后移走转移筛网及其上细胞,对培养皿上的细胞进行单独检测。每组检测时重复3~5次。
1.3 MTT检测 BV2细胞分别与正常的PC12细胞、RT预处理的PC12细胞共育培养及用正常和损伤的PC12上清孵育、正常1640培养作对照。培养24小时,重复3孔,每组至少重复3次。两种细胞的共育培养用转移筛网(孔径8 μm的transwell)间隔。移走PC12及转移筛网,检测时每孔加入MTT(5 g/L)20 μl,继续培养4小时,弃上清。每孔加入150 μl DMSO,震荡10分钟后,酶标仪570 nm波长下自动测OD值。细胞存活率(%)=处理组细胞OD/对照组细胞OD×100%。
1.4 倒置荧光显微镜检测 细胞分别与正常的PC12细胞、RT预处理的PC12细胞共育培养及用正常和损伤的PC12上清孵育、正常1640培养作对照。培养24小时,重复3孔,每组至少重复3次。两种细胞的共育培养用转移筛网(孔径8 μm的transwell)间隔。移走 PC12及转移筛网,去上清,PBS漂洗1次,4%多聚甲醛室温固定15分钟,PBS漂洗1次,抗CD200R一抗孵育4℃过夜,PBS漂洗3次,荧光二抗室温孵育1~2小时,PBS漂洗3次,镜下观察BV2。
1.5 ELISA检测CD200R蛋白表达 BV2细胞分别与正常的PC12细胞、RT预处理的PC12细胞共育培养及用正常和损伤的PC12上清孵育、正常1640培养作对照。培养24小时,重复3孔,每组至少重复3次。两种细胞的共育培养用转移筛网(孔径8 μm的transwell)间隔。移走PC12及转移筛网,去上清,PBS轻洗1遍。4%多聚甲醛室温固定15分钟,PBS轻洗 1遍,PBS 1×(1%BSA、0.1%Triton)固定1 小时,加入 CD200R(1∶300)40 μl每孔,4℃过夜,PBS 洗3 次,加入 Hrp二抗(1∶2 500),每孔40 μl,变色后加入 40 μl H2SO4,震荡 10 分钟后,酶标仪450 nm波长下测OD值,测出的OD值因受细胞数量的影响,需要与细胞存活率进行标准化,即ELISA OD值/细胞存活率,然后再进行分析比较。
2 结果
2.1 MTT实验结果 与正常对照组相比,正常神经细胞上清孵育组及损伤神经细胞上清孵育组OD值显著降低(P<0.05),细胞存活率下降,正常神经细胞共育组及损伤神经细胞共育组与正常对照组相比,OD值略高,但无统计学意义(P>0.05),细胞存活率无显著差异 (见表1,图1)。
2.2 倒置荧光显微镜观察结果 普通倒置显微镜下可见,正常BV2细胞单层生长,细胞体呈细长或椭圆,从胞体发出细长而有分支的突起,表面有许多小棘突,胞体饱满,细胞数量多,细胞间联系紧密,相互交织成簇状。D、E组与正常BV2细胞形态一致。B、C组细胞数量减少,贴壁细胞由原来细长或椭圆变小、变圆,细胞突触变短、甚至消失,细胞之间连接消失,核固缩,胞浆肿胀,胞膜尚完整。
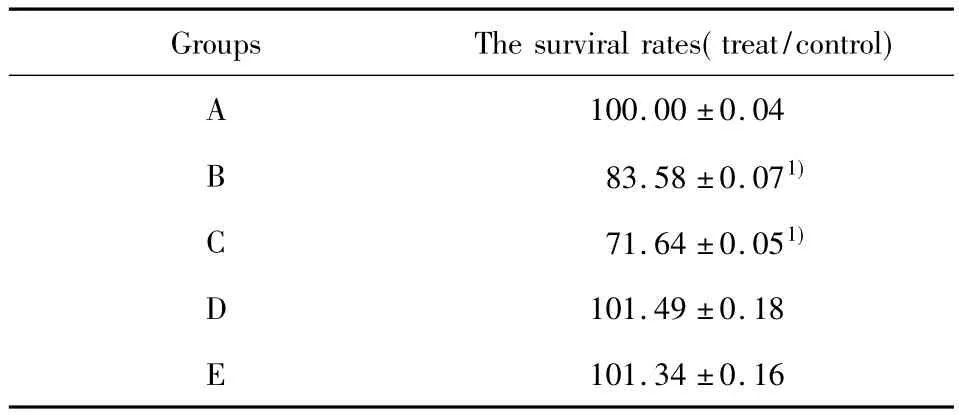
表1 不同损伤神经环境下BV2细胞的存活率(%)Tab.1 The survival rate of BV2 cells under different injury nerve environments(%)
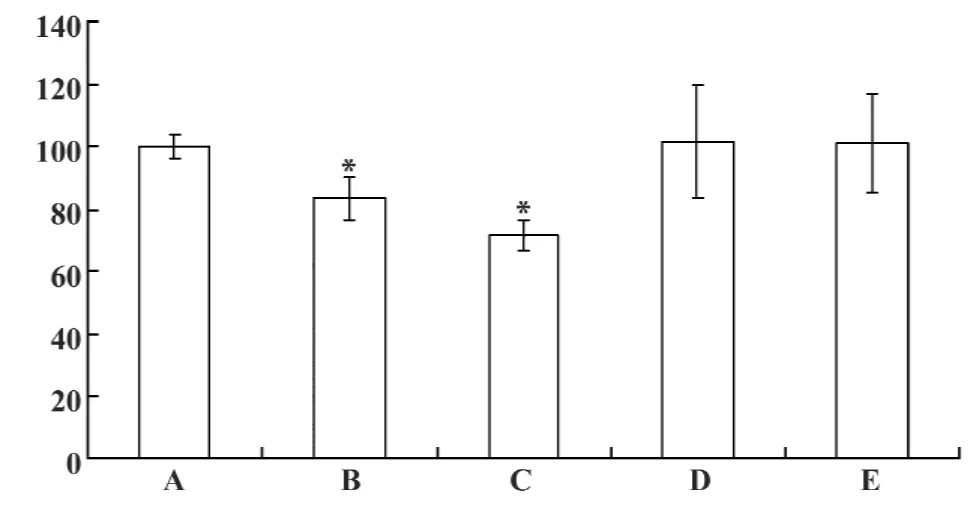
图1 不同损伤神经环境下BV2细胞的存活率(%)Fig.1 The survival rate of BV2 cells under different injury nerve environments(%)
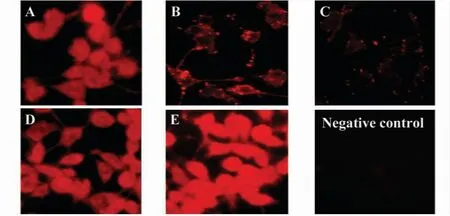
图2 不同损伤神经环境下BV2细胞CD200R的表达情况Fig.2 The expression of CD200R on BV2 cells under different injury nerve environments
荧光镜下见CD200R阳性细胞呈红色荧光,A、D、E组荧光明显,尤以E组突出。B、C组荧光较弱,C组荧光断续,部分消失(如图2)。
2.3 ELISA检测CD200R蛋白表达 经标准化后,与正常对照组(A组)相比,损伤神经细胞上清孵育组(C组)OD值显著降低(P<0.05),细胞CD200R表达减少;损伤神经细胞共育组(E组)OD值显著升高(P<0.05),细胞CD200R表达增加。正常神经细胞上清孵育组(B组),正常神经细胞共育组(D组)与对照组相比无显著差异(P>0.05)。如表2、图3。
3 讨论
神经元不仅仅是受小胶质细胞调节的对象,它也能够调控小胶质细胞的活化[8]。而神经元和小胶质细胞的相互作用主要是通过CD200-CD200R信号通路完成的,它在调控小胶质细胞的活化中起到了关键的作用[9]。本实验结果发现,无论与正常或受损的PC12共育,BV2细胞存活率与对照组无明显变化,而且与受损的PC12共育显著提高了BV2细胞CD200R的表达。此外,我们也看到无论是正常还是受损的PC12上清都可以影响BV2细胞的存活率,并且受损的上清使BV2的CD200R表达减少。提示小胶质细胞与受损神经元的直接接触和与神经元之间蛋白递质的双向交流对于小胶质细胞存活、活化和发挥生物学功能有很重要的影响。有实验结果显示[10]与损伤PC12直接共育的BV2显著提高了骨髓间充质细胞的神经营养功能,表现为以该骨髓间充质细胞培养上清液温育受损PC12后,PC12的凋亡同对照组相比显著减少,而与健康PC12共育的BV2一定程度上也提高了骨髓间充质细胞的神经营养功能。提示神经元的损伤是小胶质细胞对骨髓间充质细胞神经营养功能施加良性影响的重要条件。联系本实验,小胶质细胞可能是通过CD200R发挥神经营养功能。本实验支持了小胶质细胞的活化受神经元的影响,并且在神经变性病的早期神经元通过CD200/CD200R信号系统抑制小胶质细胞活化的能力更强,损伤神经元较远处的小胶质细胞CD200R表达低,可能表明处于较强的激活状态,而受损神经细胞附近的小胶质细胞则有可能受到有效调控,提高CD200R表达,炎症得到有效控制。
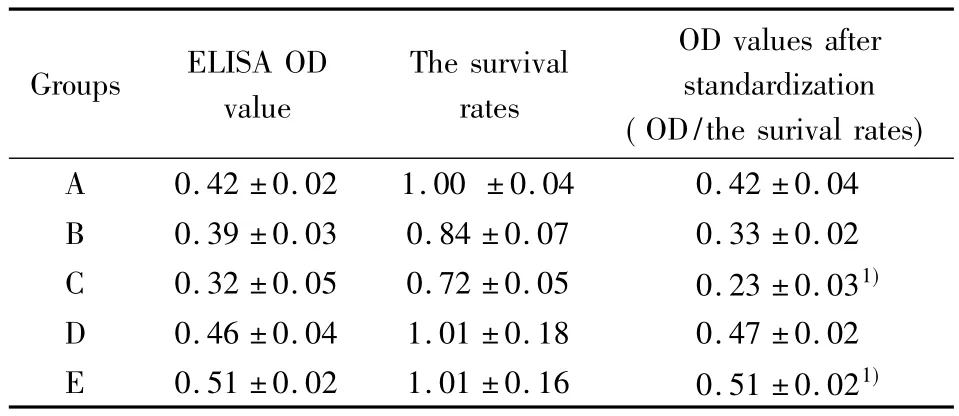
表2 标准化后的各组OD值Tab.2 Groups OD after standardization
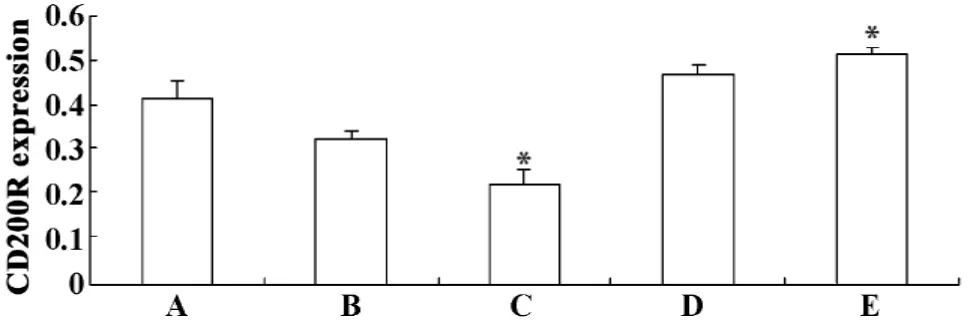
图3 各组CD200R的表达Fig.3 The expression of CD200R
因此,以CD200-CD200R为靶点调控小胶质细胞有望成为神经系统疾病研究领域的新方向。从这条途径出发较现行其他途径可能更有前途,因为以CD200-CD200R为靶点调控小胶质细胞不仅考虑到小胶质细胞激活对神经元的毒性作用,也考虑到神经元对小胶质细胞的作用,较现行的其他研究更符合机体内部的规律,以保证机体完成复杂精确的信息传递。对CD200-CD200R信号系统的深入研究,可能为探讨神经系统疾病的发病机制及治疗提供新的线索。
1 Dehmer T,Lindenau J,Haid S et al.Deficiencyof inducible nitric oxide synthase protects against MPTP toxicity in vivo[J].J Neurochem,2000;74(5):2213-2216.
2 Xiang Z,Haroutunian V,Ho L.Microglia activation in the brain as inflammatory biomarker of Alzheimer's disease neuropathology and clinical dementia. [J].Dis Markers,2006;22(1-2):95-102.
3 Jens Neumann,Matthias Gunzer,Gutzeit H O et al.Microglia provide neuroprotection after ischemia[J].FASEB,2006;20:714-716.
4 Sastre M,Klockgether T,Heneka M T.Contribution of inflammatory processes to Alzheimer's disease:molecular mechanisms[J].Int J Dev Neurosci,2006;4(2-3):167-176.
5 Teismann P,Tieu K,Cohen O et al.Pathogenic role of glial cells in Parkinson's disease[J].Mov Disord,2003;18(2):121-129.
6 Launer L.Nonsteroidal anti-inflammatory drug use and the risk for Alzheimer's disease:dissecting the epidemiological evidence[J].Drugs,2003;63(8):731-739.
7 Hatherley D,Barclay A N.The CD200 and CD200 receptor cell surface proteins interact through their N-terminal immunoglobulin-like domains[J].Eur J Immunol,2004;34(6):1688-1694.
8 Combs C K,Karlo J C,Kao S C.beta-Amyloid stimulation of microglia and monocytes results in TNFalpha-dependent expression of inducible nitric oxide synthase and neuronal apoptosis.[J].Neurosci,2001;21(4):1179-1188.
9 Smith M E.Phagocytic properties of microglia in vitro:implications for a role in multiple sclerosis and EAE[J].Microsc Res Tech,2001;54(2):81-94.
10 罗晓光,葛春林,任 艳.与损伤神经细胞共育后小胶质细胞促进骨髓间充质干细胞神经保护功能[J].细胞生物学杂志,2007;29(4):595-599.

