Combretastatins类肿瘤血管阻断剂的构效关系研究*
周 全 ,陈建伟 ,刘晓蓉
1南京中医药大学药学院,南京 210046;2南京圣和药业有限公司,南京 210038
恶性肿瘤严重威胁着人类的健康,目前临床上常用的抗肿瘤药物既包括传统的细胞毒药物,也有新型的靶向抗肿瘤药物。Combretum caffrum系一种非洲灌木,其根、皮一直被当地的Xhosa人用来治疗癌症[1],从其树干中提取分离得到的顺式二苯乙烯类化合物考布他汀(Combretastatin A4)是目前已知微管蛋白抑制剂中活性最强的化合物之一[2]。1973年,美国国家癌症研究所(NCI)首次对该种植物进行了采集[3]。1979年,亚利桑那州立大学Pettit GR教授的研究小组开始与NCI共同进行Combretum caffrum中化学成分的研究。至1987年,该小组先后从中分离得到了17个Combretastatins类化合物[4](见图1)。
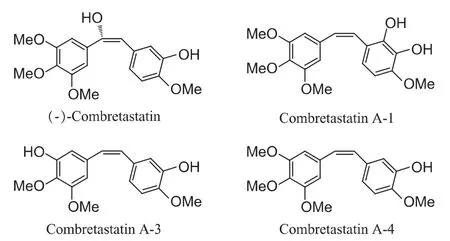
图1 Combretastatins类化合物的结构式
经筛选发现,在这些化合物中,Combretastatin A-4(CA4)及 CombretastatinA-1(CA1)的体外抗肿瘤活性及微管蛋白抑制效果最佳,且显示出选择性抑制肿瘤血管增生的活性[2],属于微管抑制型血管阻断剂(vascular disrupting agent,VDA)。 由于 CA4和CA1的水溶性低,很难制成合适的剂型用于临床,其磷酸盐前药CA4P和OXi4503及其他结构改造物应运而生。经过多年研究,目前活跃于临床的Combretastatins化合物主要有CA4P(Ⅱ期)、Oxi-4503(Ⅱ期)及 AVE-8062(Ⅲ期)。
Combretastatins类抗肿瘤化合物结构中的顺式双键易异构化成反式构型,从而导致其半衰期较短。这个问题促使人们设计和合成改善顺式构型限制的CA4衍生物,改造主要集中在两个苯环的位置和顺式双键。本课题组依据晶体结构进行药效基团构建,发现A环三个甲氧基中对位的甲氧基不是与靶点作用所必需的,依据此发现设计并合成了6个全新目标化合物,具体的名称与结构见图2、表1。
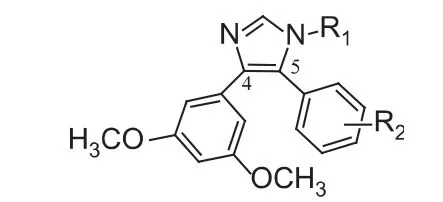
图2 CA4衍生物的结构式
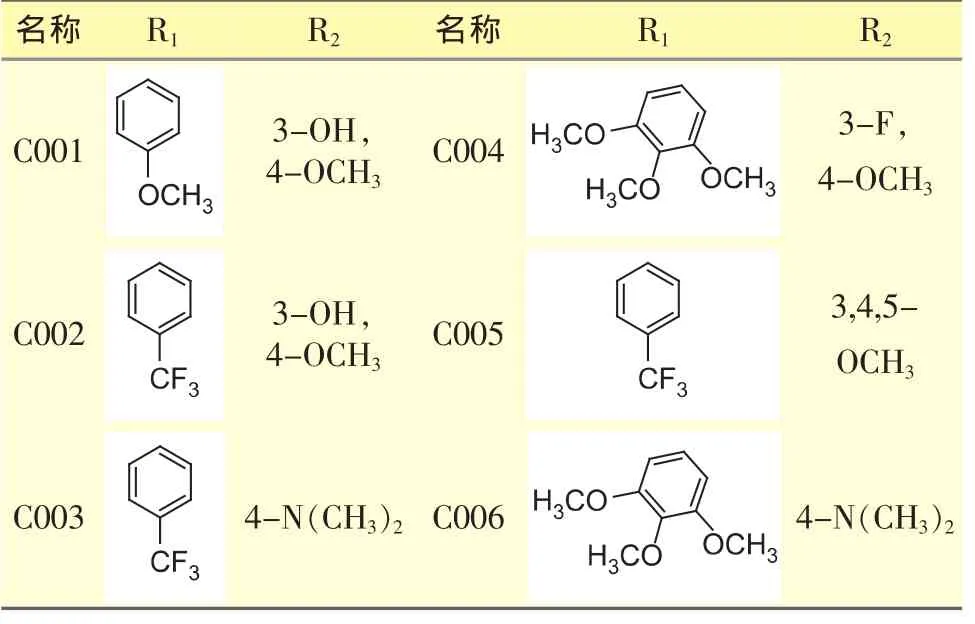
表1 6个CA4衍生物的取代基团
1 材 料
1.1 受试样品、试剂
受试样品由南京圣和药业有限公司合成室合成所得。药物及配制:CP001~CP020为测试药物,阳性对照药物为CA4及顺铂;药物分别溶于DMSO(二甲基亚砜),并等比例稀释成5个浓度(0.01~100 μmol·L-1)。
苯甲醛衍生物(上海海曲化工厂),常用试剂为市售分析纯。
1.2 细胞株、培养基
K562(人粒性白血病)、MCF-7(人乳腺癌)、DU-145(人前列腺癌)、NCI-H460(人非小细胞肺癌)、HCT-116(人结肠癌细胞)均由本实验室传代并保种。
RPMl 1640培养基(含10%胎牛血清)。
1.3 仪器
YRT-3数字熔点仪;Bruker AV-300和 Bruker AV-500型核磁共振仪;Agilent LC-MSD-Trap-SL型质谱仪;ZF-Ⅰ型三用紫外分析仪;HSGF254型高效薄层层析板(烟台江友硅胶开发有限公司);柱层析硅胶(青岛海洋化工厂,200~300目)。
Napco5420-I型及Sanyomc0175型CO2培养箱(Napco 公司和 Sanyo 公司);Adventuxe:万分之一电子天平 (Ohaus公司);Wellscan MK3型酶标仪(Labsystems Dragon公司);UV-260型紫外-可见分光光度仪 (Shimadza公司);Spectra MAX fluorescence microplate reader荧光密度测定仪 (美国Gemini XS,Molecular Devices公司)。
2 方法与结果
2.1 结构鉴定
2.1.1 5-(3-羟基-4-甲氧基苯基)-4-(3,5-二甲氧基苯基)-1-(4-甲氧基苯基)咪唑(C001)白色固体,mp 131~134℃。1H-NMR(300 MHz,CDCl3) δ:3.92(s,6H,2×OCH3),4.07(s,3H,1×OCH3),4.13(s,3H,1×OCH3),6.40~6.43 (t,1H,1×Ar-H),6.71~6.81(m,7H,7×Ar-H),7.1(m,2H,2×Ar-H),7.67(s,1H,imidazole-H)。 ESI-MS m/z:433.2[M+1]+,分子量:432。
2.1.2 5-(3-羟基-4-甲氧基苯基)-4-(3,5-二甲氧基苯基)-1-(4-三氟甲基苯基)咪唑(C002)淡黄色固体,mp 111~113℃。1H-NMR(300 MHz,CDCl3)δ:3.72 (s,6H,2×OCH3),3.93 (s,3H,1×OCH3),6.34~6.35(t,1H,1×Ar-H),6.74~6.88(m,5H,5×Ar-H),7.11 (d,2H,2×Ar-H),7.64 (d,2H,2×Ar-H),7.88(s,1H,imidazole-H)。 ESI-MS m/z:471.2[M+H]+,分子量:470。
2.1.3 5-(4-二甲氨基苯基)-4-(3,5-二甲氧基苯基)-1-(4-三氟甲基苯基)咪唑(C003)淡黄色固体,mp 84~84.5℃。1H-NMR(300MHz,CDCl3)δ:3.67(s,6H,2×OCH3),6.62~6.64(m,2H,2×Ar-H),7.00~7.03(m,2H,2×Ar-H),7.24~7.25(m,2H,2×Ar-H),7.59~7.60(m,3H,3×Ar-H),7.67~7.68(m,2H,2×Ar-H),7.78 (s,1H,imidazole-H)。 ESI-MS m/z:468.2(M+1)+,分子量:467。
2.1.4 5-(3-氟-4-甲氧基苯基)-4-(3,5-二甲氧基苯基)-1-(3,4,5-三甲氧苯基)咪唑(300 MHz,
C004)白 色 固 体 ,mp 157~158.4℃ 。1H-NMR(CDCl3) δ:3.72 (s,12H,4×OCH3),3.85 (s,3H,1×OCH3),3.89(s,3H,1×OCH3),6.33(s,2H,2×Ar-H),6.36~6.37(d,1H,1×Ar-H),6.74~6.76(d,2H,2×Ar-H),6.89~6.92 (m,2H,2×Ar-H),6.95~6.97(m,1H,Ar-H),7.76 (s,1H,imidazole-H)。ESI-MS m/z:495.2(M+1)+,分子量:494。
2.1.5 5-(3,4,5-三甲氧基苯基)-4-(3,5-二甲氧基苯基)-1-(4-三氟甲基苯基)咪唑(C005)粘稠状液体。1H-NMR(300MHz,CDCl3) δ:3.60(s,6H,2×OCH3),3.68(s,6H,2×OCH3),3.85(m,3H,1×OCH3),6.35~6.37(m,2H,2×Ar-H),6.78~6.79(d,2H,2×Ar-H),6.88(m,1H,1×Ar-H),7.28~7.30(m,2H,2×Ar-H),7.64~7.65(m,2H,2×Ar-H),7.82(s,1H,imidazole-H)。 ESI-MS m/z:515.2(M+1)+,分子量:514。
2.1.6 5-(4-二甲氨基苯基)-4-(3,5-二甲氧基苯基)-1-(3,4,5-三甲氧基苯基)咪唑(C006)淡黄色固体,mp 151~154℃。1H-NMR(300 MHz,CDCl3)δ(ppm):2.93(s,6H,2×N-CH3),3.64~3.70(m,12H,4×OCH3),3.87(s,3H,1×OCH3),6.31~6.33(m,2H,2×Ar-H),6.37~6.39 (m,1H,1×Ar-H),6.62~6.64(m,2H,2×Ar-H),6.82~6.84(m,2H,2×Ar-H),7.04~7.06(m,2H,2×Ar-H),7.75 (s,1H,imidazole-H)。 ESIMS m/z:490.3(M+1)+,分子量:489。
2.2 体外抗肿瘤活性的测定
参照MTT法[5],用酶标仪于570 nm波长下测量各孔的OD值[5]。根据孙氏综合法(改进寇氏法)计算各测试药物对各细胞株的半数抑制浓度(IC50),实验结果见表2。
根据化合物的体外抑制肿瘤细胞增殖活性结果,初步的构效关系如下:化合物C001、C003、C004、C005、C006对所测的细胞菌株显示了中等或较弱的抑制活性,而化合物C002对所测的5种细胞株均表现出较好的体外抗肿瘤活性,具有较广的抗瘤谱。其体外抗肿瘤活性与对照药CA4相当,具有进一步研究价值。
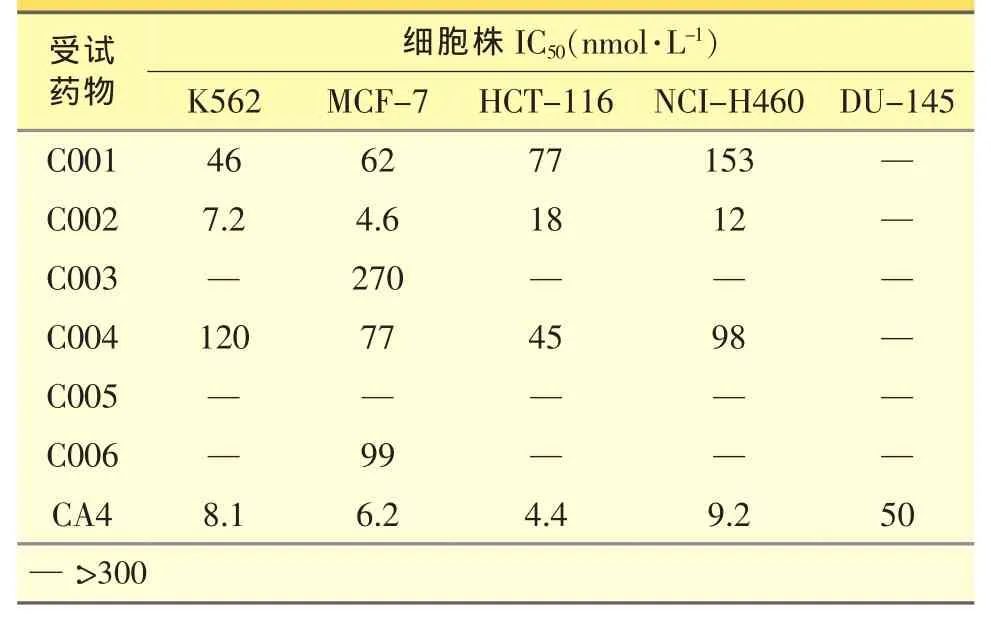
表2 化合物体外抗肿瘤活性
2.3 酶抑制的活性测定
从液氮罐中取出已纯化的Tubulin(微管蛋白)置于1.5 mL离心管,放入冰盒。PMEG缓冲液配制适 量 的 含 有 5 μmol·L-1Tubulin 和 10 μmol·L-1DAPI染色液溶液,混匀,注意避光,放入冰盒中备用。将黑色96孔板放入冰盒中预冷,然后用微量移液器将含有 Tubulin(终浓度为 5 μmol·L-1)和 DAPI(终浓度为 10 μmol·L-1)的 PMEG 缓冲液加入 96 孔板后,将待测样品加入至总体积为200 μL,对照组加入相同体积的DMSO。DMSO的终浓度保持在4%(V/V)以下。微孔内溶液快速混匀,并注意避免产生气泡。将96孔板放入预热到37℃的荧光酶标仪中,每一份样品平行测定2组。激发光和发射光波分别设定在370 nm和445 nm,每隔1min测定一次,直到达到平台期。药物诱导微管蛋白装配的EC50是聚合量达到最大聚合量50%时的药物浓度。ΔF可用平台期的荧光强度减去相应时间对照组的荧光强度得到。
应用GraphpaDPrism4软件对ΔF与药物浓度作图,并根据下述公式得到半数有效浓度EC50值,计算公式:ΔF=ΔFmaxX[drug]/(EC50+[drug])。
按这一公式计算,化合物抑制微管蛋白聚合活性结果见表3。

表3 化合物抑制微管蛋白聚合活性
通过以上药效实验,发现化合物C002体外抗肿瘤活性与CA4相当。构效关系分析表明:B环的取代对于活性影响较大,3-OH、4-OCH3和3-F、4-OCH3的化合物活性较好,改变为其他的取代基则活性丧失。
[1]尹华熙,吴 萍,徐小平,等.抗肿瘤新药CA4P及其有关物质的IR结构解析 [J].华西药学杂志,2008,23(5):523-5.
[2]陈再新,马维勇,张椿年.天然产物Combrestastatins的研究进展[J]. 天然产物研究与开发,2008,13(1):76-80.
[3]Pinney KG,Jelinek C,Edvardsen K,et al.The discovery and development of the Combretastatins[J].Anti A-gents Nat Prod,2005:23-46.
[4]Lin CM,Singh SB,Chu PS,et al.Interactions of tubulin with potent natural and synthetic analogs of the antimitotic agentcombretastatin:a structure-activity study[J].Mol Pharmacol,1988,34(2):200-8.
[5]楼成华,王明艳,杨 欢,等.镰形棘豆中黄酮类化合物抗肿瘤活性的体外实验研究 [J].南京中医药大学学报,2009,25(1):46-50.