藤甲酰苷缓释片的制备及体外释药因素考察
陈 烨,王 洋,刘忠忱,李文君,邓晶晶,徐利锋(辽宁大学药学院,辽宁沈阳110036)
藤甲酰苷是由天然产物提取物藤黄酸(gambogic acid)经三步反应合成得到的藤黄酸的衍生物,为新实体化合物,目前国内外均无相关报道。药理实验研究显示,它具有一定的细胞毒性,对白血病细胞HL-60(TB)、黑素瘤细胞LOX IMVI具有明显抑制作用,其 IC50值分别为21.0 nmol/L和19.8 nmol/L[1]。动物实验研究显示,藤甲酰苷的口服半衰期为2.2 h,代谢速度较快,如用于临床治疗则需要多次连续给药,给患者用药带来不便,同时也会产生很大的毒性。研制藤甲酰苷缓释片可有效地延长其代谢时间,降低毒副作用,提高患者的顺应性。笔者采用亲水性高分子材料羟丙基甲基纤维素(HPMC)为主要缓释材料、乙基纤维素(EC)为骨架材料、乳糖为致孔剂、微晶纤维素为添加剂,研制出12 h给药1次的藤甲酰苷亲水凝胶骨架型缓释片,并对影响该缓释片体外释放药物的因素进行了研究[2]。现报告如下.
1 仪器与试剂
DP30型单冲压片机(上海天凡药机制造厂);RZC-6C2型药物溶出仪(上海黄海药物仪器有限公司);Waters 1525 Brnary高效液相色谱仪/泵(美国Waters公司);Waters 2487高效液相色谱仪/检测器(美国Waters公司);78X22片剂四用测定仪(上海黄海药检仪器厂);数显式恒温干燥箱(余姚市远东数控仪器厂);电子天平(Mettler-Toledo Group)。
藤甲酰苷原料(辽宁大学药学院研制);羟丙基甲基纤维素K4M、羟丙基甲基纤维素K15M、乙基纤维素EC 10FP(上海卡乐康包衣技术有限公司);羟丙基甲基纤维素60RT4000(山东瑞泰化工集团有限公司);乳糖(美国FMC公司),其余辅料均为药用级。
2 方法与结果
2.1 缓释片的制备及含量测定方法
2.1.1 缓释片的制备 以HPMC为缓释材料、EC为骨架材料、乳糖为致孔剂、微晶纤维素(MCC)为填加剂,按处方比例称取过100目筛的藤甲酰苷与HPMC等辅料,混合均匀,无水乙醇为黏合剂制成软材,过20目筛制粒,55℃烘干,30目筛整粒,加1%(w/w)滑石粉混匀,压片,制成藤甲酰苷缓释片,每片含藤甲酰苷60 mg。
2.1.2 缓释片的含量测定方法 依照《中国药典》2010年版二部附录ⅤD的高效液相色谱法测定。
色谱条件与系统适用性试验:用十八烷基硅烷键合硅胶为填充剂;以甲醇-0.05%磷酸水溶液为流动相;检测波长为331 nm。理论板数按藤甲酰苷计算不低于2 000。
测定法:取本品20片,精密称定,研细,精密量取适量(约相当于藤甲酰苷25mg),置50 ml量瓶中,加甲醇适量,摇匀,滤过,精密量取续滤液3 ml,置25 ml量瓶中,用流动相稀释至刻度,摇匀,精密量取20 μl,注入液相色谱仪,记录色谱图;另量取藤甲酰苷对照品适量,精密称定,加甲醇溶解并定量稀释制成每1 ml中含藤甲酰苷60 μg的溶液,同法测定。按外标法以峰面积计算,即得。
2.2 释放度方法的建立
2.2.1 标准曲线绘制 精密称取藤甲酰苷对照品约25 mg于50 ml量瓶中,用甲醇溶解并稀释至刻度,摇匀,制成储备液。精密吸取储备液2.0、2.5、3.0、3.5、4.0 ml,分别置于 25 ml量瓶中,稀释至刻度,摇匀,在331 nm处测定峰面积A,并以浓度(C)对峰面积(A)进行线性回归,得标准曲线方程:A=13 806.6C+7 887.6,线性范围为40.80~81.60 μg/ml,r=0.999 8。
2.2.2 方法重复性试验 取标准曲线试验项下61.2 μg/ml的样品溶液,间隔2 h测定一次,共测定6次,计算样品的日内RSD值为0.18%,表明方法的重复性良好。
2.2.3 体外释放度的测定 取本品,按释放度测定法(《中国药典》2010年版二部附录X D第一法)的有关规定进行测定[3]。转速为 100 r/min,温度为37℃,释放介质为900 ml,质量分数为0.5% 的十二烷基硫酸钠(SDS),避光操作,按规定时间点取样4.5 ml,补加等量介质。释放液经0.45 μm微孔滤膜过滤,取续滤液作为供试品溶液。照“2.1.2”节方法分别测定,计算累计释放百分率。测得本品每片在2、6、12 h的释放度分别为 10% ~35%、35%~65%和80%以上。
2.3 体外释药行为的考察
2.3.1 不同规格的HPMC对药物释放的影响 采用3种不同规格的羟丙基甲基纤维素即:HPMC 60RT4000、K4M、K15M,用量均为片剂辅料总量的30%,加入处方量的乳糖、EC和微晶纤维素,按“2.1”节的操作制备藤甲酰苷缓释片。按“2.2.3”节的方法分别测定不同时间点缓释片剂的累计释放百分率,绘制释药曲线图,结果见图1。

图1 HPLC的规格对药物体外释放的影响
结果表明,不同规格的HPMC对释放有一定影响,其中,K4M释放度优于其他两种辅料,故选择K4M作为缓释材料。
2.3.2 不同用量的HPMC对药物释放的影响 选用HPMC(K4M)作为骨架材料,使其用量占片剂辅料总量的20%、30%、40%、50%、60%左右,用微晶纤维素调节片重。按“2.1”节的操作制备藤甲酰苷缓释片。按“2.2.3”节的方法分别测定不同时间点缓释片剂的累计释放百分率,绘制释药曲线图。结果见图2。
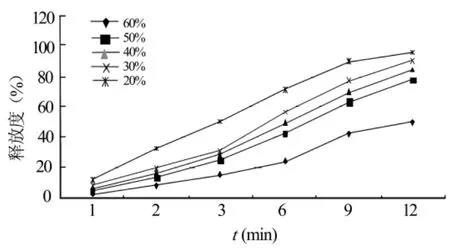
图2 HPMC的用量对药物体外释放的影响
结果表明,不同用量的HPMC对释放有很大影响,30%用量的释放度优于其他4种用量,故选择30%用量的HPMC为宜。
2.3.3 不同致孔剂对药物释放的影响 选用HPMC(K4M)作为骨架材料,使其用量占片剂辅料总量的30%,用微晶纤维素代替乳糖。同上述工艺过程制备缓释片。按2.2.3方法操作分别测定不同时间点缓释片剂的累计释放百分率,结果见图3。结果表明,用微晶纤维素代替乳糖,药物的释放速度会减慢。
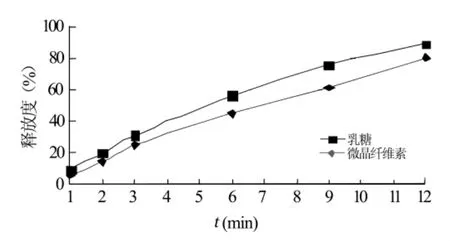
图3 不同致孔剂对药物体外释放的影响
2.3.4 释放条件——转速对药物释放的影响 测定同一处方、同一批次缓释片在相同的溶出介质中,搅拌速度分别为50、75、100 r/min时藤甲酰苷缓释片的体外释放速度。按“2.2.3”节的方法分别测定不同时间点藤甲酰苷缓释片剂的累计释放百分率,绘制释药曲线图,结果见图4。
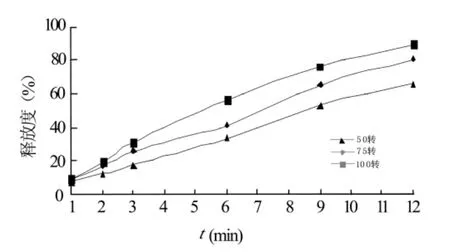
图4 搅拌速度对药物体外释放的影响
结果表明,转速越快药物的释放速率也加快,说明搅拌速度对药物的释放产生一定的影响,原因是转速快可以加速致孔剂的的溶出,进而加速药物的释放。
2.3.5 不同压片的压力对药物释放的影响 在压片压力为 2~4 、4~6、6~8 kg/cm2的条件下,制备不同硬度的藤甲酰苷缓释片,按“2.2.3”节的方法分别测定压片压力对释放度的影响。结果见图5。
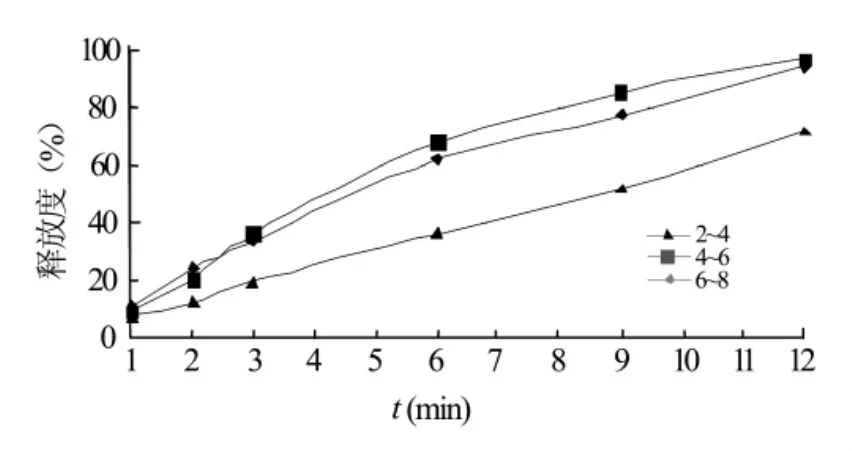
图5 不同的压片压力对药物体外释放的影响
结果表明,当压片压力很小时,缓释片释放较慢;当压力增加大到一定值后,释放度随压力的增加变化不大。
2.4 缓释片剂的质量考察
2.4.1 释放均一性 取优化处方制得的同批次藤甲酰苷缓释片(批号:090408)4片,按“2.2.3”节的方法测定不同时间累计释药百分率,结果见图6。
由图6可知,药物释放均一性良好。
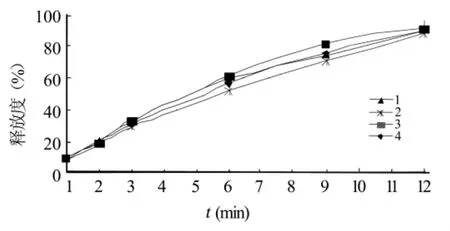
图6 均一性对药物体外释放的影响
2.4.2 工艺重现性 按优化处方制备二批次藤甲酰苷缓释片(批号:090408;090410),按“2.2.3”节的方法分别测定不同时间点缓释片剂的累计释放百分率,绘制释药曲线图,结果见图7。由图7可知,制备方法的工艺重现性良好。
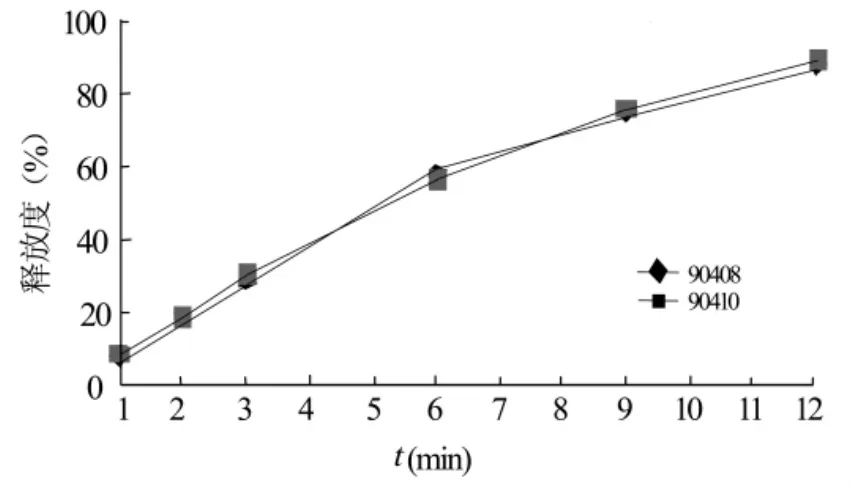
图7 工艺重现性对药物体外释放的影响
2.4.3 释放度-时间-pH值三维图 对于口服缓控释制剂,药物在体内的释药过程较长,要经过多个器官,如:从pH接近1.0的胃部到达pH值约为7.4的结肠,这期间药物释放环境的pH值变化跨度较大,为了使药物的释放更符合人体消化道环境,进一步考查了随着时间的变化,释放介质pH值的变化对释放度的影响,得到了释放度-时间-pH值三维图,见图8。结果显示,随着释放介质pH的变化,药物的释放速度变化不大。说明藤甲酰苷从缓释片中的释放过程受释放介质pH值的影响不大,但在中性或弱酸性、弱碱性条件下释放速度在后期略微降低。释放度-时间-pH值三维图能为制剂的质量控制提供更全面、更广泛的释药行为方面的依据,帮助评价、判断产品质量并为体内生物利用度的预测提供依据。
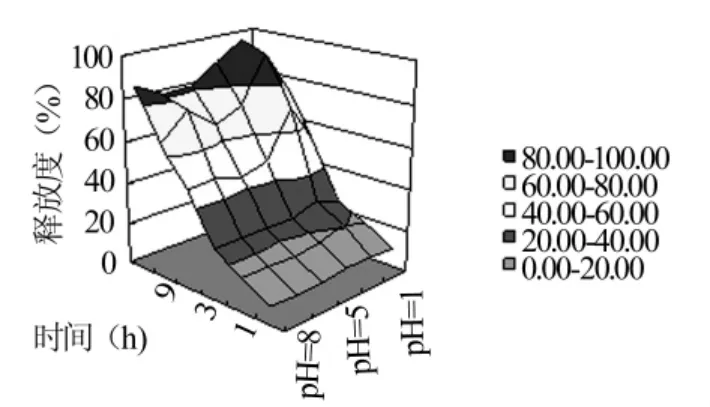
图8 pH值对药物体外释放的影响
3 讨论
根据文献报道,HPMC在高黏度范围内,黏度对难溶性药物释放有显著的影响,而对水溶性药物的释放影响不大。本实验研究结果表明,随HPMC黏度的增加,药物的释放变缓,药物的释放随着HPMC黏度的不同而表现出不同的释药特征。骨架材料的用量是影响释药速率的重要因素,理论上讲,HPMC用量增加,凝胶层厚度和强度增大,释药速率减慢[4],本试验结果也证实了这一点。微晶纤维素为水不溶性物质,但遇水易膨胀,在片剂中具有促进和阻滞药物释放的双重作用,对能抵制其膨胀性的骨架,它主要表现为阻塞水通道的阻滞释放作用。由本研究的结果可以看出,微晶纤维素对药物的释放有较大的影响,导致药物释放缓慢,表明在此处方中,微晶纤维素作用是阻止水分渗入药片、阻滞药物释放,因而药物释放速度减慢。
当制片压力很小时,可能会使片剂的骨架疏松,空隙率增大,水会迅速地进入缓释片,在片剂的表面形成很厚的水凝胶层,不利于药物的释放。藤甲酰苷在0.5%(w/v)十二烷基硫酸钠水溶液中的溶解度相对较小,当压片压力过小时,凝胶溶胀时藤甲酰苷停留在了凝胶层,从而阻碍了药物的释放;而压力增加至一定值后,骨架紧密、孔隙率随压力改变变化不大,由于片厚降低,药物在水凝胶层停留的时间减少,故释放速度加快
[1]徐利锋.藤黄酸苷衍生物和类似物及其制备方法和用途[P].中国专利,101289482A,2008-10-22.
[2]Zong L,Chen LL,Zhang Y.Studies on nitrendipine sustained-release tablets and in vitro release se characteristics[J].J China Pharm Univ,2004 ,35(6):503.
[3]中国药典2010版.二部[S].2010:附录,87.
[4]颜耀东.缓释控释制剂的设计与开发[M].北京:中国医药科技出版社,2006:68.

