2007年~2011年济南战区抽验制剂质量问题分析与对策
赵庆华,巩 伟,王爱武,张振兴(.济南军区联勤部药品仪器检验所,山东 济南500;.山东大学附属省立医院,山东济南500)
医疗机构制剂是根据本单位临床需要经批准配制而成的自用的标准制剂和非标准制剂,具有用量小,贮存期短,市场供应缺乏,临床必需等特性,在临床治疗中发挥了重要的作用。但毋庸讳言,其质量也存在一定问题。近年来,国家及军队对药品安全包括自制制剂的质量极为重视,监管力度逐年加大。2007年,《药品注册管理办法》、《药品GMP检查认定评定标准》、《药品流通监督管理办法》、《药品广告审查办法》、《药品广告审查发布标准》和《药品召回管理办法》等一系列药品法规相继修订发布。2009年全军药品监督机构针对临床常用且易出质量问题的制剂实行交叉抽验,2010年全军对医疗机构制剂室进行了换证和再注册工作,淘汰了临床疗效不确切、不良反应多、质量不可控及已有市售药品的品种,使医疗机构对制剂质量的提高更加重视。我区有100多家医疗机构,其中具备生产制剂资质的有16家,允许生产的制剂品种1 700多种,随着制剂监督审查力度的加大,允许生产的制剂品种降至890多种。我所近年来亦加强了对医疗机构制剂的抽验检查,扩大了抽验品种,增加了抽验批次,促进了辖区内医疗机构制剂质量的提高,抽检制剂不合格率呈下降趋势。本文就我区2007年~2011年抽验制剂质量存在的问题进行分析,为促进我区医疗机构制剂质量的提高提供对策。
1 资料与方法
汇总我所2007年~2011年制剂检验记录,对医疗机构制剂抽验不合格情况进行描述性统计分析。
2 结果
2.1 总体情况 2007年~2011年共抽验我区医疗机构制剂1 177批,总合格率为96.18%;不合格制剂共45批,不合格率为3.82%,其中外用制剂21批(占不合格制剂的46.7%,下同),内服制剂20批(44.4%),无菌制剂4批(占8.9%)。详见表1。
2.2 不合格项目 2007~2011年抽验不合格制剂的不合格项目共8项,包括微生物限度、含量测定、装量、性状、鉴别、标签、pH、包装等。详见表2。
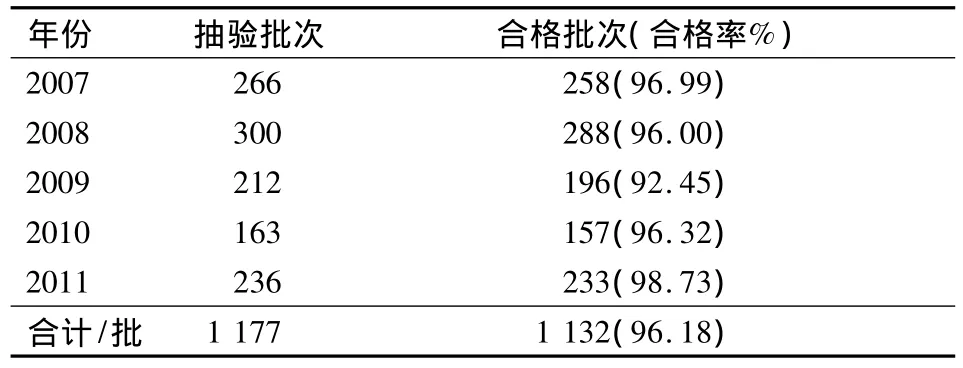
表1 2007~2011年我区抽验医疗机构制剂质量总体情况
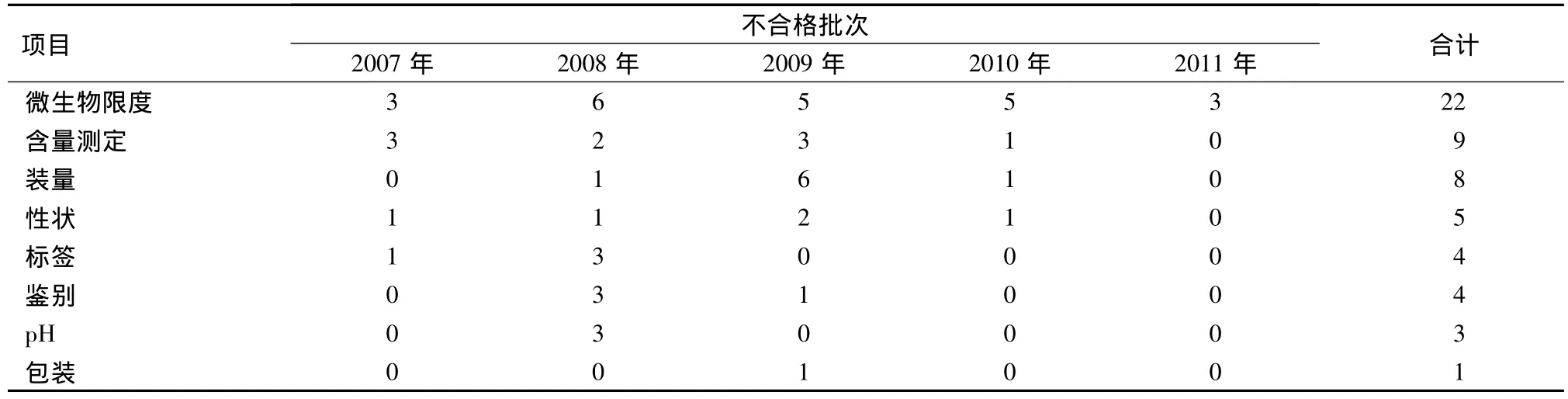
表2 2007~2011年我区抽验医疗机构制剂不合格的项目与批次统计
涉及剂型共15种,其中外用剂型9种(溶液剂、外用灭菌溶液剂、洗剂、滴鼻剂、滴耳剂、甘油剂、酊剂、散剂、软膏剂);内服剂型5种(口服溶液剂、口服液、合剂、芳香水剂、丸剂);灭菌制剂1种(注射剂)。
3 分析
针对上述抽验结果,重点对2007年~2011年抽验不合格制剂的不合格项目和原因作分析和讨论。
3.1 微生物限度不合格 共22批,其中内服溶液剂14批,外用制剂8批;50%硫酸镁溶液有9批,炉甘石洗剂6批。不合格主要原因:①制剂配制卫生环境不符合规定;②制剂包材密封不严,运输、储藏过程中受到污染。如硫酸镁溶液,多釆用塑料瓶包装,密封性差,受温度、湿度、时间等各方面的影响较大,存放期间易生霉变质。
3.2 含量测定不合格 共9批,有碘酊、复方苯甲酸醇溶液、水杨酸醇溶液、复方硼砂溶液等。不合格主要原因,①制剂的处方不合理:如碘酊(2%),《中国药典》和《中国人民解放军医疗机构制剂规范》均规定加碘化钾 15 g[1,2],但《中国人民解放军医疗机构制剂规范》增补本规定加碘化钾为12 g[3]。处方中碘化钾的加入量不同,从而导致检验结果出现差异。为统一处方,消除差异,提高该制剂的质量,我所按照总后安排在军队医疗机构制剂标准提高的课题任务中已展开对碘酊的质量标准的探索研究工作。②个别包材密封性不好:如复方苯甲酸醇溶液和水杨酸醇溶液多因容器密封不严,贮存期间醇溶液挥发,导致含量升高。③个别制剂生产人员责任心不强:没有严格执行操作规程,导致制剂的含量不合格。
3.3 装量不合格 有8批,包括4批50%硫酸镁溶液,1批复方苯甲酸醇溶液,2批复方氯霉素醇溶液和1批丸剂。不合格主要原因:①分装设备简易,缺乏精确的自动控制系统;②溶液剂多采用塑料瓶包装,密封不严实,在存贮、运输过程中易造成外漏(如水溶液剂)或外渗(如醇溶液剂)。比如复方苯甲酸醇溶液和水杨酸醇溶液均因运输中液体外流,贮存期间挥发,导致装量减少。
3.4 性状不合格 有盐酸普鲁卡因溶液、薄荷水、50%硫酸镁溶液、复方苯酚溶液。不合格主要原因:①主药的稳定性差,包材遮光不好,导致制剂变质。比如复方苯酚溶液中的主要成分苯酚含有酚羟基,稳定性较差,易氧化变色。②未严格按照制剂生产工艺制备。在我区例行的制剂质量年审中发现,个别医疗机构未严格按照工艺生产制剂,导致个别制剂性状不合格。如薄荷水为薄荷油的饱和水溶液,处方中的滑石粉作为分散剂,有加速溶解和助滤作用,工艺要求滑石粉不宜过细,否则不易被滤除,影响澄明度。
3.5 鉴别不合格 有3批,其中一个不合格的原因是检验方法有缺陷。如复方薄荷脑滴鼻液,有报道[4]其检测方法存在问题。该制剂鉴别项下“樟脑”釆用UV法鉴别,以液体石蜡为参比溶液在289 nm波长处有最大吸收,但不同质量的液体石蜡对樟脑的最大吸收波长有不同的影响,测定时必须用与所配制剂使用的同厂家同批号的液体石蜡做参比,否则易导致检验结果出现差异。
4 对策
4.1 加强制剂质量管理,提高制剂质量 针对抽验制剂中微生物限度、装量、含量测定等主要项目不合格率仍然偏高的问题,要加大专项检查力度,积极查找原因,追根溯源,必要时进行质量跟踪和安全性评价。同时,要严格制剂审批制度,对抽验不合格的制剂经过评价后,仍不合格者吊销制剂文号。加强药品生产监管制度建设;严格控制配制分装间的环境卫生,加强操作人员的卫生管理;为确保制剂质量,建议对微生物限度检查进行方法学验证,坚持制剂室年审制度,加大监督管理。
4.2 提高制剂包装容器质量 溶液剂多釆用塑料瓶包装,封装不严,受温度、湿度影响大,应改善包装容器。只有包装容器密封不漏气,制剂的装量、含量、性状等出现问题的几率才会减少;包装容器的卫生质量提高了,微生物限度出现不合格的几率也会减少。因此建议:①使用符合要求的包装材料;②对瓶口进行二次密封;③对瓶口进行压膜封口处理或釆用玻璃瓶密封包装;④用软管或铝箔封口。
4.3 优化制剂处方和工艺,提高和统一制剂质量标准 对一些易出现质量问题的品种,若临床必需保留,应对其制剂处方和工艺进行优化,重新报批。建议向《中国药典》靠拢,药典上已收载的制剂品种,《中国人民解放军医疗机构制剂规范》不再收载。
4.4 加强药检队伍建设 为确保药品制剂质量,
应改善药品检验实验室条件,配备符合要求的检验设备;同时要加强药检基层人员的专业技术培训,促进药检人员不断更新知识层次,提升药品检验能力,提高医疗机构制剂质量。
4.5 切实执行医疗机构制剂配制质量管理规范
监督部门应严格实施军队医疗机构制剂管理办法,加大制剂抽验的力度,扩大抽验覆盖面和抽验品种范围,增加抽验频次。抽验时加强制剂现场的监督检查,严格按照质量管理要求开展检验工作,保证药品制剂检验结果的准确可靠与公正;对抽验不合格制剂配制单位加大检查力度。通过有效地监督管理,进一步提高医疗机构制剂水平,保证人民群众和官兵用药安全有效。
[1]中国药典2010版.二部[S].2010:1070.
[2]中国人民解放军医疗机构制剂规范2002年版[S].2002:121.
[3]中国人民解放军医疗机构制剂规范2002年版增补本[S].2005:35.
[4]古卓良,傅小英.南京战区医疗机构制剂质量分析与对策[J].解放军药学学报,2008,24(2):187.

