低氧训练对大鼠心、肝、肾、海马组织细胞凋亡的影响及其机制研究
林喜秀瞿树林周桔张沙骆刘文锋刘铭
1湖南师范大学医学院生理教研室(长沙410013) 2中南大学基础医学院
低氧训练研究始于血液成分[1]。之后,关于心脏功能[2]、肺通气量[3]等的研究表明:低氧训练利用低氧刺激保护机体,提高机体转运氧的能力。不同氧浓度(海拔高度)、低氧刺激时间、刺激方式等对机体细胞凋亡的影响各异。耐力训练可提高机体抗疲劳和恢复能力[4],抑制细胞凋亡[5];急性、大强度运动[6,7]及力竭运动可引起缺血再灌注损伤,细胞凋亡增加[8]。
低氧训练时,机体既承受运动负荷,同时处于低氧环境。那么,心、肝、肾、脑组织如何适应这种变化?各组织的细胞凋亡与不同低氧训练刺激时间的关系怎样?低氧训练后力竭运动对机体不同器官细胞凋亡及机制的研究报道较少。鉴于此,本实验通过观察低氧训练后力竭运动大鼠心、肝、肾、海马组织细胞凋亡及HIF-1α、Bcl-2和Bax表达情况,探讨运动与低氧适应的机理。
1 材料与方法
1.1 分组及实验方案
70只2~3月龄SD大鼠购于湖南农业大学实验动物学部,按体重分层,随机分为7组,每组10只,即正常对照组(A)、高住 8 h 组(B)、高住 12 h 组(C)、常氧运动组(D)、8 h 高住低练组(E)、12 h 高住低练组(F)和一次力竭运动组(G)。 D、E、F 组大鼠每天在坡度为0的动物跑台上以25 m/min的速度训练1 h。每天训练结束后,将B、E组和C、F组依次放入氧浓度为12.5%(相当于海拔4000 m)的低氧舱内8 h和12 h。实验周期为4周,5 d/周。最后一次训练,B、C、D、E、F、G 组均以 25 m/min 的速度跑至力竭。训练中,有时采用声、光或毛刷等刺激,偶尔用电刺激,使大鼠持续运动,保证运动强度一致。力竭标准参考文献[9]。实验过程中,动物饲养环境温度为25±3℃,自然光照,所有动物均自由饮食。动物及饲料由湖南农业大学实验动物学部提供。
1.2 取材
各组动物均于最后一次训练后24 h,采用军事医学科学院生产的速眠新II(0.8~1.2 ml/kg)腹腔注射麻醉后心脏取血处死,仰卧位固定于手术台上。剪开腹壁,小心切取切取心尖组织、肝左侧叶、肾皮髓质交界处、海马CA1区组织。
1.3 实验仪器
美国Hypoxico公司制造的低氧分压系统,美国TOXIBLAEPGM-36型氧气监测仪,日本奥林巴斯株式会社OLYMPUS BX52显微照相图像采集系统,美国AO公司AG325R型切片机。
1.4 测试指标和方法
1.4.1 HE染色
将心、肝、肾、海马组织标本置于4%多聚甲醛磷酸缓冲液(0.1M,pH 7.4)中固定约24 h后,常规石蜡包埋,切片,厚5 μm。再按常规脱蜡、染色、封片。
1.4.2 HIF-1α、Bcl-2及Bax免疫组化染色
HIF-1α、Bcl-2和Bax蛋白免疫组织化学检测试剂盒由北京中杉金桥生物工程有限公司提供,Santa Cruz Biotechnology LNC公司产品。心、肝、肾、海马组织石蜡切片放于二甲苯5 min×2次;置于100%、95%、85%乙醇中各2 min复水;自来水冲洗;3%H2O2室温孵育10 min;蒸馏水冲洗;PBS浸泡5 min;将切片浸入柠檬酸酸盐抗原修复液(pH 6.0)后放入微波炉中加热15 min,间断2 min后,再加热5 min;室温冷却后经PBS冲洗,5 min×3次;正常山羊血清封闭,室温孵育10 min,倾去;滴加一抗(Bcl-2和Bax均为1?50);4℃湿盒过夜;次日取出恢复至室温后,PBS冲洗5 min×3次;滴加二抗工作液,37℃孵育 30 min;PBS冲洗 5 min×3次;DAB 显色 5 min;自来水冲洗;苏木素复染4 min;自来水冲洗;1%盐酸酒精分色:自来水冲洗;烤片;封片。HIF-1α蛋白是一种核蛋白,因而在显微镜下观察发现:棕色或棕褐色颗粒主要显现在组织细胞核上。Bcl-2、Bax蛋白的表达产物呈棕黄色颗粒状,位于胞浆,偶见胞膜(或)核膜,细胞核被苏木素复染成蓝色。在光学显微镜(×400)下每张切片随机观察6个视野(向同一方向移动切片,不重复,不重叠),以Simple PCI图像分析软件测试阳性产物的表达。采用一定面积中光密度值与阳性面积值的乘积作为阳性指数(positive index,PI),即阳性指数=阳性强度光密度值×阳性反应面积/测量面积[10]。
1.4.3 细胞凋亡检测
末端脱氧核苷酸转移酶介导的dUTP缺口末端标记法 (terminal deoxynucleotydyl transferase-mediated dUTP nick end labeling,TUNEL)检测细胞凋亡。心、肝、肾、海马组织石蜡切片常规脱蜡水化;抗原修复;内源性过氧化物酶的阻断;标记;信号转化和分析;显色;复染;梯度酒精脱水、二甲苯透明、中性树胶封片、镜检。普通光学显微镜观察,阳性凋亡细胞表现为细胞核呈棕色或棕褐色着染,部分胞浆也可因胞核DNA碎片溢出而呈阳性着染;正常非凋亡细胞和阴性对照细胞核被苏木素复染成蓝色,核相对较大,形态大小一致。
用Motic B5显微摄像系统和MIAS医学图像分析系统摄像计数。光学显微镜(×400)下每张切片随机观察6个视野,每个视野至少500个细胞水平,以Simple PCI显微图像分析软件计算每100个观察细胞中的平均阳性凋亡细胞数,即凋亡指数(Apoptosis Index,AI)。
1.5 统计学分析
2 结果
2.1 运动至力竭时间
表1显示,两高住组、常氧运动组、8 h高住低练组的运动时间比12 h高住低练组及一次力竭运动组明显延长,有统计学意义(P<0.05)。
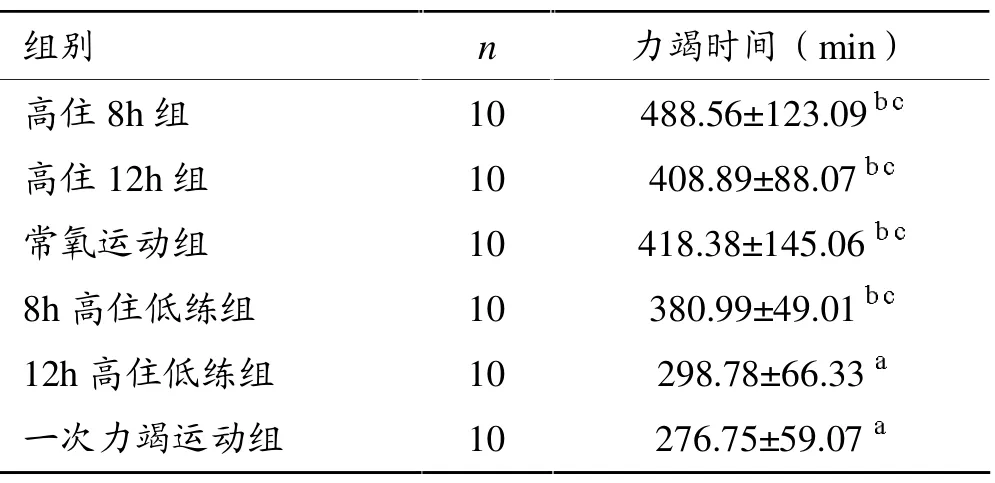
表1 各组大鼠运动至力竭时间比较
2.2 大鼠心、肝、肾、海马组织HE染色结果
正常对照组和高住8 h组大鼠心、肝、肾组织细胞结构完整。高住12 h组、常氧运动组和8 h高住低练组心尖、肝、肾小球、肾小管上皮细胞结构未见明显改变,组织细胞形态无异常改变。一次力竭运动组和12 h高住低练组心、肝细胞明显肿胀,间隙明显增大,细胞核染色质固缩,集聚于核膜周边,细胞体变小;肾小管上皮细胞水肿样变性,以近曲小管为重,肾小管管腔扩张,管内可见管形和脱落细胞;上皮细胞核染色质集聚周边,胞浆空泡样变性(见图1所示)。常氧运动组和一次力竭运动组海马CA1区组织改变最明显,排列散乱,层次不完整,稀疏分布不均匀。

2.3 大鼠心、肝、肾、海马TUNEL结果
图2显示:随低氧时间延长,心组织凋亡细胞逐渐增多。高住8 h组偶见阳染颗粒,高住12 h组阳染颗粒有所增加,12 h高住低练组出现较多散在的阳染颗粒;8 h高住低练组海马区可见较多阳性凋亡细胞,随低氧时间延长,海马组织凋亡细胞减少。
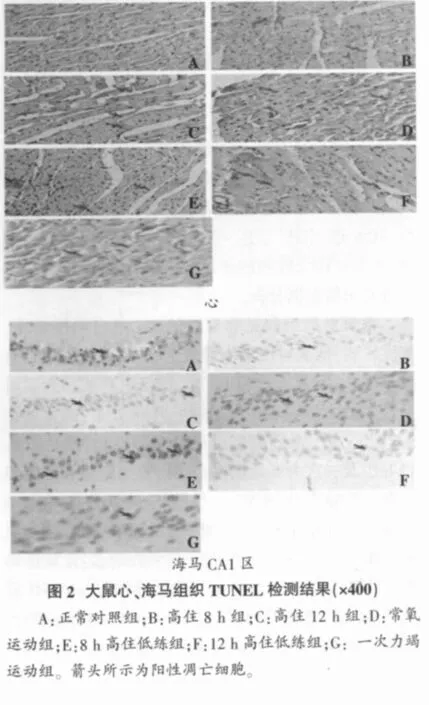

表2 各组大鼠心、肝、肾、海马组织细胞凋亡指数(AI)比较(%)
表2显示:与正常对照组相比,高住12 h组、常氧运动组、8 h高住低练组和一次力竭运动组心、肝、肾凋亡指数均显著增加(P<0.05),而 8 h、12 h高住低练组海马组织与正常对照组相比升高但无显著性差异。12小时高住低练组海马凋亡指数与常氧运动组比较显著增加(P<0.05);与一次力竭运动相比,高住组、常氧运动组、8 h高住低练组海马区凋亡指数均明显降低(P<0.05)。12小时高住低练组心、肝、肾凋亡指数较8小时高住组显著增加(P<0.05)。
2.4 大鼠心、肝、肾、海马Bax、Bcl-2及HIF-1α 免疫组化染色图像观察结果
2.4.1 Bax
Bax蛋白主要表达于细胞浆,也可见细胞膜和细胞浆同时着色,呈淡棕黄色或棕色,呈镞状分布和(或)片状分布。在显微镜下观察,将切片内阳性细胞率<10%定为阴性显色,丢弃,不进行照像和分析处理;将切片内阳性细胞率≥10%定为阳性显色,进行照像并采集数据分析。
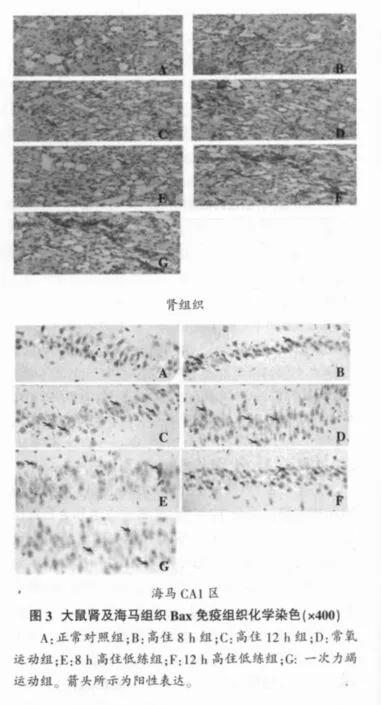
常氧对照组偶见非常浅的Bax蛋白阳性物质,灰度较弱;低氧对照组阳性表达增多,细胞膜上也有少量表达;常氧运动组心、肝、肾组织胞浆和胞膜可见较多Bax蛋白表达,呈镞状、片状分布;高住低练8 h组心、肝、肾细胞浆可见较多阳性物;高住低练12 h组及一次力竭运动组心、肝、肾细胞浆和细胞膜均有阳性物质,面积较大,呈镞状、片状分布(见图3肾组织);而正常对照组、低氧8 h组和低氧12 h组海马组织CA1区Bax阳性细胞个数增多;常氧运动组、一次力竭运动组可见大量阳性细胞,8h高住低练组和12h高住低练组海马组织CA1区Bax阳性细胞个数逐渐减少(见图3海马CA1区)。
由表3可知,与正常对照组相比,高住12 h组、常氧运动组、8 h和12 h高住低练组和一次力竭运动组心、肝、肾组织Bax蛋白表达阳性指数均显著增加(P<0.05),而8 h和12 h高住低练组海马区与正常对照组相比增高但无显著性差异。12 h高住低练组心、肝、肾组织Bax蛋白表达与常氧运动组比较显著增加(P<0.05);与一次力竭运动组相比,高住8 h组、高住12 h组、常氧运动组和8 h高住低练组海马区Bax蛋白表达阳性指数均显著降低 (P<0.05)。12 h高住低练组心、肝、肾Bax蛋白表达阳性指数比8 h高住组显著增加(P<0.05),海马区则无显著性差异。
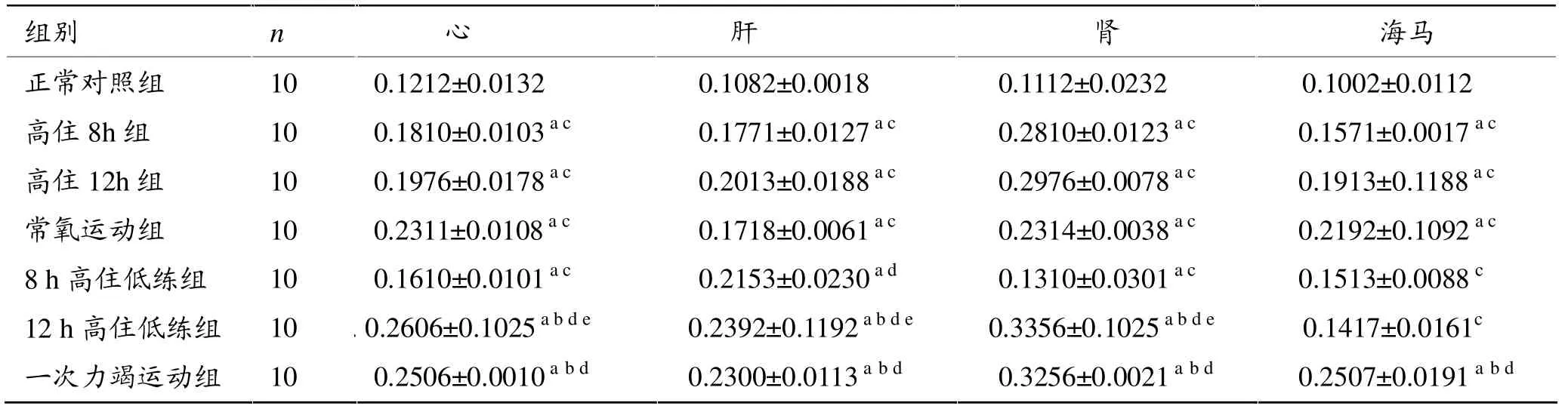
表3 各组大鼠心、肝、肾、海马组织Bax蛋白表达阳性指数(PI)比较
2.4.2 Bcl-2
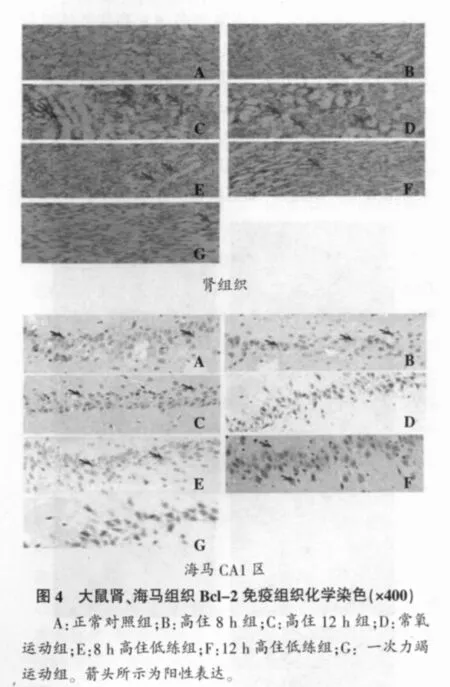
Bcl-2蛋白阳性信号主要表达于细胞浆和细胞膜,为棕黄色,略呈颗粒状。对照组、低氧8 h组和低氧12 h组心、肝、肾组织Bcl-2阳性细胞个数逐渐增多;常氧运动组、8h高住低练组和12h高住低练组心、肝、肾Bcl-2阳性细胞个数逐渐减少(见图4肾组织)。正常对照组、高住8h组和高住12h组海马组织CA1区Bcl-2阳性细胞个数逐渐减少,训练对照组、8h高住低练组和12h高住低练组海马组织CA1区Bcl-2阳性细胞个数逐渐增多 (见图4海马CA1区)。
表4显示。与正常对照组相比,8 h和12 h高住组、常氧运动组、8 h和12 h高住低练组和一次力竭运动组心、肝、肾Bcl-2蛋白表达阳性指数均显著增加(P<0.05),而8 h和12 h高住组、常氧运动组、一次力竭运动组海马组织Bcl-2蛋白表达阳性指数显著下降 (P<0.05);与一次力竭运动组相比,8 h和12 h高住组、常氧运动组、8h高住低练组心、肝、肾、海马Bcl-2蛋白表达阳性指数均显著增加 (P<0.05);12 h高住低练组海马Bcl-2蛋白表达阳性指数较8小时高住组显著增加(P<0.05)。
2.4.3 HIF-1α
常氧运动组心、肝、肾组织可见HIF-1α免疫阳性物质表达;8 h高住低练组阳性物质较多,主要表达于胞浆中,部分在胞核中;12 h高住低练组和一次力竭运动组心、肝、肾组织可见大量HIF-1α免疫阳性物质,主要表达于胞浆中,部分在胞核中。正常对照组、低氧8 h组和低氧12 h组海马组织CA1区HIF-1α阳性细胞个数逐渐增多,8 h高住低练组和12 h高住低练组海马组织HIF-1α阳性细胞个数逐渐减少。图5显示:心肌组织对照组偶见较弱的HIF-1α免疫阳性表达;高住8 h组阳性物质主要表达于胞浆中,部分在胞核中,并分布于心肌纤维、肝窦静脉及肾小管周围;高住12 h组阳性物质较强表达,主要位于细胞核,细胞质也少量表达。
表4 各组大鼠心、肝、肾、海马组织Bcl-2蛋白表达阳性指数(PI)比较
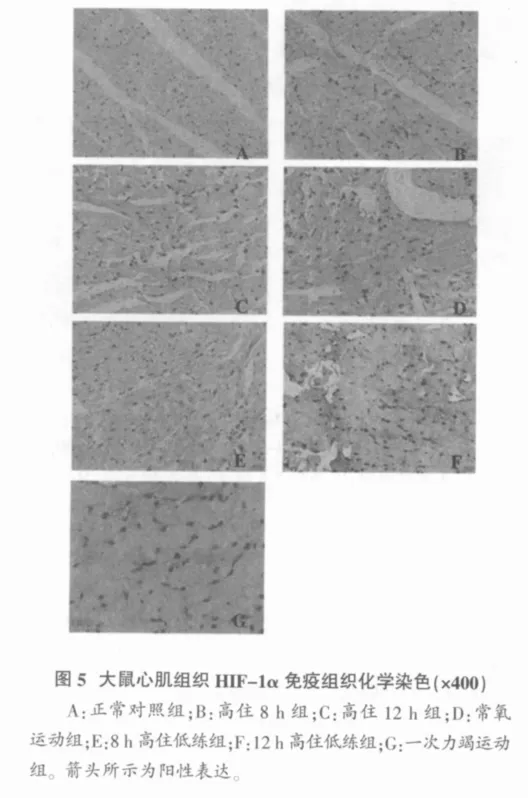
表5显示,与正常对照组相比,高住12 h组、常氧运动组、高住低练组和一次力竭运动组心、肝、肾组织HIF-1α蛋白表达阳性指数均显著增加 (P<0.05),而高住低练组海马区有所增高但无显著性差异。与常氧运动组比较,12 h高住低练组心、肝、肾组织HIF-1α蛋白表达阳性指数显著增加(P<0.05),海马组织区与之相反;与一次力竭运动组相比,高住组、常氧运动组和8 h高住低练组心、肝、肾组织HIF-1α蛋白表达阳性指数均明显降低 (P<0.05);12 h高住低练组心、肝、肾Bax蛋白表达阳性指数比8 h高住组显著增加(P<0.05),海马组织与之相反。
3 讨论
3.1 高住低练后力竭运动对大鼠心、肝、肾、海马细胞凋亡的影响
细胞异常凋亡在急、慢性器官损害的发病机制中起着重要作用[11]。低氧、运动及低氧运动与细胞凋亡存在某种直接或者间接的联系[12,13]。 研究表明,低氧对不同组织细胞凋亡影响不同。缺氧可以诱导交感神经细胞凋亡[14],对肾小管上皮细胞具有直接的致细胞凋亡作用[15];而抑制肺血管周细胞凋亡并诱导抑凋亡基因Bcl-2过度表达[16];胸腺细胞在低氧状态下自发性凋亡减少[17];Tanaka 等[18]研究培 养的新生鼠心肌细胞,发现细胞凋亡在低氧12小时即可出现,并随低氧时间延长逐渐加重;Kohli等[19]建立大鼠常温肝脏缺血再灌注模型后,发现肝缺血再灌注损伤的肝细胞和肝窦状上皮细胞的死亡方式主要以细胞凋亡方式存在,而非传统的细胞坏死。本实验结果显示:与正常对照组相比,12 h高住组细胞凋亡指数显著升高,8 h高住组细胞凋亡指数升高,但无显著性差异;与一次力竭运动组比,8 h、12 h高住组细胞凋亡指数显著降低。HE染色结果表明,8 h高住组心、肝、肾、海马各组织细胞结构完整,组织上皮细胞未见特殊改变,12 h高住组各组织细胞未出现明显结构改变,而一次力竭运动组各组织出现明显病理损伤。这表明4000 m低氧暴露4周后,机体产生了抗损伤力,使低氧暴露后力竭运动对机体的损伤明显小于单纯一次力竭运动。缺氧引起的机能变化有损伤一面,也有抗损伤一面,关键在缺氧发生的速度、程度、持续时间等。模拟海拔4000 m低氧4周后,高住8 h和12 h组心、肝、肾小管、海马无明显损伤,可能是氧分压适宜,或每次低氧持续时间、4周低氧适应时间恰当。这说明4000 m低氧暴露8 h或12 h作为应激源作用强度较缓和,作用时间恰当,能提高机体机能和运动能力。

表5 各组大鼠心、肝、肾、海马组织HIF-1α蛋白表达阳性指数(PI)比较
适宜运动提高机体运动能力,未见凋亡明显发生[20]。急性运动诱导骨骼肌细胞、心肌细胞、肝细胞凋亡,且凋亡细胞数目随着运动速度增加而增加,过度疲劳时细胞出现坏死,力竭训练可导致骨骼肌细胞、心肌细胞[21]、海马[22]、肾[23]凋亡率显著升高。 本实验结果显示:常氧运动组可见较多的凋亡细胞核,其凋亡指数显著低于一次力竭运动组;HE染色结果中,常氧运动组心、肝、肾、海马各组织上皮细胞未见明显病理改变,而一次力竭运动组各组织出现明显损伤。力竭运动时,血液重新分配,大量供给骨骼肌,心、肝、肾及脑组织不可避免缺血缺氧,运动停止后,血液再次重新分配,心、肝、肾及脑组织经历类似缺血再灌注的过程。Cosulich研究[24]表明,这种血流恢复反而引起细胞的进行性破坏,即再灌注损伤,导致缺血组织损伤。再灌注损伤由多种原因引起,启动自由基连锁反应,氧自由基可通过引起细胞脂质过氧化、损伤DNA分子或者调节细胞凋亡相关基因而诱导细胞凋亡。本实验中,中等强度耐力运动后力竭运动,机体有一个长时间的适应过程,力竭运动后缺血再灌注程度相对较轻,凋亡机制的启动可能受到限制,说明中等强度耐力运动对机体有保护作用。
低氧暴露与运动双重刺激对心、肝、肾、海马细胞凋亡的影响如何?本实验中,镜下凋亡细胞呈深棕色阳性,核中有细微颗粒状,部分胞浆也因细胞核DNA碎片溢出而呈阳性着色,而正常细胞胞核呈蓝色。正常对照组心、肝、肾组织偶见阳性细胞核;高住低练组阳性细胞核较多,特别是12 h高住低练组及一次力竭运动组,呈强阳性;一次力竭运动组、常氧运动组、8h高住低练组和12 h高住低练组海马组织CA1区深棕色阳性细胞核随低氧持续时间延长而表达减少。与正常对照组相比,8 h、12 h高住低练组心、肝、肾细胞凋亡指数显著升高,12 h高住低练组比8 h、12 h高住组和常氧运动组均显著升高。12 h高住低练组HE染色可见明显病理损伤,力竭运动时间明显减少。12 h高住低练组细胞凋亡指数明显高于8h高住低练组,说明4000 m低氧暴露12 h后再进行运动训练,负荷性缺氧与低氧性缺氧两者对心、肝、肾有协同效应。运动(负荷性低氧或运动性缺氧)和低氧暴露(缺氧性低氧或低氧性缺氧)后运动,心、肝、肾可能出现暂时缺血[25,26],强度降低后血液重新回流,导致再灌注损伤。 Mattson[27]观察到,短暂脑缺血后,几分钟至几小时内海马区神经元看似正常,但48~72 h后大多死亡,提示短暂脑缺血时,神经元凋亡主要发生于缺血敏感区,如海马、纹状体等。本研究中,常氧运动组海马区可见细胞凋亡,但与一次性力竭运动相比明显降低,说明中等强度耐力训练提高机体抗细胞凋亡能力,有保护机体的作用,8 h和12 h高住低练组凋亡细胞指数随低氧持续时间延长有减少趋势,推测是大脑对低氧刺激的适应性改变。在低氧训练中,大脑携氧能力较单纯运动组高。这说明4周高住低练后力竭运动,使停止运动后缺氧再灌注的变化幅度比单纯一次力竭运动组小得多,海马组织损害也减小,表现为8 h和12 h低氧训练组细胞凋亡指数较常氧运动组均降低,且随低氧适应时间的延长有减小的趋势。
高住低练后力竭运动诱导细胞凋亡的可能机制有:①一方面细胞内游离钙超载激活钙离子依赖性的核酸内切酶,使双链DNA在核小体Linker部位裂解,形成DNA片段;另一方面钙超载可激活蛋白酶C,令其转移至细胞膜表面,使G蛋白磷酶化,胞内cAMP 增加,导致细胞凋亡[28];②Bcl-2 和 Bax 与细胞凋亡有密切关系。Bcl-2水平高于Bax时,形成Bcl-2和Bcl-2同源二聚体,细胞凋亡受抑制;Bax表达高于Bcl-2时,则形成Bax和Bax同源二聚体,细胞凋亡增强。并且,Bcl-2和Bax定位于线粒体膜上,这为其调控细胞凋亡提供了条件;③低氧诱导因子-1(HIF-1)作为低氧条件下机体的调节因子,可能在体内发挥多向性调节作用。其除了发挥抗细胞凋亡方面的作用,它还介导缺氧诱导的细胞凋亡;④P53是介导HIF-1发挥促凋亡作用的重要分子。免疫共沉淀等方法证明,HIF-1直接与P53蛋白结合,增加P53稳定性,促进P53发挥促细胞凋亡的作用[29];⑤机体不同组织本身具有的特点可能与低氧运动导致其细胞凋亡有一定关系。本研究发现,12 h高住低练对大脑海马组织无明显影响,海马组织对低氧刺激反应相对稳定,而心、肝、肾对低氧刺激反应较大,出现明显病理改变。
3.2 高住低练大鼠心、肝、肾、海马细胞凋亡与HIF-1α及Bax/Bcl-2关系
3.2.1 高住低练对大鼠心、肝、肾、海马组织HIF-1α表达的影响
低氧诱导因子可调节血管生成、细胞增殖、细胞凋亡、转录调节[30]等诱导靶基因表达的许多生物学效应。同时,它有双重效应,轻度低氧时,促进其目的基因如促红细胞生成素、血管内皮生长因子生成,促进低氧组织细胞存活,具有抗凋亡的功能;严重低氧且持续时间长时,调节凋亡相关因子如Bax、Bad等,激活Caspases,促进低氧诱导的凋亡,即HIF-1的激活影响细胞增殖和凋亡[31]。本实验结果显示:8 h和12 h高住组、常氧运动、高住低练后力竭运动或者一次力竭运动,都能促进心、肝、肾HIF-1a蛋白表达显著增加;与单纯低氧暴露组相比,高住低练组HIF-1α蛋白表达高些;与常氧运动组比较,高住低练组表达更显著,且12 h高住低练组心、肝、肾组织表达最高;与一次力竭运动相比,8 h和12 h高住组、常氧运动组、8 h高住低练组HIF-1α蛋白表达均明显降低。而海马HIF-1α表达与之相反,高住12 h组HIF-1α表达最高,高住低练组表达显著增加,与一次力竭运动无显著差异,高住低练组及一次力竭运动组表达高于单纯低氧暴露组和常氧运动组。这表明HIF-1α对外界形成的低氧产生适应性反应,细胞通过多个通路感受低氧,调控HIF-1α表达,稳定其活性,可为减轻低氧对器官造成的损伤提供物质基础。
3.2.2 高住低练对大鼠心、肝、肾、海马细胞凋亡调控基因Bax、Bcl-2的影响
Bcl-2、Bax基因主要在凋亡执行阶段发挥作用,Bcl-2/Bax蛋白比值决定细胞是存活还是凋亡,Bcl-2/Bax比值高,细胞存活率高,反之,细胞凋亡率高[32]。 Campbell等[33]研究表明,12 周训练促进 Bax 蛋白表达,抑制Bcl-2蛋白表达,Bcl-2表达下降,从而导致细胞凋亡[34]。本实验结果显示:与正常对照组相比,低氧暴露、常氧运动、高住低练及一次力竭运动,均促进心、肝、肾Bcl-2和Bax蛋白表达显著增加;单纯低氧暴露下,Bcl-2和Bax蛋白表达显著高于正常对照组,随低氧暴露时间延长,Bcl-2无显著增加,8h低氧暴露组Bax蛋白表达稍低于12 h组;常氧运动促进Bcl-2和Bax蛋白表达显著增加;高住低练促进Bcl-2蛋白表达,随着低氧暴露时间延长,增加不明显,但仍显著高于正常对照组;高住低练组Bax蛋白含量比低氧暴露组显著增加,与常氧运动组相比也显著增加,随低氧暴露时间延长呈增长趋势。海马组织与之相反;与一次力竭运动组比,8 h和12 h高住组、常氧运动组、8 h高住低练组Bax蛋白表达值均明显降低,Bcl-2蛋白表达明显增加。Bcl-2蛋白过表达并不增加细胞数而是保护细胞、延长细胞寿命。本实验中,Bax蛋白表达明显上升,Bax/Bcl-2比值增加,消除Bcl-2对细胞的保护作用,导致细胞凋亡,引起机体损伤。大鼠力竭时间却显著延长,与Bcl-2蛋白表达增加一致,反映耐力训练、低氧暴露、高住低练提高机体运动能力,Bcl-2/Bax比值增加,保护机体免受损伤。
3.2.3 高住低练心、肝、肾、海马细胞凋亡与HIF-1α及凋亡相关因子之间的关系
Helton[35]和 Rosenberger[36]研 究 表明 ,HIF-1 在大鼠肾缺血再灌注病理损伤中发挥重要作用。HIF-1α的激活使其蛋白表达增加,调节Bcl-2、Bax、P53基因表达,从而调节细胞凋亡。本实验结果表明,HIF-1α在低氧暴露、常氧运动、低氧训练作用或一次力竭运动中上调Bax,提高Bax/Bcl-2,协同Bcl-2家族凋亡相关蛋白表达,在低氧导致心、肝、肾、海马细胞凋亡中发挥促细胞凋亡的作用。12 h高住低练组及一次力竭运动组最明显,表现出HIF-1α在低氧环境中的病理效应。而高住8 h组、高住12 h组、常氧运动组HIF-lα表达协同Bcl-2家族凋亡相关蛋白表达,发挥抑制细胞凋亡作用,表现出HIF-1α在低氧环境中的生理效应,提示HIF-1α有双重效应。但HIF-1α双重效应的调节机制仍有待于研究。
4 总结
中等强度耐力运动、4000 m低氧暴露8 h或12 h、8 h高住低练提高大鼠有氧代谢能力。低氧、耐力运动、高住低练、一次力竭运动可诱导大鼠心、肝、肾、海马组织HIF-1a、Bcl-2及Bax蛋白表达;细胞凋亡率与凋亡指数及病理损伤与运动强度、低氧刺激有关,12 h高住低练及一次力竭运动对运动能力的影响最明显。Bcl-2与Bax参与调控心、肝、肾、海马组织细胞凋亡,HIF-1a表达可能协同Bcl-2家族凋亡相关因子的表达,在低氧训练导致的组织细胞凋亡中发挥双重效应。低氧刺激对不同器官影响不一,对大脑海马组织影响较小,而对心、肝、肾影响较大,表现生理性适应及病理损伤。
[1]Grassi B,Ferretti G,Kayser B,et al.Maximal rate of blood lactate accumulation during exercise at altitude in humans.J Appl Physiol,1995,79(1):331-339.
[2]黄丽英,林文弢,翁锡全.常压模拟高住低练对大鼠心肌低氧诱导因子1α基因表达的影响.中国运动医学杂志,2004,23(2):133-135.
[3]Levine BD,Friedman DB,Engfred K,et al.The effect of normoxic or hypobaric hypoxic endurance training on the hypoxic ventilatory response.Med Sci Sports Exerc,1992,24(7):769-775.
[4]张全江,李秋霞,熊正英,等.小鼠耐力训练后再力竭运动对体内某些生化指标的影响.中国应用生理学杂志,2003,19(4):363-366.
[5]袁海平,陈佩杰,史仍飞,等.运动性蛋白尿与肾细胞凋亡及氧自由基代谢的关系.中国运动医学杂志,2003,22(3):254-257.
[6]Stray-gundersen J,Chapmam RF,Levine BD. “Living HIgh-training Low”Altitude Training Improves Sea Level Performance in Male and Female Elite Runners.Appl Physiol,2001,91(3):1113-1120.
[7]Solaroglu I,Solaroglu A,Kaptanoglu E,et al.Erythropoietin prevents ischemia-reperfusion from inducing oxidative damage in fetal rat brain.Child Nerv Syst,2003,19(1):19-22.
[8]Podhorska-Okolow M,Dziegiel P,Murawska-Cialowicz E,et al.Effects of adaptive exercise on apoptosisin cells of rat renal tubuli.Eur J Appl Physiol,2007,99(3):217-226.
[9]李善妮.急性力竭运动对大鼠肝细胞损伤及凋亡的影响.湖南师范大学硕士学位论文,2005.19.
[10]郑澜.低氧运动促进肌组织血管生成的机制.上海体育学院博士学位论文,2007.46.
[11]Tushar P,Gregory JG.Apoptosis and hepatobiliary disease.Hepatology,1995,21(6):1725.
[12]杨海平.低氧、运动对骨骼肌细胞凋亡及bcl-2、bax表达的影响.中国运动医学杂志,2006,25(6):706-709.
[13]Yim JH,Kim YJ,Cho YE,et al.GLTSCR2 sensitizes cells to hypoxic injury without involvement of mitochondrial apoptotic cascades.Pathobiology,2007,74(5);301-308.
[14]Rosenbaum DM,Michaelson M,Batter DK,et al.Evidence for hypoxia-induced,programmed cell death of cultured neruond.Ann Neurol,1994,36:864-870.
[15]王伟铭,陈楠,董德长.Lazarold对低氧致肾小管上皮细胞凋亡的保护作用.肾脏病与透析肾移植杂志,2001,10(4):322-325.
[16]张燕,熊密,车东媛,等.低氧对培养的肺血管周细胞凋亡的影响.中国组织化学与细胞化学杂志,1999,8(3):328-331.
[17]Hale LP,Braun RD,Gwinn WM,et al.Hypoxia in the thymus:role of oxygen tension in thymocyte survival.Am J Physiol Heart Cire Physiol,2002,282:H1467-1477.
[18]Tanaka M,Ito H,Adachi S,et al,Hypoxia induces apoptosis with enhanced expression of Fas antigen messenger RNA in cultured neonatal rat cardiomyocytes.Circ Res,1994,75:426-433.
[19]Kohli V,Selzner M,Maden JF,et al.Endothellal cell and hepatocyte death occur by apoptosis after ischemia-reperfusion injury in the rat liver.Transplantation,1999,67(8):1099-1105.
[20]袁海平,陈佩杰,史仍飞,等.运动性蛋白尿与肾细胞凋亡及氧自由基代谢的关系.中国运动医学杂志,2003,22(3):254-257.
[21]Arslan S,Erdem S,Sivir A,et al.Exercise-induced apoptosis of rats skeletal muscle and the effect of meloxicam.Rheumatol Int,2003,21(4):133-136.
[22]Kidwell CS,Saver JL,Mattiello J,et al.Thrombolytic reversal of acute human cerebral ischemic injury shown by diffusion/perfusion magnetic resonance imaging.Ann Neurol,2000,47(4):462-469.
[23]Saikumar P,Venkatachalam MA.Role of apoptosis in hypoxic ischemic damage in the kidney.Semin Nephrol,2003,23(6):511-521.
[24]Cosulich SG,Worrall V,Hedge PT,et al.Regulation of apoptosis by BH3 domains in a cell-free system.Curr Biol,1997,7(12):913-920.
[25]Wei Q,Alam MM,Wang MH,et al.Bid activation in kidney cells following ATP depletion in vitro and ischemia in vivo.Am J Physiol Renal Physiol,2004,286(4):803-809.
[26]Danial NN,Korsmeyer SJ.Cell death:critical control points.Cell,2004,116(2):205-219.
[27]Mattson MP,CulmseeC,Yu ZF,et al.Apoptotic and antiapoptotic mechanism sin stroke.Cell Tissue Res,2000,301(1):173.
[28]Li Z,Bing OH,Long X,et al.Inereased cardiomyeyte apoptosis during the transition to heart Failure in the spontaneously hypertensive rat.Am J fhysiol,1997,272(5 Pt 2):H 2313-2319.
[29]Sj din B,Hellsten Westing Y,Apple FS.Biochemical mechanisms for oxygen free radical formation during exercise.Sports Med,1990,10(2):236-254.
[30]Moritz W,Meier F,Stroka DM,et al.Apoptosis in hypoxic human pancreatic islets correlates with HIF-1alpha expression.FASEB J,2002,16(7):745-747.
[31]Goda N,Ryan HE,Khadivi B,et al.Hypoxia-inducible factor 1 is essential for cell cycle arrest during hypoxia.Mol Cell Biol,2003,23(1):359-369.
[32]Zhu Y,Prehn J,Culmsee C,et al.The beta2-adrenoceptor agonist clenbuterol modulates Bcl-2,Bcl-x land Bax protein expression following transient for brain ischemia.Neurosci,1999,90(4):1255-1263.
[33]Campbell KI,McTiernan A,Li SS,et al.Effect of a 12-month exercise intervention on the apoptotic regulating proteins Bax and Bcl-2 in colon crypts:a randomized controlled trial.Cancer Epidemiol Biomarkers Prev,2007,16(9):1767-74.
[34]Brunelle JK,Santore MT,Budinger GR,et al.c-Myc sensitization to oxygen deprivation-induced cell death is dependent on BaxBak,but is independent of p53 and hypoxia-inducible factor-1.J Biol Chem,2004,279:4305-4312.
[35]Helton R,Cui J,Scheel Jr,et al.Brain-specific knock-out of hypoxia-inducible factor-1 alpha reduces rather than increases hypoxic-ischemic damage.J Neurosci,2005,25:4099-4107.
[36]Rosenberger C,Heyman SN,Rosen S,et al.Upregulation of HIF in experimental acute renal failure:evidence for a protective transcriptional response to hypoxia.Kidney Int,2005,67:531-542.

