一次性力竭运动对小鼠肝脏和骨骼肌内质网应激的影响
温悦萌 张天欧 谢岚 艾华 管又飞
1北京大学第三医院运动医学研究所营养生化研究室(北京100191)
2北京大学肥胖与代谢病研究中心 3北京大学医学部生理学与病理生理学系
内质网是哺乳动物细胞内一种重要的亚细胞器,主要参与蛋白质的初步合成、修饰与加工。内质网应激(endoplasmic reticulum stress,ERS)是指由于各种原因导致的细胞内质网功能发生紊乱、蛋白质合成过程受到影响的一种生理病理过程[1,2]。有研究报道,急性运动可提高组织内质网应激蛋白的表达[3-5],但急性运动引起内质网应激的原因尚不清楚[6]。急性运动可导致糖原大量消耗,糖原储备量和消耗量对急性运动引起的内质网应激有何影响不明确。本实验通过力竭游泳运动探讨内质网应激及其机制问题。
1 材料与方法
1.1 实验动物和分组
雄性C57BL/6小鼠16只,体重24.0~26.0 g,由北京大学医学部实验动物中心提供。小鼠在SPF级环境中单笼饲养,温度(22±1)℃,湿度 40%~60%,12 h明暗循环。小鼠自由摄食和饮水,均喂食普通饲料,由北京科澳协力公司提供。
适应性喂养3天。小鼠随机分为安静组(8只)和运动组(8只)。运动组小鼠采用一次性力竭游泳运动,无负重,水温(30±2)℃,水深 50 cm。判断力竭的标准为:小鼠沉入水中5 s不能自主浮上水面,且呼吸急促,对刺激反应迟缓,无逃避反应。安静组小鼠不运动。
1.2 标本采集和保存
力竭游泳后4 h,用3%戊巴比妥钠腹腔注射麻醉小鼠,腹主动脉取血,迅速转入EDTA抗凝的离心管中,混匀后室温离心(3000 r/min,20 min)分离血浆,分装后液氮中速冻,转入-80℃冰箱保存。迅速取出肝脏和股四头肌组织,PBS冲洗干净,用铝箔纸包好,投入液氮中速冻,后转入-80℃冰箱保存。速取肝左叶组织,投入4%福尔马林固定液中固定4~8小时,后常规石蜡包埋。安静组小鼠标本采集时间和方法同运动组。
1.3 测试指标和方法
分别取肝脏和股四头肌组织100 mg加入1 ml RIPA裂解液,制备组织匀浆液。采用western blot方法检测内质网应激标志性蛋白表达,葡萄糖调节蛋白 78(glucose-regulated protein 78,GRP78)、肌醇需酶 1(inositol requiring enzyme 1,IRE1)、磷酸化肌醇需酶1(p-IRE1)一抗由Abcam公司提供;双链RNA依赖的蛋白激酶样内质网类激酶 (double-stranded RNA-dependent protein kinase (PKR)-like ER kinase,PERK)和磷酸化 PERK(p-PERK)一抗由 Santa Cruz公司提供;内参蛋白质3-磷酸甘油醛脱氢酶(glyceraldehyde 3-phosphate dehydrogenase,GAPDH)一抗由Bioworld公司提供。荧光二抗由中杉金桥公司提供。利用Odyssey红外荧光扫描系统采集图像并进行灰度分析。
分别取肝脏和股四头肌组织50 mg加入1 ml Trizol提取RNA,Trizol试剂购自Invitrogen公司。采用实时定量RT-PCR方法检测GRP78、剪切型的X盒结合蛋白 1(X box binding protein 1 splicing,XBP1s)、C/EBP 同源蛋白 (C/EBP homologous protein,CHOP)、生长停滞和诱导 DNA损伤基因 34(growth arrest and DNA damage-inducible gene 34,GADD34)的 mRNA 表达水平,β-肌动蛋白(β-actin)mRNA作为内参。cDNA第一链合成试剂盒和荧光染料 SuperReal PreMix(SYBR Green) 购自 TIAN GEN BIOTECH公司。各引物序列见表1。
实时定量RT-PCR测试主要过程:预变性95℃30 s,PCR 反应 95℃ 10 s,60℃ 30 s,40 个循环。检测CT值。
采用日立7170A全自动分析仪以葡萄糖氧化酶法测定血糖。采用已糖激酶法测定肝糖原和肌糖原,分别取肝脏组织75 mg和股四头肌组织85 mg,按1:3加入碱液,沸水浴煮20 min制备糖原检测液。空白管调零,在620 nm波长处测定OD值。试剂盒购自KeyGEN公司。

表1 实时定量RT-PCR方法测定内质网应激各标志蛋白质mRNA引物序列
肝脏和骨骼肌组织由Leica石蜡切片机切片,HE染色,用Nikon E600显微镜图像采集系统照相并观察。
1.4 统计学分析
统计分析使用SPSS 18.0软件完成。数据以平均数±标准差(Mean±SD)表示。安静组和运动组均值比较采用独立样本t检验。资料服从双变量正态分布时,选择Pearson方法对运动组进行相关分析,不服从时,选择Spearman方法。P<0.05为显著性水平,P<0.01为非常显著性水平。
2 结果
2.1 内质网应激标志蛋白表达水平
与安静组相比,运动组小鼠肝脏组织GRP78、p-PERK/PERK和p-IRE1/IRE1表达分别增加了49.39%、16.54%和21.11%,差别均有统计学意义(P<0.001)(图 1A); 股四头肌组织 GRP78、p-PERK/PERK和p-IRE1/IRE1表达分别增加了22.33%、15.26%和22.05%,差别均有统计学意义(P<0.001)(图 1B)。
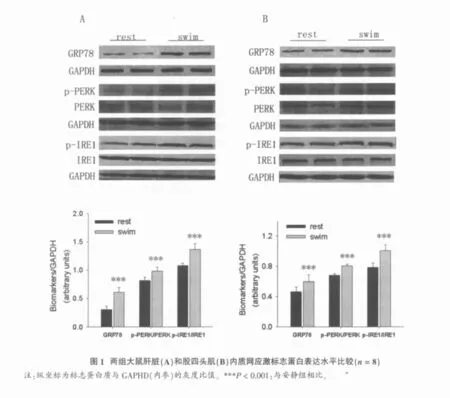
2.2 内质网应激标志蛋白mRNA表达水平
运 动 组 肝 脏 组 织 GRP78、XBP1s、CHOP 和GADD34 mRNA表达分别是安静组的1.93倍、1.84倍、1.76倍和2.04倍,差别均有统计学意义 (P<0.001)(图 2A); 运动组股四头肌组织 GRP78、XBP1s、CHOP和GADD34 mRNA表达分别是安静组的1.53倍、2.21倍、1.68倍和1.8倍,差别均有统计学意义(P<0.001)(图 2B)。
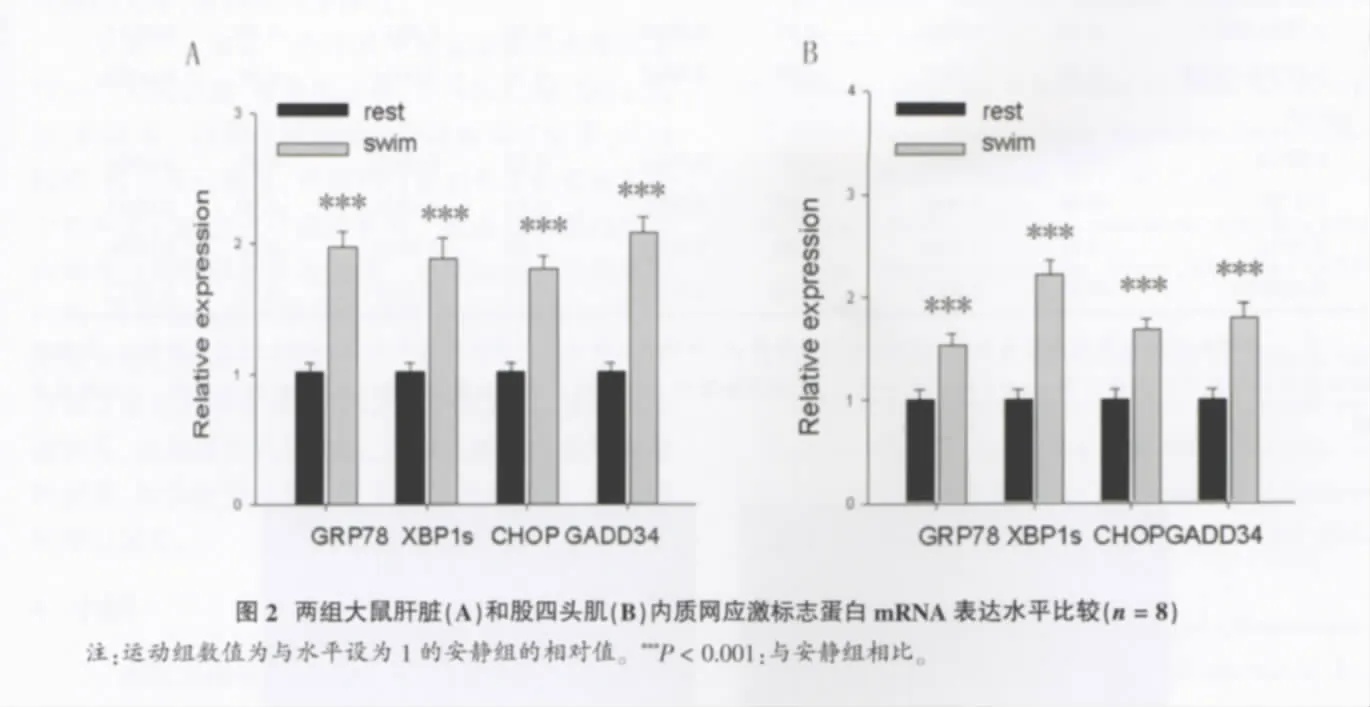
2.3 血糖和糖原水平
表2显示,与安静组相比,运动组一次性力竭游泳运动后4小时血糖水平下降16.78%,有显著性差异(P<0.05),肝糖原水平下降了14.24%,有极显著性差异(P<0.01),肌糖原水平减少了53.85%,有极显著性差异(P<0.001)。

表2 安静组和运动组血糖和糖原水平比较
2.4 内质网应激标志蛋白表达与血糖和糖原含量的相关分析
内质网应激标志蛋白及mRNA表达量均与血糖及糖原含量呈显著负相关(r值和P值见表3)。
2.5 组织形态学结果
HE染色结果显示,安静组(图3A)肝组织细胞结构完整;运动组(图3B)部分肝细胞轮廓改变,胞浆疏松水肿(如箭头所指)。运动组骨骼肌形态学与安静组未见明显差异(结果未给出)。
3 讨论
真核细胞中,内质网应激时的主要表现是未折叠或者错误折叠的蛋白质在内质网腔内蓄积,引发所谓的未折叠蛋白质反应 (unfolded protein response,UPR)[7]。GRP78 可与未折叠和错误折叠的蛋白质结合,其表达增多是内质网应激的主要标志[8]。迄今研究发现,URP主要通过PERK、IRE1以及活化转录因子 6(activating transcription factor 6,ATF6)3种跨膜蛋白介导产生。在生理状态下,这3种跨膜蛋白均与伴侣蛋白GRP78结合呈无活性状态[9],当发生内质网应激时,GRP78与3种跨膜蛋白脱离,转去结合未折叠或错误折叠的蛋白质,从而磷酸化激活这3种跨膜蛋白,进而激活其下游的CHOP和XBP1s,分别通过抑制新蛋白质的翻译与合成、增强内质网内蛋白质的正确折叠能力和激活其下游基因的转录[1,10]等方式加快蛋白质的正确折叠,达到防止未折叠、错误折叠蛋白质大量聚集的目的[11]。故本次实验选用GRP78和磷酸化/非磷酸化的PERK、IRE1作为标志蛋白,用于检测内质网应激的程度。然而,当内质网应激过于剧烈或持久时,细胞自身不能有效地清除未折叠的蛋白质,就会启动相关的凋亡程序[12,13],这也是应激细胞发生损伤的重要原因。 故本实验选取了CHOP和GADD34这两个既反映内质网应激又反映细胞凋亡的指标。
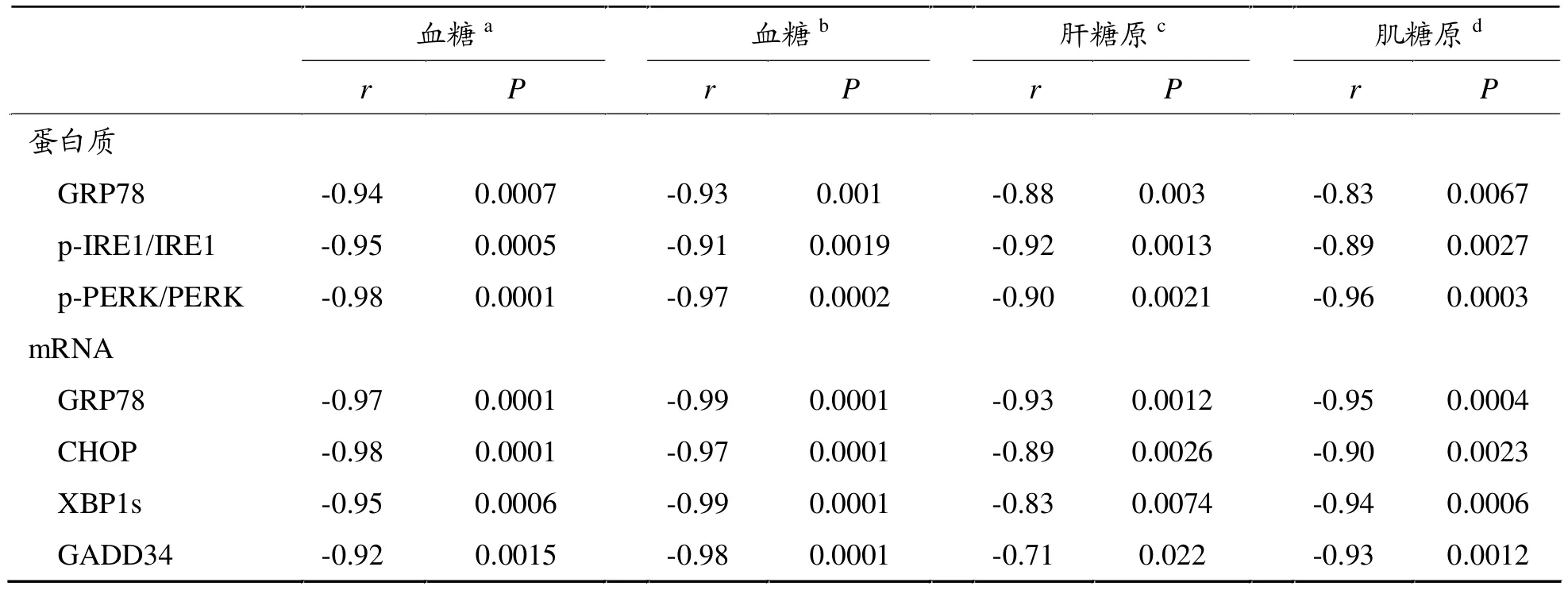
表3 内质网应激标志蛋白及m RNA表达量与血糖及糖原含量相关分析
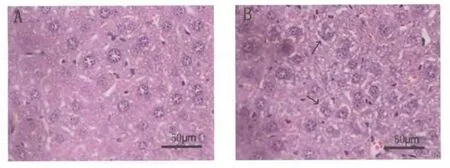
图3 安静组(A)和运动组(B)两组肝脏组织结构(×400)
本次实验观察到,一次性力竭运动后,肝脏和股四头肌组织内质网应激蛋白GRP78、p-PERK/PERK和p-IRE1/IRE1表达较安静组均显著升高,其中肝脏组织应激程度较大。同时,其下游分子CHOP、XBP1s和GADD34 mRNA表达也显著升高,与标志蛋白表达结果一致。 这与 Gonzalez 等[14]、Stary 等[15]和Wu等[3]通过一次性跑台运动发现肝脏和骨骼肌内质网应激标志分子表达显著升高一致。
糖原是机体储存能量的重要方式,以骨骼肌和肝脏储量最为丰富,与机体运动能力密切相关,而一次性力竭运动可导致糖原储备大量消耗。本实验结果显示,尽管力竭性游泳已过去4小时(4小时是为观察标志蛋白质表达所预留的时间),糖原含量已部分恢复,但仍显著低于对照组,血糖、肝糖原和肌糖原分别降低16.78%、14.24%和53.85%。我们推测,糖原储备量和消耗量可能与内质网应激的程度有关。相关分析结果显示,血糖水平和糖原含量均与内质网应激标志物的表达呈显著负相关,即糖原含量越低,内质网应激标志蛋白表达越高。本实验中,急性力竭运动导致肌糖原的大量消耗,随着运动时间延长,为了满足肌肉收缩的能量需要,骨骼肌从细胞外摄取葡萄糖增加,导致血糖水平下降;为了维持血糖稳定,肝脏糖异生和糖原分解作用加强,从而使肝糖原下降[16,17]。 我们的研究中,相关分析结果显示,血糖水平越低,内质网应激标志蛋白表达越高。这提示糖原储备量和消耗量可能是一次性急性力竭运动引起的内质网应激的关联因素。糖原消耗导致局部和全身组织中的快捷供能物质下降,引起能量供应不足,最后导致内质网应激的发生。糖原在内质网应激中的作用还有待深入研究。
我们还发现,一次性急性力竭运动可导致部分肝脏细胞胞浆水肿,这可能是暂时性的。尚未发现骨骼肌细胞有此变化。有人推测,细胞胞浆水肿可能与肝细胞三磷酸腺苷(ATP)减少、能量供应不足有关[18,19]。 急性力竭运动导致肝糖原大量消耗,是肝细胞ATP减少的重要原因。肝细胞水肿可导致肝细胞结构的暂时变化,而这种暂时性的结构改变与内质网应激的关系,值得进一步探讨。
生活中,常见一些不常参加运动锻炼者突然进行一次大运动量、疲劳性运动,如马拉松跑、登山、远足、游泳等。这种急性运动往往导致深度疲劳,肌肉酸痛,数天难以恢复。内质网应激对机体的影响实质上是对蛋白质合成代谢的影响,而运动后蛋白质的合成对运动性修复极为关键。急性运动引发内质网应激,进而影响蛋白质的合成和运动后修复,这可能是疲劳难以恢复的原因之一。如果平时多吃碳水化合物含量较多的食物,提高体内糖原含量,并经常多做锻炼,改善糖原利用状态,有可能减轻内质网应激的程度,加快疲劳恢复。相关的机制和猜测,还需研究加以证实。
4 小结
一次性力竭运动可引起肝脏和股四头肌组织内质网应激明显增加。肝糖原和肌糖原的储备和运动消耗量可能与内质网应激程度有关。
[1]Hotamisligil GS.Endoplasmic reticulum stress and the inflammatory basis of metabolic disease.Cell,2010,140(6):900-917.
[2]温悦萌,艾华.内质网应激与炎症、肥胖、脂代谢和运动关系研究进展.中国运动医学杂志,2011(9):870-873.
[3]Wu J,Ruas JL,Estall JL,et al.The unfolded protein response mediates adaptation to exercise in skeletal muscle through a PGC-1alpha/ATF6alpha complex.Cell Metab,2011,13(2):160-169.
[4]Staib JL,Tumer N,Powers SK.Increased temperature and protein oxidation lead to HSP72 mRNA and protein accumulation in the in vivo exercised rat heart.Exp Physiol,2009,94(1):71-80.
[5]Noble EG,Ho R,Dzialoszynski T.Exercise is the primary factor associated with Hsp70 induction in muscle of treadmill running rats.Acta Physiol(Oxf),2006,187(4):495-501.
[6]Morton JP,Kayani AC,McArdle A,et al.The exercise-induced stress response of skeletal muscle,with specific emphasis on humans.Sports Med,2009,39(8):643-662.
[7]Ron D,Walter P.Signal integration in the endoplasmic reticulum unfolded protein response.Nat Rev Mol Cell Biol,2007,8(7):519-529.
[8]Rasheva VI,Domingos PM.Cellular responses to endoplasmic reticulum stress and apoptosis.Apoptosis,2009,14(8):996-1007.
[9]Oslowski CM,Urano F.Measuring ER Stress and the Unfolded Protein Response Using Mammalian Tissue Culture System.Methods Enzymol,2011,490:71-92.
[10]Zhang K,Kaufman RJ.From endoplasmic-reticulum stress to the inflammatory response.Nature,2008,454 (7203):455-462.
[11]Morton JP,Kayani AC,McArdle A,et al.The exercise-induced stress response of skeletal muscle,with specific emphasis on humans.Sports Med,2009,39(8):643-662.
[12]Fribley A,Zhang K,Kaufman RJ.Regulation of apoptosis by the unfolded protein response.Methods Mol Biol,2009,559:191-204.
[13]Zhang K,Kaufman RJ.Identification and characterization of endoplasmic reticulum stress-induced apoptosis in vivo.Methods Enzymol,2008,442:395-419.
[14]Gonzalez B,Manso R.Induction,modification and accumulation of HSP70s in the rat liver after acute exercise:early and late responses.J Physiol,2004,556(Pt 2):369-385.
[15]Stary CM,Walsh BJ,Knapp AE,et al.Elevation in heat shock protein 72 mRNA following contractions in isolated single skeletal muscle fibers.Am J Physiol Regul Integr Comp Physiol,2008,295(2):R642-R648.
[16]Foskett A,Williams C,Boobis L,et al.Carbohydrate availability and muscle energy metabolism during intermittent running.Med Sci Sports Exerc,2008,40(1):96-103.
[17]Lima-Silva AE,De-Oliveira FR,Nakamura FY,et al.Effect of carbohydrate availability on time to exhaustion in exercise performed at two different intensities.Braz J Med Biol Res,2009,42(5):404-412.
[18]Febbraio MA,Steensberg A,Walsh R,et al.Reduced glycogen availability is associated with an elevation in HSP72 in contracting human skeletal muscle.J Physiol,2002,538(Pt 3):911-917.
[19]Howarth KR,Phillips SM,MacDonald MJ,et al.Effect of glycogen availability on human skeletal muscle protein turnover during exercise and recovery.J Appl Physiol,2010,109(2):431-438.
——疾病防治的新靶标

