不同年龄阶段家兔髂软骨组织学特点
荆立忠 郭秦炜 胡跃林
北京大学第三医院运动医学研究所(北京100191)
修复关节软骨缺损尤其是重度缺损始终是临床医师面对的棘手难题。其主要手术方法包括钻孔术、微骨折术、自体骨软骨移植术以及软骨细胞移植术等[1-3]。但每种术式均有缺点:钻孔术及微骨折术不适用于大面积的软骨缺损和严重的骨软骨损伤;骨软骨移植术容易造成供区关节软骨损伤从而影响供区关节功能;软骨细胞移植术费用昂贵且需行二次手术等[4]。近年来,一些学者将髂软骨作为软骨修复的组织来源[5,6],从而克服了上述各种术式的缺点。但髂软骨的性质及随年龄增长的变化特点,目前缺乏相关的详细研究。本实验观察了不同年龄阶段家兔髂软骨的组织学特征,并与相应年龄阶段的膝关节软骨进行比较,研究其与关节软骨在组织结构方面的异同点。
1 材料和方法
1.1 实验动物
健康新西兰大白兔15只,1月龄、3月龄、4月龄、6月龄、12月龄各3只。雌雄不限。
1.2 标本的处理
分别用骨刀切取每只家兔的两侧髂软骨及少量软骨下骨和1月龄、3月龄和12月龄组膝关节股骨滑车软骨标本各1块,直径4 mm、厚度6 mm,将标本修切整齐,用于组织学分析:取材后马上浸入4%多聚甲醛(solarbio公司)固定48小时,生理盐水冲洗,然后放入10%甲酸脱钙液脱钙7~10天,石蜡包埋后切片,厚度5 mm。
1.3 组织化学染色
分别将各组髂软骨和关节软骨的切片脱蜡,进行HE染色和甲苯胺蓝染色。
1.4 免疫组化染色
小鼠抗兔I型胶原单克隆抗体、小鼠抗兔II型胶原多克隆抗体均购自Calbiochem公司。山羊抗小鼠第二抗体(PV-6002)及胃蛋白酶均购自中杉金桥公司,DAB显色试剂盒购自基因科技公司。
分别将各年龄段髂软骨和关节软骨的切片脱蜡,恢复室温后,用胃蛋白酶处理(37℃,30分钟),然后分别滴加抗I型及II型第一抗体 (浓度均为1:200,37℃,2小时)。 DAB法显色,阳性结果为棕色。各组均用PBS代替第一抗体作为免疫组化染色阴性对照。
1.5 统计学分析
应用Image-Pro PLUS医学图像分析系统对软骨标本进行成像,分别测量软骨厚度(μm)及细胞密度(个/10000μm2)。 采用SPSS13.0统计学软件进行数据处理,两组之间采用t检验,多组之间采用单因素方差分析检验进行比较。实验数据以±s表示,P<0.05表示差异有显著性意义。
2 结果
2.1 关节软骨的组织学染色
关节软骨主要由透明软骨细胞组成。随着年龄的增长,软骨细胞密度逐渐下降,软骨层厚度逐渐变薄,肥大层及钙化层逐步出现细胞骨化。甲苯胺蓝染色变浅。II型胶原免疫组化染色阳性(图1)。按表层、移行层、柱状层、肥大层、钙化层分层后对每层厚度及细胞密度进行测量,具体数据见表1。
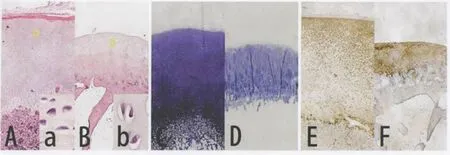
图1 各年龄组关节软骨组织学染色结果(×40)
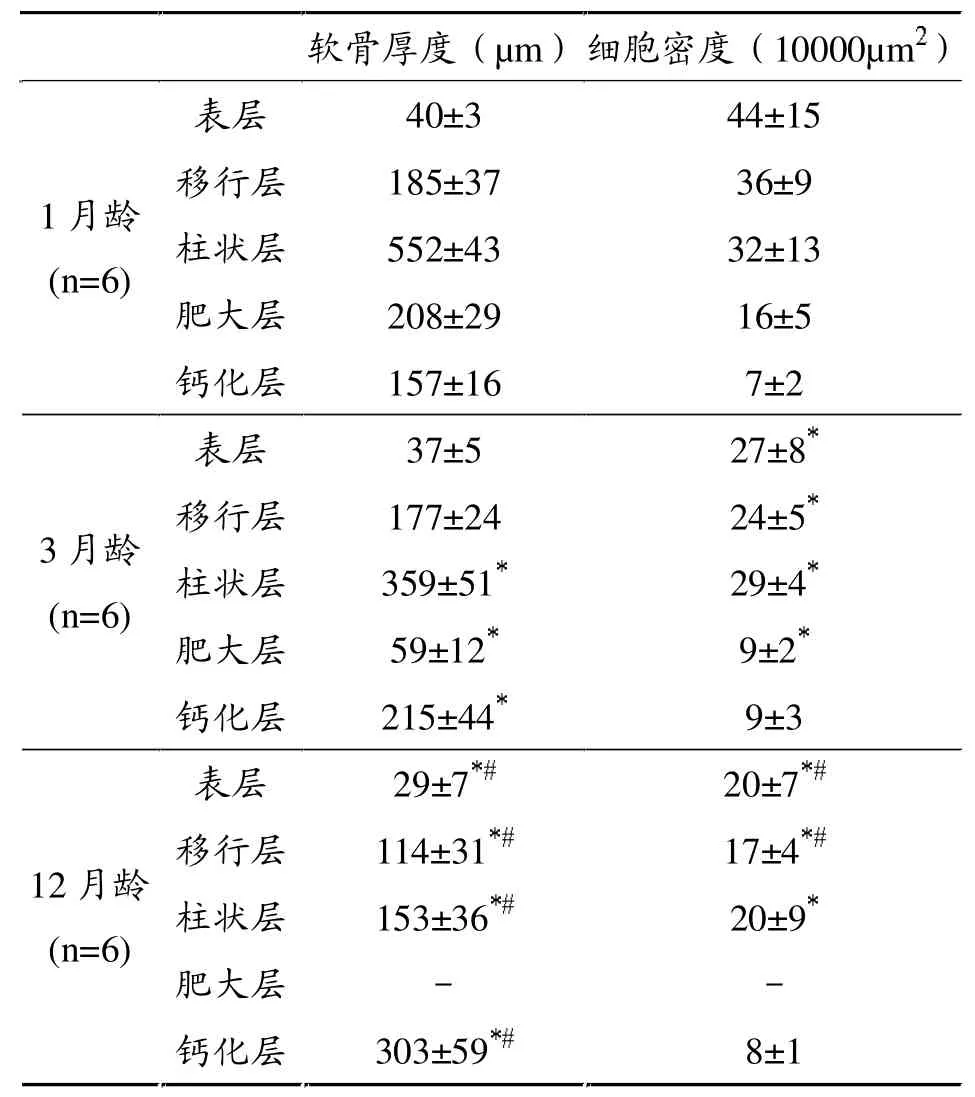
表1 关节软骨厚度及细胞密度随年龄增长的变化
2.2 髂软骨的组织学染色结果
2.2.1 1月龄标本
HE染色可见,浅表层及中间层有大量软骨细胞,形态主要为圆形,体积较小,软骨细胞分布均匀,内无细胞肥大及钙化现象;深层软骨细胞呈扁平型,细胞长径垂直于骨之长轴,同源细胞群呈长串状,与髂骨纵轴平行排列;钙化软骨层较窄,细胞体积增大,胞质呈空泡状。甲苯胺蓝染色均匀,无失染现象。II型胶原免疫组化染色阳性,I型胶原免疫组化染色阴性。
2.2.2 3月龄标本
HE染色可见,浅表层及中间层变薄,部分区域出现肥大软骨细胞,大而圆,三五成群;深层长串状的同源细胞群相对变少。肥大软骨细胞区甲苯胺蓝染色缺失。肥大软骨细胞区II型胶原免疫组化染色阴性,其余区域染色阳性。软骨区I型胶原免疫组化染色阴性,软骨下骨I型胶原免疫组化染色阳性。
2.2.3 4月龄标本
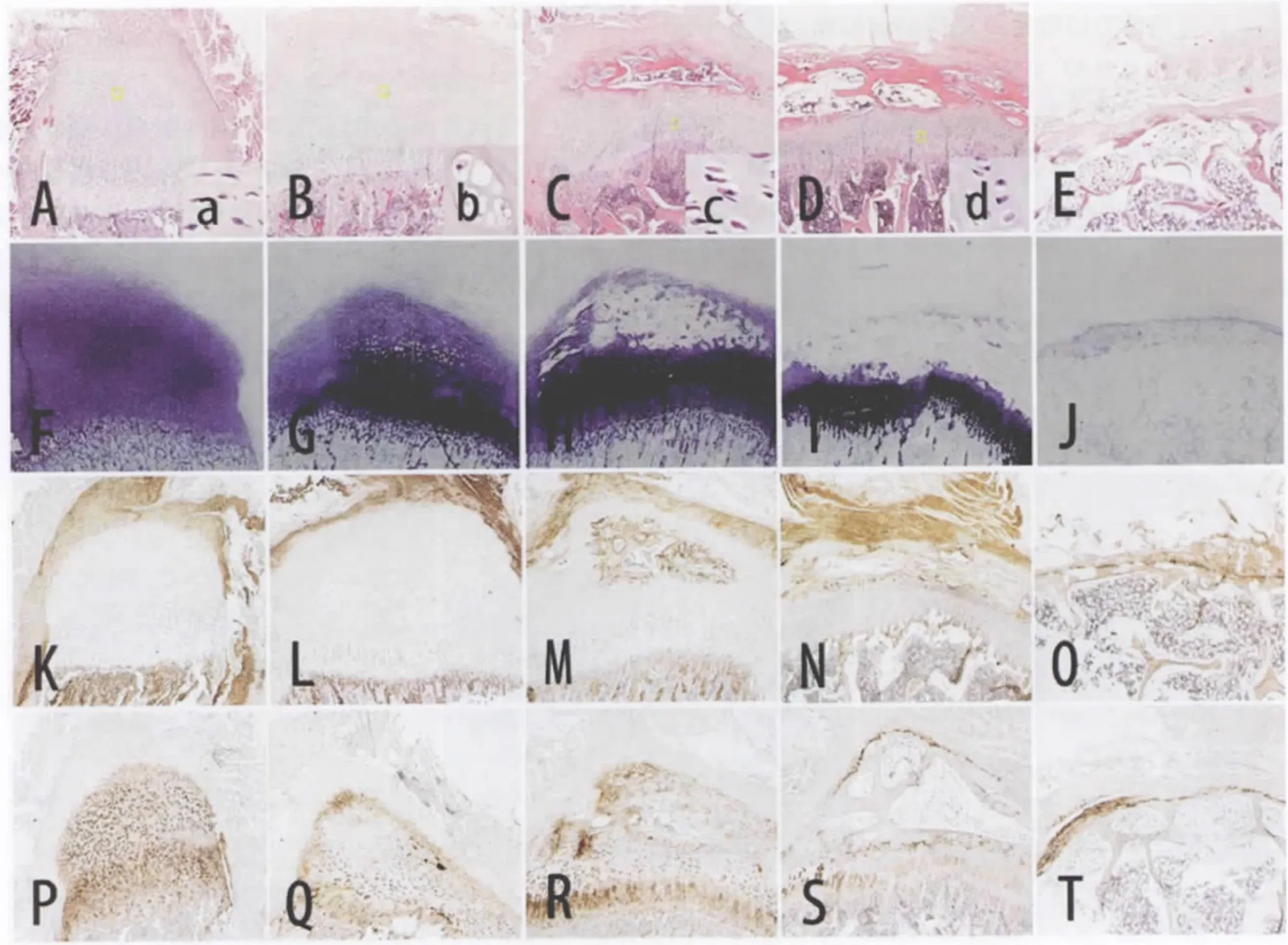
图2 各年龄组髂软骨组织学染色结果(×40)
HE染色可见,浅表层及中间层部分区域出现散在骨化灶;深层长串状的同源细胞群变少。骨化区甲苯胺蓝染色缺失。骨化区II型胶原免疫组化染色阴性,其余软骨区域染色阳性。软骨区I型胶原免疫组化染色阴性,骨化区及软骨下骨I型胶原免疫组化染色阳性。
2.2.4 6月龄标本
HE染色可见,浅表层及中间层软骨几乎全部骨化,软骨细胞稀少;深层长串状的同源细胞群变短、变稀,细胞数量进一步减少;钙化软骨层部分细胞出现骨化,细胞数量减少。骨化区甲苯胺蓝染色缺失。骨化区II型胶原免疫组化染色阴性,其余区域染色阳性。软骨区I型胶原免疫组化染色阴性,骨化区及软骨下骨I型胶原免疫组化染色阳性。
2.2.5 12月龄标本
HE染色见软骨层缺失,软骨几乎全部骨化;甲苯胺蓝染色浅染,II型胶原免疫组化染色弱阳性,染色区域窄,I型胶原免疫组化染色阳性。
3 讨论
髂软骨是肌腱在髂骨处的附着点,属于特殊类型的牵拉性软骨[7],其骨化后表面即成为肌腱止点。作为肌肉附着于骨面的着力点,肌腱止点不仅要把肌肉的收缩力量完全传递到效应骨上,还要有应力缓冲作用[8],这就可以理解髂软骨存在的意义。
Ponseti等[7]通过 HE组织学染色初步研究、比较了人体髂软骨在组织形态学及化学成分上的异同,研究集中在儿童到青少年阶段,作者研究发现婴幼儿的髂软骨主要由透明软骨组成。青年期开始出现软骨细胞肥大、骨化现象。该实验欠缺之处在于作者未进一步对比成年标本,也未深入全面地将其与关节软骨加以对比。此后,利用髂软骨修复各种关节软骨缺损屡见报道[5,6],髂软骨也广泛应用于修复多种颜面部缺损畸形[9],均取得较满意的结果。但髂软骨的性质以及随年龄增长出现的变化,相关学者并未继续进行深入研究。
本研究中,关节软骨的组织学特点及其随年龄出现的变化规律与其他有关学者的研究[10]一致:随着年龄增长,软骨细胞密度逐渐下降,细胞体积增大,软骨层厚度逐渐变薄。本实验进一步按表层、移行层、柱状层、肥大层、钙化层对每层厚度及每层软骨细胞密度随年龄增长出现的变化进行了描述,从而更加全面地阐述了其变化规律。另外,随着年龄增长,甲苯胺蓝染色也稍微变浅,这可能与基质合成能力下降有关。肥大层及钙化层出现钙化,但正常条件下表层、移行层、柱状层无软骨钙化。
与关节软骨类似,髂软骨也主要由透明软骨细胞组成,基本可划分为浅表层、中间层、深层以及钙化层。但与关节软骨不同的是,随着年龄的增长出现软骨细胞肥大及骨化现象的主要为浅表层及中间层,首先是浅表层及中间层不同部位出现数个小的骨化灶,至成年期骨化灶连成一个整体,最终整个软骨层几乎全部骨化。由幼年到成年,甲苯胺蓝染色以及II型胶原免疫组织化学染色均逐渐变浅;I型胶原免疫组织化学染色显示其只在软骨下骨及肌腱部位着色,成年后随着软骨出现骨化,I型胶原在骨化区着色。如实验所述,成年后各透明软骨相关指标虽然都有所下降,但仍有II型胶原蛋白的合成及蛋白粘多糖、硫酸软骨素的分泌,而这些指标正是透明软骨所特有的。
与髂软骨类似,髌尖末端结构也属于牵拉性软骨的一种。丁长隆等[8]在对其进行研究时发现在有些老年髌尖末端结构内,部分老化纤维软骨细胞反分化为透明软骨细胞形成透明软骨岛,原有的纤维软骨细胞几乎不可见。关于其发生原因,作者推测可能为各种因素致使局部细胞环境发生改变,刺激老化细胞发生反分化,再由这种分化较低的细胞分化成透明软骨岛。近年来大量实验已证实,多种细胞生长因子均能使肥大骨化的软骨细胞出现反分化[11,12],我们推测,上述细胞出现反分化的原因可能与局部生长因子的作用有关。如果推测成立,生长因子对同为牵拉性软骨的髂软骨有无类似作用将值得进一步探讨。
总之,髂软骨有希望成为软骨缺损的修复材料,结合其具有手术操作简单、来源充足、无关节供区损伤等优点,对其进行全面深入研究将为软骨缺损修复领域开辟新思路,进而有助于解决大面积关节软骨损伤修复的难题。但移植到软骨缺损区后会不会发生骨化以及如何克服此种弊端,尚需进一步研究证实。
4 总结
家兔幼年期髂软骨类似于关节透明软骨,但随着年龄的增长,髂软骨细胞逐渐肥大、骨化,至成年期仍有少量透明软骨细胞特有的II型胶原蛋白及蛋白多糖的合成。
[1]Chuckpaiwong B,Berkson EM,Theodore GH.Microfracture for osteochondral lesions of the ankle:outcome analysis and outcome predictors of 105 cases.Arthroscopy,2008,24:106-112.
[2]Scranton PJ,Frey CC,Feder KS.Outcome of osteochondral autograft transplantation for type-V cystic osteochondral lesions of the talus.J Bone Joint Surg Br,2006,88(5):614-619.
[3]Baums M H,Heidrich G,Schultz W,et al.Autologous chondrocyte transplantation for treating cartilage defects of the talus.J Bone Joint Surg Am,2006,88(2):303-308.
[4]余家阔.膝关节软骨全层缺损的常用修复方法.中华关节外科杂志(电子版),2010,4(6):708-722.
[5]Osman Aynac SG.The treatment of osteochondral defects with autologous osteochondral and apophyseal grafts in animal models.Joint Dis Rel Surg,2008,19(3):119-126.
[6]Takao M,Innami K,Komatsu F,et al.Retrograde cancellous bone plug transplantation for the treatment of advanced osteochondral lesions with large subchondral lesions of the ankle.Am J Sports Med,2010,38(8):1653-1660.
[7]Ponseti IV,Pedrini-Mille A,Pedrini V.Histological and chemical analysis of human iliac crest cartilage.I.Observations on trunk growth.Calcif Tissue Res,1968,2(3):197-213.
[8]于长隆,曲绵域,田得祥,等.人髌尖末端结构及其生物学意义.北京医学院学报,1983,(4):267-273.
[9]王克涛,魏奉才,刘云生,等.牙槽突植骨同期髂软骨移植治疗单侧唇腭裂术后鼻畸形.口腔颌面外科杂志,2005,15(4):349-351.
[10]罗小平.不同年龄段正常膝关节软骨厚度的MRI测量研究.实用临床医学,2007,(7):98-99.
[11]Gonzalez C,Auw YK,Schwab JH,et al.Transforming growth factor-beta1 modulates insulin-like growth factor binding protein-4 expression and proteolysis in cultured periosteal explants.Growth Horm IGF Res,2010,20(2):81-86.
[12]Waese E,Stanford WL.One-step generation of murine embryonic stem cell-derived mesoderm progenitors and chondrocytes in a serum-free monolayer differentiation system.Stem Cell Res,2011,6(1):34-49.

