氯霉素单克隆抗体的制备与纯化
易 喻,汪竹环,朱克寅,李 敏,应国清
(1.浙江工业大学 药学院,浙江 杭州 310014;2.杭州博林生物技术有限公司,浙江 杭州 310018)
氯霉素(chloramphenicol,CAP)是一种广谱性抗生素,对革兰阴性菌和革兰阳性菌均有很好的抑制作用[1]。由于其优良的抗菌性和低廉的价格,因此常作为细菌性疾病的治疗药物应用于人和动物,并作为饲料添加剂广泛应用于畜牧业和人工水产养殖业。但是,CAP具有毒性,易引起人体血中毒,长期应用可导致再生障碍性贫血和粒细胞缺乏症。婴儿长期食用CAP污染的乳汁,可能会引起“灰婴综合征”[2-3]。此外长期微量摄入CAP,不仅使大肠杆菌、沙门氏菌等产生耐药性,而且会引起机体正常菌群失调,使人们易感染各种疾病[4]。如果CAP在食用动物中残留,可通过食物链传给人类,对人类的健康造成危害,因此,抗CAP单克隆抗体的制备对动物性食品中CAP的检测具有重要意义。本研究以纯化的CAP全抗原为免疫原,利用淋巴细胞融合技术,建立了能稳定分泌特异性抗CAP单克隆抗体的杂交瘤细胞株,并对得到的单克隆抗体进行了纯化和鉴定,为动物性食品中 CAP的检测提供实验基础。
1 材料
SP2/0骨髓瘤细胞,南京凯基生物科技发展有限公司。
CAP,上海晶纯试剂有限公司;HAT培养液、HT培养液、PEG1500,Sigma公司;胎牛血清,民海生物工程有限公司;牛血清白蛋白(BSA),上海生工生物工程有限公司;RPMI 1640培养液,吉诺生物医药技术有限公司;免疫原CAP-BSA和检测抗原CAPOVA,本实验室合成;羊抗小鼠 IgG-HRP,博士德生物工程有限公司。
BALB/c小鼠,浙江省动物实验中心,许可证:SCXK(沪)2008-0016;F1小鼠,浙江中医药大学动物实验中心,许可证:SCXK(沪)2007-0005。
2 方法
2.1 免疫
用纯化的CAP-BSA抗原淋巴注射6~8周龄的BALB/c小鼠,每次免疫量为100μg/只,第1次免疫与等量的弗式完全佐剂充分乳化,第2和第3次免疫与等量的弗氏不完全佐剂充分乳化,每次间隔7d,融合前3 d腹腔直接注射抗原100μg加强免疫。
2.2 细胞融合
将小鼠处死,无菌摘取脾脏,研磨制取脾B淋巴细胞悬液,洗涤调整细胞浓度为(1~5)×107/mL。将免疫脾B淋巴细胞与处于对数生长期的骨髓瘤细胞按 5∶1混合后离心弃上清,缓慢加入50%PEG1500溶液1mL,间隔1 min后,缓慢滴入无血清培养液,终止融合剂的作用,经洗涤去除融合剂后加入所需量的细胞培养液,分种于96孔培养板,每孔200μL,置于37℃,5%CO2饱和湿度培养。
2.3 杂交瘤细胞的筛选
在选择HAT培养基中,骨髓瘤细胞是不能生长的,而只有骨髓瘤细胞与B淋巴细胞的融合细胞能增殖生长;此外,正常B淋巴细胞一般在培养情况下也是不能长期存活,因而被淘汰。在细胞融合24 h后,每孔加入HAT培养液,每3 d换液1/2 HAT选择培养液,经过2周的培养后,骨髓瘤细胞与B淋巴细胞的杂交瘤细胞即被选择培养出,然后进行单克隆化。
采用有限稀释法进行细胞单克隆化,按实验室常规方法操作,一般3~4次,直至克隆细胞生长的各个孔检测100%抗体阳性为止。
2.4 单克隆抗体的制备及其性质的鉴定
采取体内诱生法制备大量腹水。先腹腔注射液体石蜡0.5mL于F1小鼠,1周后腹腔注射1×106个杂交瘤细胞,接种细胞7~10 d后可产生腹水,待腹水尽可能多,收集腹水,可反复收集数次。
间接竞争ELISA(ciELISA)筛选杂交瘤细胞。用包被液将CAP-OVA抗原稀释成一定浓度,1μg/孔包被酶标板,设置空白对照孔,37℃包被2 h;PBS-T溶液浸洗3次,每孔加入细胞上清液200μL,37℃孵育1 h;PBS-T溶液浸洗3次,每孔加入用BSA溶液按 1∶3 000稀释的羊抗小鼠 IgG-HRP 100μL,37℃孵育1 h;PBS-T溶液浸洗3次,双蒸水浸洗3次,每孔加入邻苯二胺底物溶液100μL,置于暗处反应5 min,阳性孔变为棕黄色,每孔加入2 mol/L H2SO4溶液100μL终止反应。筛选出的阳性孔再用CAP-OVA包被的酶标板进行竞争抑制性ELISA法,先将细胞培养上清与2×10-3mol/L的CAP溶液等量混合,37℃作用1 h,再加入已包被的酶标板中。同时用0.01 mol/L,pH 7.4的PBS替代CAP溶液作对照。若经抑制后的A490降至对照孔50%以下,则判为阳性孔。
2.5 抗体的纯化
选择5mL HiTrap r-Protein A FF预装色谱柱纯化抗体。20mmol/L磷酸缓冲液上样,用0.1 mol/L甘氨酸缓冲液洗脱。考察选择上样缓冲液的pH和NaCl浓度、洗脱液的pH对抗体纯化的影响[5]。
SDS-PAGE鉴定单克隆抗体的纯度和回收率。分离胶浓度12%,浓缩胶浓度4%,还原状态下处理样品,电泳后以考马斯亮蓝R250染色,乙醇乙酸脱色,直至背景脱净为止,然后经凝胶成像系统扫描并分析,鉴定其纯度和回收率。
2.6 单克隆抗体特异性的测定
用ciELISA法测定纯化后抗体与BSA、甲砜霉素以及磺二甲基嘧啶之间的交叉反应,用BSA、甲砜霉素、磺二甲基嘧啶等稀释液替代CAP稀释液,其他条件相同。以50%抑制的CAP浓度与50%抑制的类似物浓度之比为其交叉反应率。交叉反应率=(50%抑制的CAP浓度/50%抑制的类似物浓度)×100%。交叉反应率的大小了反应了抗氯霉素单克隆抗体的特异性[6]。
3 结果
3.1 杂交瘤细胞株的建立
3.1.1 小鼠血清抗体效价检测 CAP-BSA抗原免疫的BALB/c小鼠共4只,眼眶取血检测效价(表1)。4只小鼠的血清抗体效价都达到了10-6以上,免疫效果较好,可进行细胞融合。
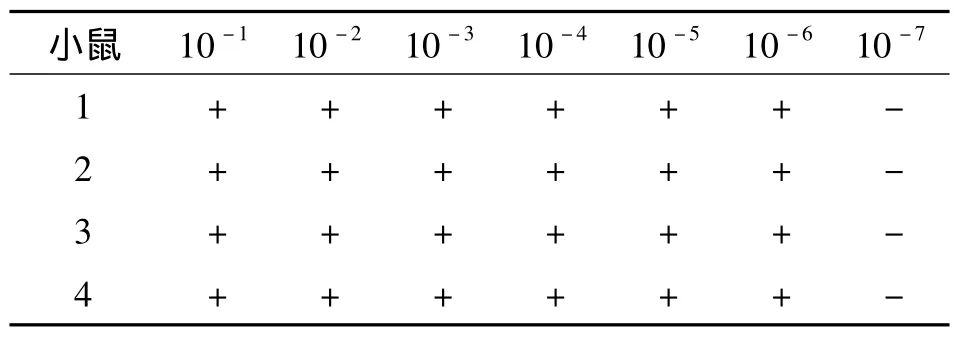
表1 免疫小鼠血清抗体效价Tab.1 Antibody titers in the sera of the mice immunized with CAP-BSA
3.1.2 杂交瘤细胞株的建立 细胞融合后经HAT培养液筛选后以及间接ELISA检测,测出9个阳性孔,取上清效价最高(10-4)的两孔细胞株(1D1,3G12)采用有限稀释法单克隆化4次,从表2看出,第2,3,4次单克隆时,2株细胞的阳性率均为100%。杂交瘤细胞株经14周的培养后依旧能稳定分泌单克隆抗体。经液氮冻存、复苏后,两株细胞系仍能稳定分泌特异性抗CAP抗体。

表2 2株杂交瘤细胞株单克隆化实验结果Tab.2 Result of hybridoma cell cloning of 2 hybridoma cells
3.2 单克隆抗体的制备及其性质的鉴定
3.2.1 杂交瘤细胞上清蛋白含量及抗体效价的检测 细胞上清抗体效价达到了10-4以上(表3)。
3.2.2 腹水蛋白含量及抗体效价的检测 2株杂交瘤细胞株注射小鼠腹腔均能产生较高浓度的蛋白,且抗体效价均在10-7以上(表3)。
3.3 抗体的纯化
在上样缓冲液pH 6.5,7.0,7.5 条件下,单抗均能保留在色谱介质上。在pH 7.0的上样条件下,洗脱的目的蛋白峰中杂蛋白含量较少,而且抗体在中性条件下也最为稳定,所以确定pH 7.0为上样的最佳pH。
上样缓冲液中NaCl的浓度达4 mol/L以上时达到了其溶解度产生盐析效应,从而影响抗体的稳定性。当NaCl浓度在0~3.0 mol/L时,目的单抗均能较好地与色谱介质结合,在NaCl浓度为3.0 mol/L时,洗脱的目的蛋白峰中杂蛋白含量较少,纯度较高。
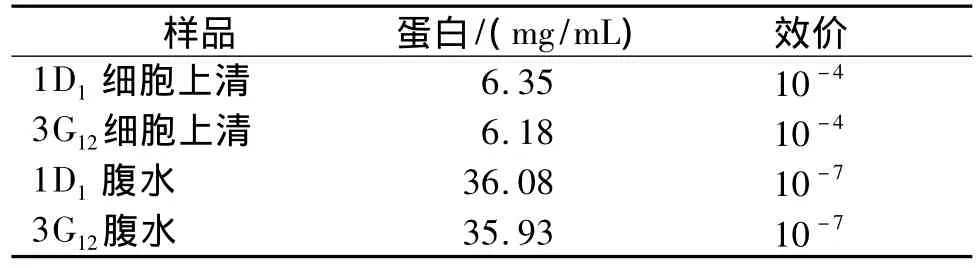
表3 细胞上清和腹水中的蛋白含量及抗体效价Tab.3 Protein concentration and antibody titer of cell culture supernate and obtained ascites
0.1 mol/L甘氨酸-盐酸缓冲液作为洗脱液,进行一步洗脱。pH 值为2.5,3.0和3.5,实验结果表明均能很好地将目的抗体与杂蛋白进行分离,随着pH的增加,分辨率逐步提高,最后将抗体峰和杂蛋白峰彻底分开。目的抗体的纯度大于95%。但随着pH的增加,抗体的回收率也有所下降。因此,确定pH 3.0的0.1 mol/L甘氨酸-盐酸缓冲液作为洗脱液。
本实验确定pH 7.0,20 mmol/L磷酸缓冲液(含3.0 mol/L NaCl)为最佳上样条件;pH 3.0,0.1 mol/L甘氨酸-盐酸缓冲液为最佳洗脱条件。经凝胶成像系统分析可知,抗体纯度可以达到98%,回收率可达80%,抗体的生物学活性良好。色谱结果如图1所示。电泳鉴定结果如图2所示。
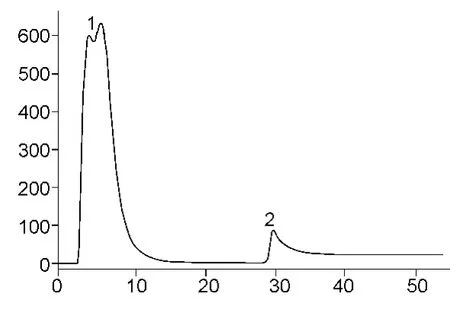
图1 mAb在r-Protein A亲和色谱柱上色谱图Fig.1 Chromatogram of mAb by using HiTrap r-Protein A FF
3.4 单克隆抗体特异性测定
采用ciELISA法测定交叉反应结果见表4,表明单克隆抗体1D1和3G12与BSA、甲砜霉素以及磺二甲基嘧啶均无交叉反应,这说明单克隆抗体1D1和3G12具有较高的特异性。

图2 mAb在r-protein A亲和色谱柱上纯化电泳图Fig.2 SDS-PAGEof mAb purified by using HiTrap r-Protein A FF

表4 单克隆抗体1D1和3G12的交叉反应性Tab.4 Cross-reactivity(CR50%)of monoclonalantibody 1D1 and 3G12
4 讨论
在制备CAP单克隆抗体的过程中,由于CAP(相对分子质量为323)是一种半抗原,本身不具备免疫原性,所以需要将其与大分子载体物质(蛋白质)相偶联成完全抗原,免疫动物时才能刺激机体产生免疫应答。本文采用自制的CAP-BSA免疫BALB/c小鼠,取其脾细胞与小鼠骨髓瘤细胞SP2/0融合,经反复筛选和单克隆化后得到了2株稳定分泌单克隆抗体细胞株。而且交叉反应结果表明所获得的2株细胞分泌的单克隆抗体与BSA,甲砜霉素以及磺二甲基嘧啶均没有交叉反应性。CAP与BSA无交叉反应,说明在免疫应答反应中只有CAP参与了免疫应答反应。而且CAP在结构上和甲砜霉素的区别在于CAP的对位硝基被甲磺酰基取代,这进一步表明硝基在抗原-抗体反应中的作用[7]。这将为为动物性食品中CAP残留的检测打下基础。
本文采用重组蛋白A偶联的琼脂糖凝胶作为亲和介质的蛋白A亲和色谱纯化小鼠腹水来源的抗CAP单克隆抗体,分离效果良好,获得纯度高,特异性强,生物活性好的单抗,并且操作简便,快速,重复性好,色谱柱可反复多次使用,为今后单抗的纯化提供了简单、有效的方法。
[1]Meyer L.Blood dyscrasias attributed to chloramphenicol:A review of 641 publised and unpublished cases[J].Postgrad Med,1974,50:123-126.
[2]王自良,赵 坤,张改平.氯霉素的毒性及其在动物性食品中的残留与检测[J].河南科技学院学报,2005(2):101-105.
[3]Allen E H.Review of chromatographic methods for chloramphenicol residues in milk,eggs,and tissues from food-producing animals[J].Jassoc Off Anal Chem,1985,68(5):990-999.
[4]王桂枝,石德时,毕丁仁,等.氯霉素免疫原的合成与鉴定[J].中国兽医学报,1998(2):163-167.
[5]沈 泓,易 喻,应国清,等.人绒促性腺素单克隆抗体的制备与分离纯化[J].中国生化药物杂志,2010,31(1):22-24.
[6]Gao A Z.Preparation of monoclonal antibodies against a derivative of semicarbazide as a metabolic target of nitrofurazone[J].Anal Chim Acta,2007,592(1):58-63.
[7]Rüdiger H,Erwin M,Gerhard T.Production and characterization of a monoclonal antibody to chloramphenicol[J].Food Agri Immunol,1989(1):197-201.

