Fenton法处理苯酚废水的试验研究
张 曼 李多松
(中国矿业大学环境与测绘学院环境工程系,江苏 徐州 221116)
含酚废水来源广、危害大、治理难度高,是目前水污染控制中重点解决的有害废水之一。随着生产的发展,我们的环境受到了前所未有的破坏,为保护环境,防患未然,各种相应的法律法规相继出台。含酚废水毒性非常高,对一切生物个体都有毒杀作用。因此对含酚废水的处理势在必行。
1 Fenton反应机理
Fenton法是一种高级氧化技术,其超强的氧化性氧化能力主要来自反应产生的·OH,自由基链反应如下:

反应(1)是整个自由基链反应的引发步骤,Fe2+和H2O2的浓度决定·OH的生成量,·OH能够和大多数有机物迅速反应。在一定范围内,增加Fe2+和H2O2的浓度可以增强处理效果,但是过量的Fe2+和H2O2会与·OH反应。因此要严格控制Fe2+和H2O2的比例。
2 试验部分
2.1 试验材料
苯酚模拟废水:称取苯酚0.2g溶于蒸馏水,定量转移至1000mL容量瓶中,苯酚浓度为200mg/L。
2.2 测定指标和分析方法
试验测定指标为苯酚,采用4-氨基安替比林分光光度法测定。
1.3 实验仪器
电子天平;pH计;分光光度计
1.4 试验过程
(1)取水样100ml于250ml锥形瓶内,水样若干份。
(2)调节pH值,向锥形瓶内加入指定量的FeSO4·7H2O,溶解后加入一定量的H2O2,反应一定时间。
(3)反应结束后,调节溶液pH值到9以上,静置,取上清液测定苯酚浓度.
3.结果和分析
3.1 单因素试验
3.1.1 双氧水投加量对苯酚去除率的影响
为考察H2O2量对苯酚去除效果的影响,固定 pH值为 4,Fe2+加入量为 0.1g,反应45min。实验结果如图1所示。

上图表明,苯酚去除率随着H2O2投加量的增加先增大后降低。当H2O2量不足时,随着H2O2的增加,引起·OH的量增加,氧化效果增强。但是当溶液中的H2O2达到一定量后,过量的H2O2能够和·OH反应,消耗了·OH的同时导致H2O2自身分解。确定H2O2的投加量为2-3mL/L。
3.1.2 Fe2+投加量对苯酚去除率的影响
本组试验固定pH值为4,加入H2O20.2mL,反应45min,结果如图2所示。

图2显示,苯酚去除率随着Fe2+浓度的增加先升高后降低。当溶液中Fe2+浓度较低时,没有足够的Fe2+催化H2O2产生·OH,因此随着Fe2+量的增加,苯酚去除率逐渐提高。但当Fe2+超过一定水平后会发生反应Fe2++·OH→Fe3++OH-,使·OH的量减少,去除率下降。Fe2+最佳投加量为0.3-0.4g/L。
3.1.3 pH值对去除效果的影响
在每份水样中均加入0.2gFeSO4·7H2O和0.2mL H2O2,反应45min。实验结果如图3所示。
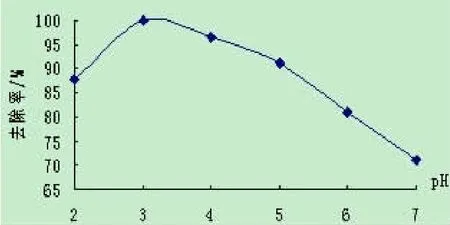
图3 pH值对去除效果的影响
从上图看出,当pH值为3时,苯酚去除效果最好。pH值过低时,溶液中有大量的H+,由(3)和(4)得知,过量的 H+会抑制 Fe3+还原为Fe2+,减少·OH的产生量,从而使去除率下降。当pH值较高时,会使Fe2+的状态发生变化,失去催化活性。因此,试验最佳pH值为3。
3.2 正交试验
以H2O2量、Fe2+量及pH值为考察因素,以苯酚去除率为指标,作三因素三水平正交表,如表1所示。
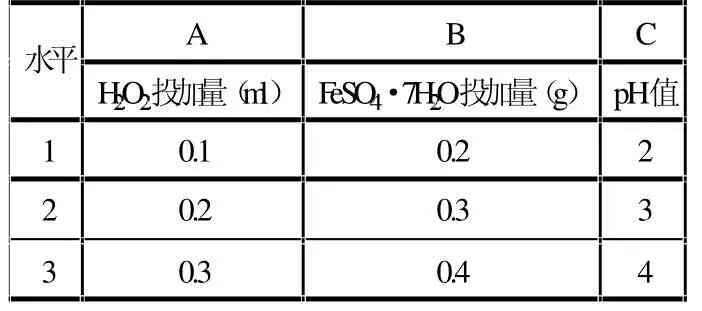
表1 正交试验因素水平

表2 正交试验分析与结果注
:Kj代表某一因素第j(j=1,2,3)水平对
应指标值总和的平均值,R为极差。
在表2中,由于RC>RA>RB,所以各因素对实验结果影响的主次顺序为:pH值>H2O2投加量>Fe2+投加量;对于 H2O2投加量这一因素来说,因为K2>K3>K1,所以第2水平为最优;同理,因素B的最佳水平为第3水平,因素C为第2水平。因而本试验最优水平组合为A2B3C2。
结论
通过研究分析得出:
(1)在给定的水平下,三种因素对Fenton反应处理苯酚废水影响的主次顺序为:pH值>H2O2投加量>Fe2+投加量。
(2)正交试验得出最佳因素组合为:H2O2投加量为2mL/L,Fe2+投加量为4g/L,pH值为3。
[1]赵天亮,宁平,陈芳媛.含酚废水治理技术研究进展[J].环境与健康杂志,2007,24(8):648-649.
[2]王发珍,左东升,李天增等.Fenton试剂处理苯酚废水的研究[J].环境保护科学,2008,34(4):18-20.
[3]邓小晖,张海涛,曹国民,等.芬顿试剂处理废水的研究与应用进展[J].上海化工,2007,32(8):1-5.

