梓醇对乳胞素诱导SH-SY5Y细胞损伤的保护作用
刘 云,包琼琼,庄晓赛,胡 乔,孙妙璇,周莉莉,张 雄
(温州医学院附属第二医院神经内科,浙江温州 325027)
梓醇是地黄中提取的单体活性成分,具有抗癌、抗炎、利尿和降血糖等多种生物学活性。近几年来,梓醇在神经保护尤其是神经退行性疾病方面的作用受到越来越多的关注。据报道,梓醇能够改善1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropypridine,MPTP)和鱼藤酮导致的中脑细胞元损伤[1-3]、改善过氧化氢(H2O2)诱导的PC12细胞及星形胶质细胞的损伤[4-5]以及改善淀粉样β蛋白片段25-35(amyloidβprotein fragment 25 -35,Aβ25–35)诱导的认知功能障碍[6]。帕金森病(Parkinson disease,PD)是我国第二大神经退行性疾病,证据显示PD发病率在65岁以上的老年人约为1.7%[7]。尽管PD具体的病因复杂而且不明确,但是目前泛素-蛋白酶体功能障碍在PD发病中的作用已得到广泛认可[8]。研究表明,20S蛋白酶体抑制剂导致的蛋白酶体功能障碍是导致中脑多巴胺(dopamine,DA)神经元变性的主要原因[9-10]。因此能够改善细胞内20S蛋白酶体含量和功能的药物可以选择作为PD治疗的潜在药物。
乳胞素可抑制20S蛋白酶体多种肽酶的活性,是建立蛋白酶体功能障碍性PD模型的公认药物[11]。SH-SY5Y细胞是国内外研究 PD的常见细胞模型[12]。梓醇虽具有多重神经细胞保护功能[13],但目前对于梓醇在蛋白酶体功能障碍方面的影响还鲜有报道。本课题组前期研究发现,复方地黄能够拮抗6-羟基多巴胺诱导的PD大鼠模型中黑质DA能神经元的丢失,发挥对DA神经元的保护功能(待发表)。本实验选用蛋白酶体抑制剂乳胞素诱导SH-SY5Y细胞建立PD模型,探讨梓醇在蛋白酶体功能障碍所致DA神经元损伤中是否具有保护作用。
1 材料与方法
1.1 细胞、试剂及仪器
SH-SY5Y细胞购自中国医学科学院基础医学研究所北京协和医学院基础医学院;乳胞素购自美国Alexis公司,纯度≥97%;梓醇购自上海同田公司,纯度≥97%;RPMI1640培养基、0.05%胰蛋白酶-EDTA和噻唑蓝(MTT)购自美国Gibco公司;胎牛血清购自美国Hyclone公司;FITC标记膜蛋白碘化丙啶(Annexin-fluorescein isothiocyanate/propodium iodide,FITC-AnnexinⅤ/PI)细胞凋亡试剂盒和 Hoechst染色试剂盒购自南京凯基生物技术有限公司;人20S蛋白酶体定量检测试剂盒购自德国IBL公司。倒置显微镜为日本Nikon公司产品;荧光显微镜为日本Olympus公司产品;流式细胞仪为美国BD公司产品;全自动酶标仪为美国Bio-Tek公司产品。
1.2 细胞培养及分组
SH-SY5Y细胞采用含有10%胎牛血清的R1640培养基,添加青霉素 100 kU·L-1、链霉素100 mg·L-1,置于恒温 37℃、5%CO2的培养箱中培养,隔天换液,选取对数生长期细胞进行实验。根据相关文献报道[7-8],及预实验结果设梓醇浓度10 μmol·L-1,干预时间为 1 h。
细胞分成正常对照组,不加任何药物;乳胞素组加入乳胞素10μmol·L-1作用24 h;梓醇预处理组先加入梓醇10μmol·L-1预处理1 h后,再加入乳胞素10μmol·L-1继续培养24 h;梓醇组加入梓醇10μmol·L-1单独作用 1 h后完全培养继续培养24 h;实验至少重复3次。
1.3 观察SH-SY5Y细胞形态改变
每组细胞相应处理结束后,吸取培养板里培养液,用无菌磷酸盐缓冲液(PBS)洗涤3次,将细胞培养板放到倒置显微镜下观察并拍照。
1.4 MTT法检测细胞存活率
细胞消化成单细胞悬液后接种到96孔板,按照每孔10 000个接种,设6个复孔。细胞贴壁后按照实验分组给予药物处理,处理结束后加入20μl MTT(5 g·L-1),继续培养4 h,吸掉培养液,加入二甲亚砜(DMSO)每孔150μl,摇床上轻轻振荡10 min,用酶联免疫检测仪在波长490 nm处检测各组细胞的吸光度(absorbance,A)。为消除培养板和培养基对结果的影响,实验同时设空白对照组。细胞存活率(%)=(A实验组-A空白组)/(A实验组-A空白组)×100%。
1.5 AnnexinⅤ-FITC流式细胞仪分析细胞凋亡率
细胞培养结束后,消化贴壁的SH-SY5Y细胞为单个细胞悬液,离心去上清,PBS洗涤计数细胞,收集(1~5)×105个细胞,离心去上清,加入缓冲液300μl重悬细胞,加入5μl AnnexinⅤ-FITC,将其混匀后加入5μl PI,室温避光染色30 min后,流式细胞仪检测凋亡率。凋亡率为计数1×104个细胞中凋亡细胞所占百分比。
1.6 Hoechst33258染色检测细胞核形态变化
细胞接种密度为每孔(1~2)×104个,药物处理结束后,加入0.5 ml固定液固定,PBS洗涤,加入0.5 ml Hoechst33258染色液避光反应10 min,以紫外340 nm波长激发,荧光显微镜下观察细胞核形态。正常细胞核出现弥漫均匀的低强度荧光,细胞核如呈浓染致密的固缩形态,记为凋亡的细胞,每组3张不同的玻片上各随机选取4个视野计数,凋亡率(%)=凋亡细胞数/细胞总数×100%。
1.7 双抗体包被法检测细胞内20S蛋白酶体含量
培养结束,消化SH-SY5Y细胞,离心,PBS重悬细胞密度为1×109L-1,反复冻融法裂解细胞,1040×g离心20 min,取上清液。每空加入标准品或待测样品100μl,每组设8个复孔并设立空白对照孔,经温育、洗涤、酶标、显色后,酶联免疫检测仪在450 nm下检测A,根据标准品的A绘制出标准曲线,再根据标准曲线和待测样品A计算出待测样品中蛋白酶体含量(μg·L-1)。
1.8 统计学分析
2 结果
2.1 梓醇对乳胞素诱导的SH-SY5Y细胞形态的影响
正常对照组和梓醇10μmol·L-1组细胞呈扁平多边形,贴壁良好,细胞周边有突起(图1A,B);乳胞素10μmol·L-1组细胞胞体肿胀变圆变小,突起减少,周边折光性增强(图1C);梓醇10μmol·L-1预处理组较乳胞素10μmol·L-1组细胞突起增多,贴壁明显改善及周边折光性减弱(图1D)。
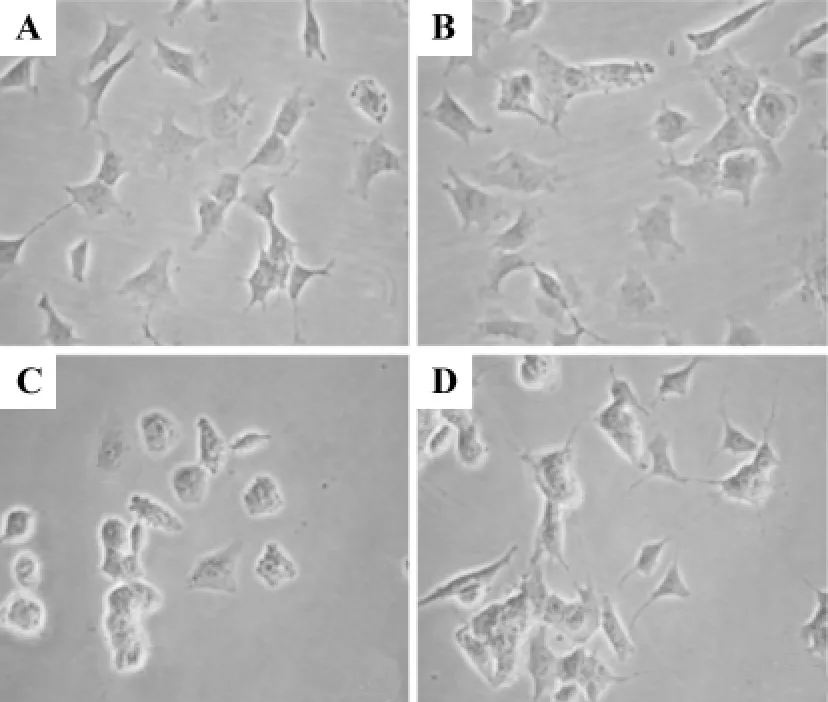
Fig.1 Effect of catalpol on lactacystin-induced cell morphology changes in SH-SY5Y cells(×200).A:normal control group;B:catalpol 10 μmol·L -1 group;C:lactacystin 10 μmol·L -1 group;D:catalpol 10 μmol·L -1+lactacystin 10 μmol·L -1 group.
2.2 梓醇对乳胞素诱导的SH-SY5Y细胞存活的影响
梓醇10 μmol·L-1组细胞存活率为(99.7 ±3.0)%,与正常对照组相(100.0 ±2.5)%相比,无统计学差异;乳胞素10 μmol·L-1组细胞存活率(72.0 ±1.8)%明显下降(P <0.05);梓醇 10 μmol·L-1预处理组细胞存活率为(87.9±2.2)%,与乳胞素组相比明显升高(P <0.05)。
2.3 梓醇对乳胞素诱导的SH-SY5Y细胞凋亡率的影响
流式细胞双染结果(图2)显示,与正常对照组细胞凋亡率 (33.6±2.1)% 相比,乳胞素10 μmol·L-1组细胞凋亡率为(64.7 ±2.6)%,明显增加(P <0.05);梓醇10 μmol·L-1预处理组细胞凋亡率为(51.4±1.5)%,与乳胞素组比较明显下降(P <0.05)。
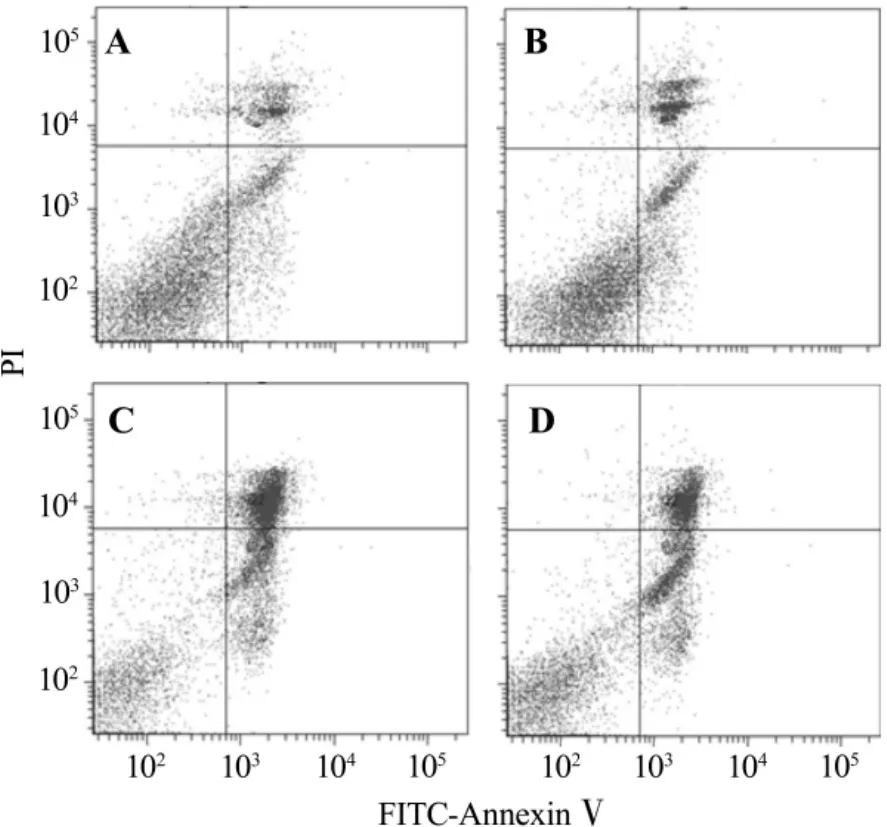
Fig.2 Effect of catalpol on lactacystin-induced cell apoptotic rate changes in SH-SY5Y cells.A:normal control group;B:catalpol 10 μmol·L -1 group;C:lactacystin 10 μmol·L -1 group;D:catalpol 10 μmol·L -1+lactacystin 10 μmol·L -1 group.
2.4 梓醇对乳胞素诱导的SH-SY5Y细胞核形态的影响
荧光显微镜下观察SH-SY5Y细胞核形态发现,正常对照组与梓醇组细胞核边缘光滑整齐,呈蓝色,均匀淡染(图 3A,B);乳胞素10 μmol·L-1组可见凋亡特征性改变,如细胞核固缩,边缘不整齐,呈碎块状致密浓染,甚至可看核裂解(图3C);与乳胞素10 μmol·L-1组比较,梓醇 10 μmol·L-1预处理组细胞核形态明显改善,细胞核固缩裂解减少(图3D)。与正常对照组细胞凋亡率(18.7±1.5)%相比,乳胞素10 μmol·L-1组细胞凋亡率为(48.5 ±2.3)%,明显升高(P <0.05);梓醇10 μmol·L-1预处理组细胞凋亡率为(25.7±2.3)%,与乳胞素组相比较明显降低(P <0.05)。
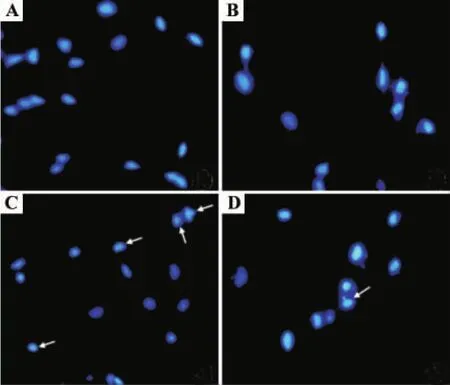
Fig.3 Effect of catalpol on lactacystin-induced nuclear morphology changes in SH-SY5Y cells(Hoechest33258 staining × 400).A:normal control group;B:catalpol 10 μmol·L-1 group;C:lactacystin 10 μmol·L -1 group;D:catalpol 10 μmol·L -1+lactacystin 10 μmol·L -1 group.
2.5 梓醇对乳胞素诱导的SH-SY5Y细胞内20S蛋白酶体含量的影响
ELISA结果显示,与正常对照组细胞内20S蛋白酶体含量(58.2 ± 1.6)μg·L-1相比,乳胞素10 μmol·L-1组细胞内蛋白酶体含量为(23.8 ±2.1)μg·L-1,明显降低(n=3,P <0.05);与乳胞素10 μmol·L-1组相比,梓醇10 μmol·L-1预处理组细胞内蛋白酶体含量为(42.2 ±2.2)μg·L-1,明显升高(n=3,P <0.05)。
3 讨论
有研究表明,在PD发病过程中存在细胞的凋亡,Agid等[14]检测黑质DA神经元凋亡形态学和生化过程发现,在PD患者脑内DA神经元有细胞凋亡特征性改变,提示细胞凋亡可能是DA神经元变性的基本步骤。据报道,地黄配成复方制剂对神经元细胞凋亡有明显的抑制作用[15]。而梓醇是地黄中的主要活性成分,具有多种神经保护作用。本实验发现,经蛋白酶体抑制剂乳胞素处理后,SH-SY5Y细胞的凋亡率增加以及细胞核固缩裂解增加;而低浓度梓醇预处理后再进行乳胞素处理,细胞的形态得到改善、存活率升高和凋亡率下降及细胞核固缩裂解现象减少。提示梓醇能够减少乳胞素诱导的SH-SY5Y细胞凋亡,发挥对乳胞素诱导的DA神经元的保护功能。
泛素蛋白酶体是体内蛋白降解的重要通道,在多种细胞周期性增殖及凋亡相关蛋白的降解中发挥重要作用。据报道,PD可能是一种蛋白降解障碍疾病[16],并且在PD中泛素-蛋白酶体功能障碍与多巴胺能神经元的凋亡存在密切的关系[17]。本实验发现,单用乳胞素处理细胞24 h后,细胞内蛋白酶体含量明显下降,而低浓度梓醇预处理后能够抑制乳胞素诱导的细胞内蛋白酶体含量下降。推测梓醇的神经保护可能与其提高细胞内蛋白酶体含量有关。
本实验研究发现,梓醇预处理后可以逆转蛋白酶体抑制剂乳胞素诱导的DA神经元细胞的凋亡,并推测其机制可能与提高细胞内蛋白酶体含量有关。首次从蛋白酶体途径上说明了梓醇的神经保护作用,为梓醇在神经退行性疾病PD的防治方面提供了有力的实验证据。本次实验从对蛋白酶体含量的影响上展现了梓醇对DA神经元的保护作用,其具体机制及其对蛋白酶体功能方面的影响将是本课题组下一步研究目标。
[1]Xu G,Xiong Z,Yong Y,Wang Z,Ke Z,Xia Z,et al.Catalpol attenuates MPTPinduced neuronal degeneration of nigral-striatal dopaminergic pathway in mice through elevating glial cell derived neurotrophic factor in striatum[J].Neuroscience,2010,167(1):174-184.
[2]Bi J,Wang XB,Chen L,Hao S,An LJ,Jiang B,et al.Catalpol protects mesencephalic neurons against MPTPinduced neurotoxicity via attenuation of mitochondrial dysfunction and MAO-B activity[J].Toxicol In Vitro,2008,22(8):1883-1889.
[3]Bi J,Jiang B,Hao S,Zhang A,Dong Y,Jiang T,et al.Catalpol attenuates nitric oxide increase via ERK signaling pathways induced by rotenone in mesencephalic neurons[J].Neurochem Int,2009,54(3-4):264-270.
[4]Jiang B,Liu JH,Bao YM,An LJ.Catalpol inhibits apoptosis in hydrogen peroxide-induced PC12 cells by preventing cytochrome c release and inactivating of caspase cascade[J].Toxicon,2004,43(1):53-59.
[5]Zhang ZQ,Liu YM,Xue BQ,Wei L.Protective effects of catalpol against H2O2induced oxidative damage in astrocytes[J].China J Chin Mater Med(中国中药杂志),2009,34(15):1955-1958.
[6]Wang Z,Liu Q,Zhang R,Liu S,Xia Z,Hu Y.Catalpol ameliorates beta amyloid-induced degeneration of cholinergic neurons by elevating brain-derived neurotrophic factors[J].Neuroscience,2009,163(4):1363-1372.
[7]Zhang ZX, Roman GC, Hong Z, Wu CB,Qu QM,Huang JB,et al.Parkinson's disease in China:prevalence in Beijing,Xi'an,and Shanghai[J].Lancet,2005,365(9459):595-597.
[8]Mandel SA,Amit T,Kalfon L,Reznichenko L,Youdim MB.Targeting multiple neurodegenerative diseases etiologies with multimodal-acting green tea catechins[J].J Nutr,2008,138(8):1578S-1583S.
[9]Li X,Yang D,Li L,Peng C,Chen S,Le W.Proteasome inhibitor lactacystin disturbs the intracellular calcium homeostasis of dopamine neurons in ventral mesencephalic cultures[J].Neurochem Int,2007,50(7-8):959-965.
[10]Li X,Du Y,Fan X,Yang D,Luo G,Le W.c-Jun N-terminal kinase mediates lactacystin-induced dopamine neuron degeneration[J].J Neuropathol Exp Neurol,2008,67(10):933-944.
[11]Xie W,Li X,Li C,Zhu W,Jankovic J,Le W.Proteasome inhibition modeling nigral neuron degeneration in Parkinson's disease[J].J Neurochem,2010,115(1):188-199.
[12]Biedler JL,Roffler-Tarlov S,Schachner M,Freedman LS.Multiple neurotransmitter synthesis by human neuroblastoma cell lines and clones[J].Cancer Res,1978,38(11 Pt 1):3751-3757.
[13]Zhu HF,Wan D,Zhang F.Progress in studies of pharmacological action and mechanisms of catalpol on brain disease[J].China J Chin Mater Med(中国中药杂志),2009,34(23):2983-2986.
[14]Agid Y.Aging,disease and nerve cell death[J].Bull Acad Natl Med,1995,179(6):1193-1203.
[15]Wang ZH,He JC,Zhang CY.Effect of compound rehmannia recipe on appotosis in Parkinson's disease rats[J].J New Chin Med(新中医),2010,42(14):86-88.
[16]McNaught KS,Olanow CW.Proteolytic stress:A unifying concept for the etiopathogenesis of parkinson's[J].Ann Neurol,2003,53(3):S73-S86,
[17]Yew PR. Ubiquitin-mediated proteolysis of vertebrate G1-and S-phase regulators[J].J Cell Physiol,2001,187(1):1-10.

