添加外源物质对红曲霉固态发酵产酯化酶的影响
张聪芝, 葛向阳, 张伟国
(江南大学 工业生物技术教育部重点实验室,江苏 无锡,214122)
红曲霉(Monascus)属于真菌界(Eumycophyta)、子 囊 菌 门 (Ascomycetes)、 真 子 囊 菌 纲(Euascomycetes)、散子囊菌目(Eurotiales)、红曲菌科(Monascaceae)、红曲霉属(Monascus)[1]。 红曲霉用途十分广泛,在酿酒、食品、食品色素和医药等方面都有重要应用。近年来,应用红曲霉生产降血脂活性物质[2]以及应用于白酒酯化增香已成为研究的热点。白酒中各种风味香酯类物质的形成与微生物酯化酶密切相关,没有酯化酶就没有酯香浓厚的浓香型大曲酒[3]。酯化酶不是酶学上的定义,而是白酒行业的习惯称法,酯化酶是羧基酯酶 (Esterase E.C.3.1.1.2)的一种,不同于脂肪酶(Lipase,E.C.3.1.1.3),酯化酶既可以催化形成羧酯键又可以水解羧酯键[4]。
将红曲霉酯化酶应用于白酒方面的研究已有诸多报道,研究仅限于菌株选育、发酵条件优化和酯化条件等研究,考察添加外源物质对红曲霉产酯化酶影响的报道较为少见,作者探讨了添加葡萄糖、新鲜酵母培养物以及乙醇和乳酸等物质对红曲霉产酯化酶的影响。
1 材料与方法
1.1 材料
1.1.1 菌株 红曲霉HQ-3和酿酒酵母J-1均为作者所在实验室保藏菌种。
1.1.2 培养基 斜面培养基(g/L):马铃薯 200,葡萄糖 20,琼脂20,pH自然;种子培养基:同斜面培养基,不加琼脂;酒精酵母种子培养基(g/L):葡萄糖20,蛋白胨 20,酵母膏 10,pH自然;固态发酵培养基:麸皮、豆饼粉、稻壳比例为 35∶4∶6,装量 30 g/500 mL三角瓶,控制含水分质量分数为30%,其中发酵培养基的灭菌条件为:115℃,灭菌10 min;其余均为121℃,灭菌20 min。
1.2 方法
1.2.1 酵母培养物制备 酿酒酵母种子培养基的装液量为50 mL/500 mL三角瓶。刮一环新鲜酵母于酵母种子培养基中,31℃摇床培养,摇床转速为100 r/min,定时进行菌落计数,细胞浓度达到108个/mL,停止培养,4℃保存备用。
将培养好的酿酒酵母离心,上清液既为酵母滤液,无菌水洗涤菌体后获得酵母菌体,将部分酵母菌体超声破碎30 min然后高速离心所得上清液为酵母破壁液。
1.2.2 粗酶制剂制备 将培养到对数期的种子液接种到固态发酵培养基,34℃培养4 d,发酵结束室温风干12 h,即为红曲粗酶制剂。
1.2.3 酯化力测定 采用传统标准酯化力测定方法[5-7]在250 mL圆底烧瓶中,加5 g红曲粉试样,精确到1 mg。100 mL体积分数1%己酸的乙醇溶液于32℃酯化100 h。酯化结束后,加入蒸馏水50 mL,缓火蒸馏出100 mL馏出液。量取50 mL馏出液于250 mL三角瓶中,用NaOH(0.1 mol/L)中和后再加入25 mL NaOH (0.1 mol/L),冷凝回流皂化30 min,皂化结束后立即冷却,用H2SO4标液 (0.05 mol/L)滴定至pH7.0。
酯化力=(C1V1-C2V2)/(m×50/V总)×144。式中:C1为 NaOH浓度 (mol/L);V1为 NaOH消耗体积(mL);C2为 H2SO4浓度(mol/L);V2为 H2SO4消耗体积(mL);V总为馏出液总体积(mL)。
2 结果与讨论
2.1 添加速效碳源对红曲霉产酯化酶的影响
在麸皮为主要营养物质的固态发酵培养基上,红曲霉要生长首先自身要产生淀粉酶、糖化酶,分解底物中的营养物质为直接利用的糖,供自身利用;彭熙敏[7]研究发现添加葡萄糖可以促进红曲霉产酯化酶酯化力。在初始培养基30 g固体物料中分别加入质量分数2%葡萄糖、2%酵母膏和2%酵母粉等考察对红曲霉产酯化酶酯化力的影响,结果发现添加葡萄糖相比另外两种物质能明显提高酯化力(如图1),分析认为添加葡萄糖作为速效碳源明显促进红曲霉的前期生长,菌丝体布满培养基,为后期产酶奠定了基础;进一步研究发现速效碳源添加量存在最佳范围(如图2),添加太少不能有效促进生长与产酶,添加太多则导致过量长菌,反而减弱产酶。
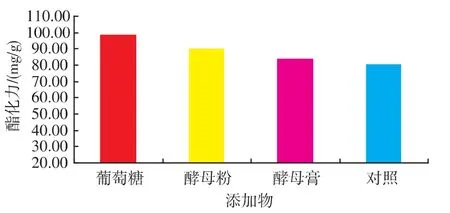
图1 添加物对红曲霉产酯化酶的影响Fig.1 Effect of glucose on esterase production by monascus
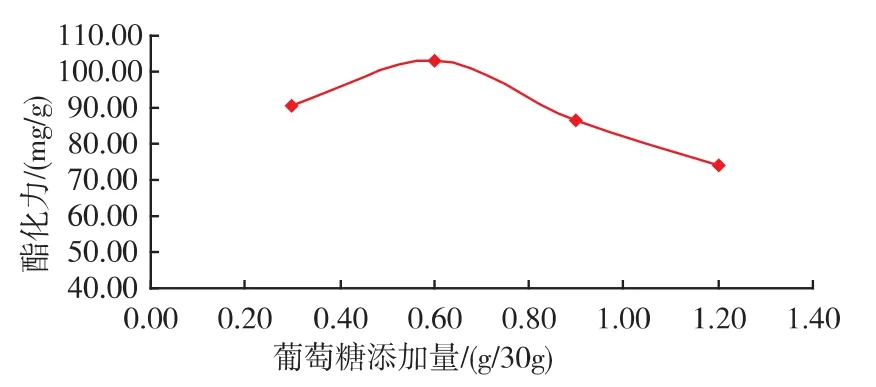
图2 葡萄糖添加量对红曲霉产酯化酶的影响Fig.2 Effect of glucose concentration on esterase production by monascus
2.2 新鲜酵母培养物对红曲霉产酯化酶的影响
2.2.1 不同新鲜酵母培养物的影响 在2.1实验中发现酵母粉与酵母膏并不能明显促进红曲霉产酯化酶酯化力;赵树欣[8]等研究发现新鲜酵母培养物能促进红曲霉菌体的生长,促进代谢产物的产生。在发酵培养36 h后添加不同的新鲜酵母培养物2 mL发现酯化力有显著提高 (如图3),相比酵母滤液、酵母菌体与酵母破壁液对酯化力的提高相对较高,Shin[9]等人研究认为新鲜酵母培养物中存在壳聚糖酶,壳聚糖酶能分解红曲霉细胞壁,影响菌体形态,可以促进菌体量的增加;新鲜酵母培养物中存在诱导因子,促进红曲霉生长及代谢活动。进一步分析认为壳聚糖酶能部分分解红曲霉细胞壁,有利于胞内酯化酶的向外分泌,促进酯化力的提高。结果表明酵母菌体与酵母破壁液促进了酯化力的提高,酯化力分别是对照组的1.29倍、1.30倍。酵母菌体的这种诱导作用,可以将红曲霉与酵母混菌发酵产酯化酶,促进酯化力的提高,制成多菌种混合强化大曲,不仅可以提高酯化力还可以提高酒精产率;酵母破壁液的这种诱导作用,可以将啤酒废酵母加以利用,为啤酒行业废酵母处理提供了新途径,可以将啤酒行业与白酒行业联系起来,促进资源优化配置。
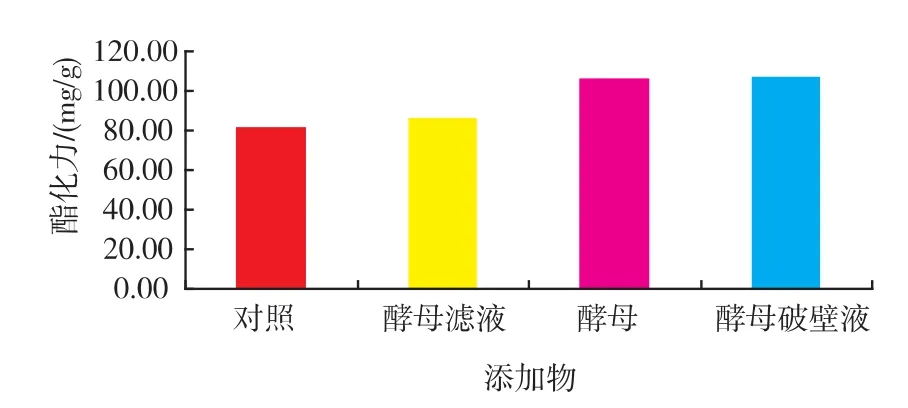
图3 添加物对红曲霉产酯化酶的影响Fig.3 Effect of fresh yeast lysate on esterase production by monascus
2.2.2 新鲜酵母破壁液添加时间的影响 分别在接种培养0、1、2、3 d后添加酵母破壁液,发酵4 d后测定培养物的酯化力,结果表明在发酵1 d时添加酵母破壁液的酯化力最高达到97.67 mg/g(如图4),这说明在菌体初始生长阶段添加诱导物能有效提高红曲霉产酯化酶活力,分析认为在菌丝体生长到一定阶段,诱导剂才能对菌体产生影响,添加太早菌丝体生长没有完成,诱导作用微弱,添加太晚菌丝体老化,诱导作用不大。
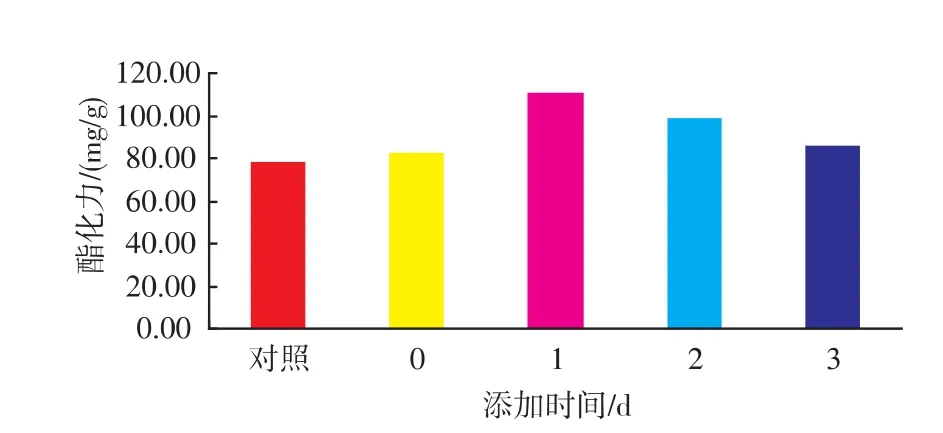
图4 不同时间添加酵母破壁液对红曲霉产酯化酶的影响Fig.4 Effect of the time of add fresh yeast lysate on esterase production by monascus
2.2.3 新鲜酵母破壁液添加量的影响 发酵培养基在接种发酵1 d后分别添加不同量的新鲜酵母破壁液,发酵4 d后测定酯化力,结果表明(如图5)不同添加量对红曲霉产酯化酶酯化力的提高程度不同,添加1 mL/30 g固体物料时对酯化力的提高最为显著,超过1 mL对酯化力的提高有所降低,分析认为酵母破壁液的诱导作用有一定的范围,在一定范围内可以有效提高酯化酶活力,超过或低于这个范围,诱导作用不明显,另外添加量的增加,将直接影响固态发酵培养基的水分含量,由于酯化酶在低水活度的条件下产酶活力和酯化力较高,水活度的提高对酯化力的增加有一定影响,但这样就容易产生浮水现象,容易感染细菌,影响产酶能力。
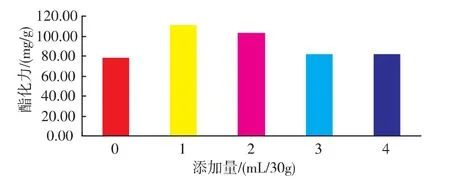
图5 不同酵母破壁液添加量对红曲霉产酯化酶的影响Fig.5 Effect of fresh yeast lysate concentration on esterase production by monascus
2.3 添加底物类物质对红曲霉产酯化酶的影响
许多研究报道表明,油脂类物质可以促进霉菌菌体生长并且促进产酶,大多数的酯化酶属于诱导型酶,Shimada[10]等人研究发现长链脂肪酸可以促进脂肪酶的表达;与此同时潘运国[11]研究发现橄榄油在促进根酶产酯化酶方面也有一定作用。据报道表面活性剂等相关物质也具有相似的作用。在发酵培养基中添加0.5 mL/30 g相关类物质,接种发酵4 d后测定酯化力,结果(如图6)表明橄榄油与大豆油对产酶有一定促进作用,其中大豆油相比橄榄油效果要好,这与其他研究报道并不相同;表面活性剂吐温-80对产酶促进作用明显,而甘油则有一定抑制作用[12]。分析认为一方面酯化酶催化酯合成是可逆的,油脂类物质作为底物可以诱导促进酯化酶酶量的增加;另一方面脂肪酸类物质与表面活性剂可以与菌体细胞膜发生相关作用,对细胞膜的通透性有一定作用,从而有利于胞内酯化酶的向外分泌,促进酯化酶的生成[13]。底物己酸在促进产酶方面也具有一定作用,但是效果不显著,可能是对己酸耐受性较差,不能有效促进酯化力的提高;相比而言乙醇与乳酸的加入对酯化力的提高有较明显作用,这与乙醇可以促进菌体生长,红曲霉嗜乳酸能以乳酸为碳源相关,该发现与唐玉明[14]的报道相似,红曲霉的这种作用可以研究与乳酸菌共生提高产酯化酶的能力。
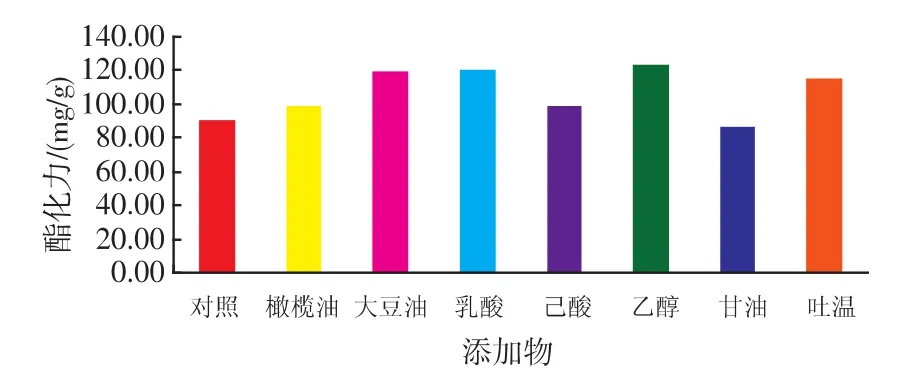
图6 添加物对红曲霉产酯化酶的影响Fig.6 Effect of substrateon esteraseproduction by monascus
3 结语
实验结果表明:葡萄糖作为速效碳源,对红曲霉的初期生长具有一定作用,促进菌丝体大量积累为后期产酶奠定基础,使酯化力提高到对照组的1.20倍达到98.65 mg/g;添加新鲜酵母培养物对酯化力的提高有显著作用,其中酵母破壁液的作用最为明显,发酵4 d后酯化力是对照组的1.30倍达到106.87 mg/g,进一步实验确定了最佳添加时间为发酵24 h后添加,最佳添加量为1 mL/30 g(以固体物料计),酵母破壁液的这种诱导作用为啤酒废酵母利用提供了新的途径;添加底物类物质对红曲霉产酯化酶酯化力的提高效果显著,其中大豆油效果较好是对照组的1.36倍达到119.21 mg/g,乙醇与乳酸的加入对酯化酶酯化力的提高作用相当明显,添加乙醇使酯化力提高到123.32 mg/g。
[1]李钟庆,郭芳.红曲霉的形态与分类[M].北京:中国轻工业出版社,2003.
[2]邢旺兴,程荣珍.几种常见红曲霉的生理学特性研究[J].药学实践杂志,2001,19(4):231-234.XING Wang-xing,CHENG Rong-zhen.Study on the physiological characteristics of seven ordinary Monascus[J].The Journal of Pharmaceutical Practice,2001,19(4):231-234.(in Chinese)
[3]杜礼泉,唐聪,古加强,等.红曲霉酯酶酯化特性的探讨[J].中国酿造,2005(1):23-24.DU Li-quan,TANG Cong,GU Jia-qing,et al.Exploration to the esterification property of esterase produced by Monascus spp.[J].China Brewing,2005(1):23-24.(in Chinese)
[4]王耀,范文来,徐岩,等.浓香型大曲中酯化酶测定方法的研究[J].酿酒,2003,(30):18-20.WANG Yao,FAN Wen-lai,XU Yan,et al.Study on the determination method about the esterifying enzymes from DaQu of Chinese Strong Flavour Liquor Making[J].Liquor Making,2003,(30):18-20.(in Chinese)
[5]施安辉,杨军方,徐海燕,等.红曲霉的生物学特性、酯酶培养技术及质量鉴定[J].中国调味品,2006,(7):25-28.SHI An-hui,YANG Jun-fang,XU Hai-yan,et al.Biology characteristics of nonascus and culture technology of esterifying enzymes and qual ity identification[J].China Condiment,2006,(7):25-28.(in Chinese)
[6]徐希望,王剑方,夏培禹,等.大曲酯化力的测定方法探讨[J].酿酒,2005,(6):69-70.XU Xi-wang,WANG Jian-fang,XIA Pei-yu,et al.The discussion of the measurement method of Daqu esterification force[J].Liquor Making,2005,(6):69-70.(in Chinese)
[7]彭熙敏,黄著,刘超兰,等.红曲霉培养条件对酯化力影响的研究[J].酿酒科技,2009,(1):17-20.PENG Xi-min,HUANG Zhu,LIU Lan-Chao,et al.Study on the effects of monascus culture conditions on the esterifying capacity of fatty acid ester[J].Liquor-Making Science ﹠ Technology,2009,(1):17-20.(in Chinese)
[8]赵树欣,汤卫华,乔长晟.添加酵母破壁液提高红曲霉Monacolin K产率[J].食品科学,2004(25):119-121.ZHAO Shu-xin,TANG Wei-hua,QIAO Chang-sheng.Enhanced monacolin K production of Monascus rubber by adding yeast lysate[J].Food Science,2004(25):119-121.(in Chinese)
[9]Shin C S,Kim M J,Ju J Y.Morphological change and enhanced pigment production of monascus when concultured with Saccharomyces cerevisiae or Aspergillus oryzae[J].Biotechnol Bioeng,1998,59:576-581.
[10]Shimada Y,Sugihara A,Nagao T et al.Induction of Geotrichum candidum lipase by long-chain fatty acids[J].Joumal of fermentation and bioengineering,1992,74(2):77-80.
[11]潘运国,陈义伦,张策,等.霉菌液态培养产酯化酶规律研究[J].酿酒科技,2005,11:35-37.PAN Yun-guo,CHEN Yi-lun,ZHANG Ce,et al.Study on the production rules of esterified enzyme by mould liquid culture[J].Liquor-Making Science ﹠ Technology,2005,11:35-37.(in Chinese)
[12]刘志钰,张东旭,堵国成,等.Paecilomyces sp.S152 胞外漆酶的合成调控[J].食品与生物技术学报,2010,29(6):952-957.LIU Zhi-Yu,ZHANG Dong-Xu,DU Guo-cheng,et al.Improvement of extracellular laccase production by Paecilomyces sp.S152[J].Journal of Food Science and Biotechnology,2010,29(6):952-957.(in Chinese)
[13]Hama S,Yamaji H,Kaieda M,et a1.Effect of fatty acid membrane composition on whole-cell biocatalysts for biodiesel-fuel production[J].Biochemical Engineering Journal,2004,(21):155-160.
[14]唐玉明,刘宇驰,卓毓崇.红曲酯化菌21-3选育及特性研究[J].酿酒科技,2005(8):32-34.TANG Yu-ming,LIU Yu-chi,ZHUO Yu-chong.Reseach on the properties and breeding of Monascus Esterifying Strain 21-3(Monascus Pilosus)[J].Liquor-Making Science ﹠ Technology,2005(8):32-34.(in Chinese)

