应用新型复合保护剂制备高活性直投式干酪乳杆菌发酵剂
张 娟 , 刘 茜 , 吴重德 , 堵国成 , 陈 坚
(1.食品科学与技术国家重点实验室 江南大学,江苏 无锡 214122;2.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;3.江南大学 生物工程学院,江苏 无锡 214122;4.四川大学 轻纺与食品学院,四川 成都610065)
由于乳酸菌本身对外界环境的耐受能力较差,在生产加工及储藏运输环节所面临的不利条件往往导致乳酸菌活性的迅速下降,从而严重影响了乳酸菌的功能。为保证乳酸菌发酵剂的活性,提高乳酸菌制剂的应用效能,目前国内外在乳酸菌的制剂化研究中通常采用直投式冷冻干燥的制备方法,并以真空冷冻干燥法的制备效果最为理想[1-3]。然而,在应用真空冷冻干燥法进行乳酸菌制剂化处理的同时,该处理过程中的低温、脱水等加工条件将对乳酸菌的活性产生难以避免的损伤。因此,选择理想的冷冻干燥保护剂维持该处理过程中细胞的活性成为应用真空冷冻干燥法进行制剂化研究中备受关注的热点问题。
目前,对冷冻干燥保护剂的研究与应用主要分为以下几类:①糖/多元醇类:如单糖(葡萄糖、果糖等)、低聚糖(蔗糖、乳糖、麦芽糖、海藻糖等)、多元醇(甘露醇、甘油、山梨醇)等;②聚合物类:如胶类(阿拉伯胶、卡拉胶、动物胶等)、可溶性淀粉等;③蛋白类:如脱脂乳、血清蛋白等;④表面活性剂、氨基酸类:如L-脯氨酸、谷氨酸钠等[4]。此外,细胞在冷冻干燥处理过程中的生理状态也受到研究人员的日益关注。虽然目前尚无直接方法证明冷冻干燥对乳酸菌胞内环境的影响,然而已有关于过氧化氢酶、脂酶、乳酸脱氢酶等对冷冻干燥处理过程较为敏感的相关报道[5],从而为揭示该过程中细胞内氧化还原状态的变化提供了有力证据。
谷胱甘肽(glutathione)是由 L-谷氨酸、L-半胱氨酸和甘氨酸经过肽键缩合形成的三肽化合物。还原型谷胱甘肽(GSH)对维持细胞正常的氧化还原状态具有重要作用,能够清除体内自由基,保护DNA、蛋白质和其它生物分子抵抗氧化环境的侵害。
基于上述情况,作者以具有优良益生功能的乳酸菌菌株Lactobacillus casei Zhang为研究对象,结合冷冻干燥发酵剂制备过程中细胞自身的生理特征,通过新型复合冷冻干燥保护剂的研究提高乳酸菌直投式发酵剂的生理活性及其应用性能。
1 材料与方法
1.1 主要试剂与仪器
1.1.1 试剂 葡萄糖、乳糖、蔗糖、甘露醇、甘油、抗坏血酸、氯化钠、无水氯化钙、海藻酸钠、磷酸氢二钠、氯化钠:国产分析纯试剂;麦芽糖、海藻糖、山梨醇、谷氨酸钠:国产化学纯试剂;均购自中国医药(集团)上海化学试剂公司。
脱脂奶粉:购自伊利公司;谷胱甘肽:购自上海生工生物工程技术服务有限公司。
1.1.2 主要仪器设备
真空冷冻干燥机 (4K XL):Virtis公司产品;冷冻立式离心机(CF16RX):日本Hitachi公司产品;小型高速离心机(5418):Eppendorf公司产品;临界点干燥仪(CPD-030):BAL-TEC公司产品;离子溅射仪(SCD-005):BAL-TEC 公司产品;扫描电子显微镜(QUANTA-200):FEI公司产品。
1.2 菌株
干酪乳杆菌(Lactobacillus casei Zhang,以下简称L.casei Zhang),由内蒙古农业大学乳品生物技术与工程教育部重点实验室惠赠。
1.3 培养基与培养条件
1.3.1 培养基 Lactobacilli MRS肉汤培养基:购自Oxoid公司。每升培养基所含成分为:蛋白胨10.0 g,葡萄糖20.0 g,酵母提取物4.0 g,肉汁粉8.0 g,山梨糖醇酐单油酸酯1 mL,七水硫酸镁0.2 g,四水硫酸锰0.05 g,三水醋酸钠5.0 g,磷酸氢二钾2.0 g,柠檬酸铵2.0 g,pH值 6.2±0.2。生长培养基为MRS肉汤液体培养基;计数培养基为MRS肉汤培养基加入1.2%琼脂粉。
1.3.2 培养条件 取保藏于-70℃冰箱的L.casei Zhang液体甘油管,以无菌操作方式按体积分数5%接种量接种于100 mL MRS液体培养基中,37℃静置培养20 h。
1.4 菌体细胞的冷冻干燥法制备
离心收集活化培养后的菌体细胞(10 000 g,10 min),经生理盐水洗涤两次并离心浓缩5倍后,加入保护剂溶液(菌悬液、保护剂体积比为1∶3)。计算初始活菌数(cfu/mL)后分装进行冰箱预冻(-70℃,12 h)。 经冷冻干燥机冻干后 (-60℃,6.67 Pa,30 h),进行复水处理并计算活菌数(cfu/mL)。
1.5 冷冻干燥保护剂的制备
1.5.1 单一冷冻干燥保护剂的制备 选取葡萄糖、蔗糖、麦芽糖、海藻糖、山梨醇、甘露醇、甘油、脱脂奶粉、抗坏血酸和谷胱甘肽作为保护剂,与离心后的菌泥混合,预冻后进行冷冻干燥处理。冷冻干燥保护剂的选取如表1所示。
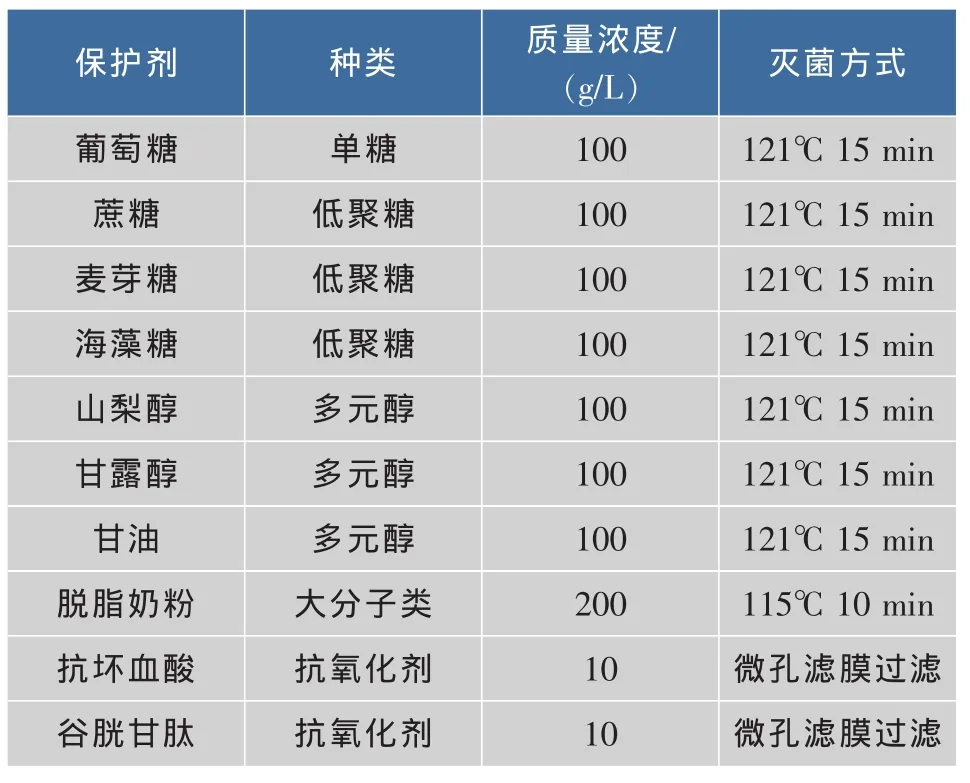
表1 不同单一冷冻干燥保护剂的制备Tab.1 Preparation of different mono-cryoprotectants
1.5.2 复合冷冻干燥保护剂的筛选 选择单因素优化后的冷冻干燥保护剂及其相应浓度,应用7因素二次旋转正交组合设计完善L.casei Zhang保护剂保护模型,实验方案如表2所示。
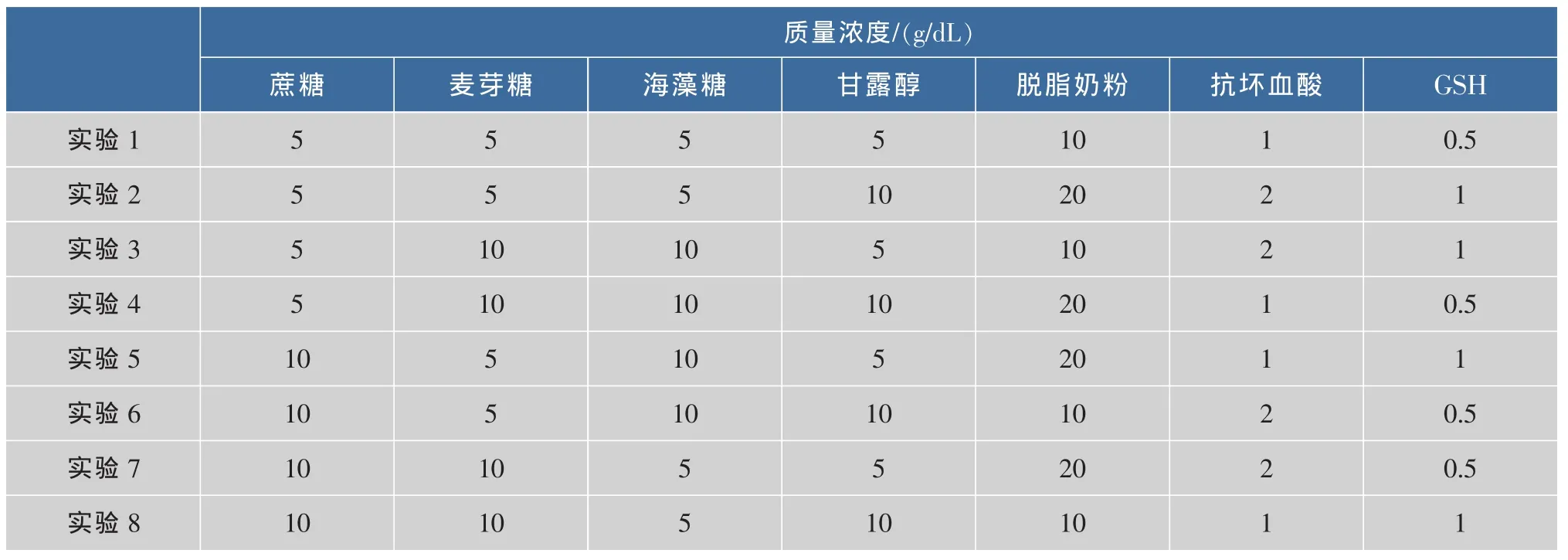
表2 复合冷冻干燥保护剂的筛选Tab.2 Design of multiple cryoprotectants for L.casei Zhang
1.6 存活率的测定
冷冻干燥处理后的菌体干粉加入冻干处理前等体积的生理盐水(0.85 g/dL NaCl)复水后,取10 μL重悬液,以不同的稀释度点种于MRS培养基平板上测定单位体积菌落数 (colony forming unit per unit,cfu/mL)。将平板放置在 37℃下培养 36 h,对平板上的菌落进行计数。每个实验样本设3个平行样。应用Excel软件计算存活率平均值和标准偏差。计算存活率时,考虑了误差的传递。

V1为冷冻干燥处理前的活菌数(l mL液体样的活菌数,cfu/mL);V2为冷冻干燥处理后的活菌数(l mL液体样冻干后的活菌数,cfu/mL)。
误差传递公式:
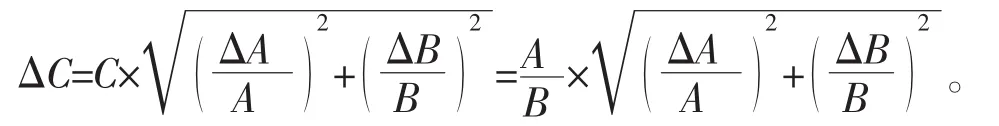
A为冻干后的菌落数(cfu/mL);△A为冻干后的误差(cfu/mL);B 为对照的菌落数(cfu/mL);△B 为对照的误差(cfu/mL);C 为存活率(%);△C 为存活率误差(%)]。
1.7 细胞膜脂肪酸成分的测定
细胞膜脂肪酸样品的制备按照Sasser的方法进行[6]。
气相色谱分析条件:PEG毛细管填充柱(30 m×0.22 mm,0.25 μm,Restek);载气:氦气;流量:29.6 mL/min;柱压:63.4 kPa;柱流量:0.5 mL/min;进样口温度:260 °C;检测器温度:280 °C;柱温升温程序:起始温度为100°C,保持1 min,随后以4°C mL/min的速率增至250°C并在250°C保持5 min。每个样本设定3个平行样。
1.8 扫描电镜样品的制备
将经过包埋处理的样品于4℃下用体积分数3%戊二醛固定,固定后用0.1 mol/L磷酸缓冲液漂洗数次,再次用质量分数1%四氧化锇固定,用0.1 mol/L磷酸缓冲液漂洗数次后,经乙醇体积分数梯度脱水(30%、50%、70%),在醋酸异戊酯过渡后放入临界点干燥仪 (CPD-030),干燥后经离子溅射(SCD-005),最终通过QUANTA-200扫描电镜观察并拍摄电镜照片。
2 结果
2.1 使用不同单一保护剂对提高乳酸菌冷冻干燥存活率的比较
冷冻干燥成功的关键在于有效保护剂的使用,冻干保护剂不仅影响乳酸菌在冻干过程中的细胞存活率,还将影响保藏期间的细胞稳定性[7]。为考察最佳的单一冷冻干燥保护剂,通过前期的预备实验确定了L.casei Zhang的最佳收获时间为稳定前期,结合相关资料选取葡萄糖、麦芽糖、海藻糖、山梨醇、脱脂奶粉,抗坏血酸、谷胱甘肽考察了单一保护剂对L.casei Zhang冷冻干燥处理过程的保护作用,研究结果如图1所示。
由图1可知,脱脂奶粉作为单一保护剂时菌体细胞经冷冻干燥处理后的存活率最高,约为以生理盐水为对照时的5.56倍。作为大分子类保护剂的代表,脱脂奶粉的作用主要通过乳清蛋白在菌体外形成蛋白膜,对细胞加以保护,并可以固定冻干的酶类,防止由于细胞壁蛋白质损伤而引起的胞内物质渗漏;同时,乳中其它成分(如乳糖等)也可提高菌体细胞的冻干存活率[8]。

图1 L.casei Zhang单一保护剂效果Fig.1 Survival of freeze-dried L.casei Zhang
作为传统的冷冻干燥保护剂,糖类与多元醇类的保护作用如图1所示。添加糖类作为保护剂后,菌体存活率与对照样本相比均有一定程度的上升,其中以海藻糖的保护作用最为显著,与对照相比,L.casei Zhang细胞的存活率提高了3.42倍。对实验结果进行分析可知,糖类保护剂的作用效果由强到弱依次为海藻糖、麦芽糖和葡萄糖,这恰好与它们玻璃态转变温度由高到低的顺序一致[9],而玻璃态转变温度能够有效地防止水对玻璃态的增塑作用[10],从而进一步削弱冷冻干燥过程中由于处理工艺条件造成的细胞结构损伤。
与糖类似,多元醇的官能团也是羟基,因此可以在冷冻干燥过程中发挥保护作用,取代水分子与菌体细胞膜磷脂中的磷酸基团或与菌体蛋白质极性基团形成氢键,保护细胞膜和蛋白质结构与功能的完整性。在前期的预备实验中,考察了山梨醇、甘露醇和甘油对细胞存活率的影响,其中山梨醇的保护效果相对于另两种保护剂较好(数据未给出),因此,选择适当浓度的山梨醇与其他类型的保护剂进行了比较。由图1可知,山梨醇在保护L.casei Zhang时相对空白样本的存活率提高了2.02倍,其作用效果可能与其在慢速结晶过程中形成结晶,从而为细胞内的活性组分提供支撑结构有关[11]。
值得关注的是,抗氧化剂GSH在冷冻干燥过程中也表现出较为显著的保护作用。经GSH保护下的L.casei Zhang细胞存活率与对照样本相比提高了5.42倍,显著高于传统的糖/醇类冷冻干燥保护剂。
2.2 不同保护剂复配对提高乳酸菌冷冻干燥存活率的比较
菌体细胞在冻干过程中受到的损伤是多方面的,而各种类型的冻干保护剂的保护作用机制也存在差异,为获得更优化的冷冻干燥保护效果,进一步开展了不同保护剂的混合添加研究。基于单一冻干保护剂筛选的研究结果,以脱脂乳作为冻干保护剂基础介质,与之协同作用的保护剂种类及相关保护效果如图2所示。
由图2可知,当使用以20 g/dL脱脂奶粉为基质的复合保护剂时,经冻干处理的细胞活力与单一保护剂相比均呈现增加态势。在上述冷冻干燥保护剂中,GSH的保护效果最为显著。保护剂按照保护作用的方式分为渗透型和非渗透型[12]。渗透型以低分子化合物为代表,在冷冻干燥过程中能够进入细胞,结合水分子发生水合反应,使溶液的粘度增加,从而减缓冰晶形成速度,降低系统因水转化为冰所造成的细胞损伤;高分子化合物则能够在冻干过程中降低溶液结冰的速度,降低细胞外的溶质浓度,避免由于盐类浓缩而引起的细胞脱水,从而减少细胞发生渗透压性休克、细胞壁和细胞膜塌陷、蛋白质变性等不良后果[13]。在本研究中,通过冷冻干燥过程中低分子保护剂与高分子保护剂的结合,显示出较好的保护作用效果。
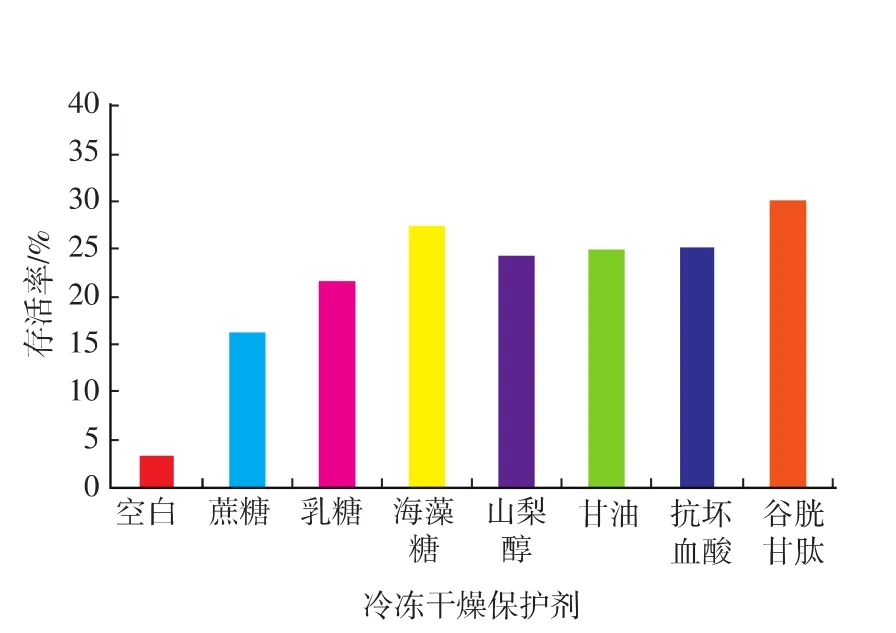
图2 以脱脂乳为基质的混合保护剂作用效果Fig.2 Survivaloffreeze-driedL.caseiZhang
2.3 优化复合保护剂提高乳酸菌冷冻干燥存活率
在上述研究的基础上,为获得理想的冷冻干燥保护效果,对不同类型的冷冻干燥保护剂进行了正交实验分析。分别选取蔗糖、麦芽糖、海藻糖、山梨醇、脱脂奶粉、抗坏血酸及谷胱甘肽进行复合保护剂的优化,实验结果分析见表3。
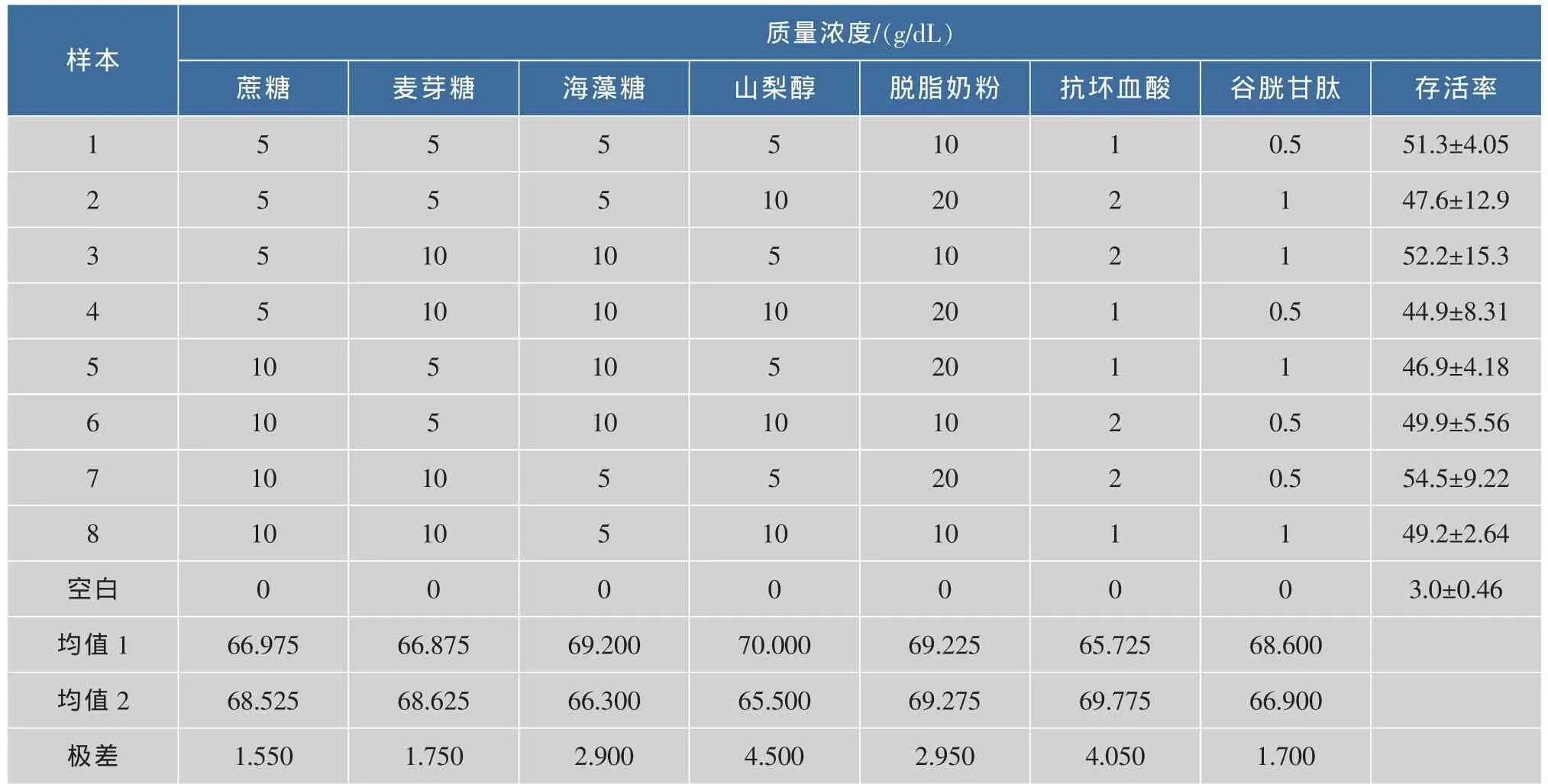
表3 L.casei Zhang正交设计数据及结果aTab.3 Orthogonal experiment of L.casei Zhanga
表3显示,在L.casei Zhang进行正交复配保护剂实验时(质量分数),蔗糖10%、麦芽糖10%、海藻糖5%、山梨醇5%、脱脂奶粉20%、抗坏血酸2%、谷胱甘肽0.5%为最佳保护剂组合,细胞存活率可达54.5%。
2.4 新型冷冻干燥保护剂谷胱甘肽对细胞膜流动性的影响
细胞膜作为细胞抵抗恶劣环境的第一道屏障,伴随着环境的变化,细胞膜组成结构往往发生一定范围的变化。尤其是细胞膜脂肪酸成分的变化将直接导致细胞的流动性变化,进而对细胞产生严重影响,甚至导致细胞死亡。随着对乳酸菌发酵剂研究的不断深入,冷冻干燥过程中细胞微环境的变化也受到越来越多的关注。
通过考察细胞膜脂肪酸的变化,如不饱和脂肪酸含量变化和细胞膜脂肪酸链长变化,能够反应细胞在冷冻干燥过程中流动性的变化过程,从而为揭示冷冻干燥过程中保护剂的作用机制提供可借鉴的思路。如表 4 所示,肉豆蔻酸(C14∶0)、十五烷酸(C15∶0)、棕 榈 酸 (C16∶0)、 十 七 烷 酸 (C17∶0)、硬 脂 酸(C18∶0)、油酸 (C18∶1-9)、 十八碳烯酸(C18∶1-11)、亚油酸(C18∶2)和 环 丙烷 脂 肪 酸 (C19∶0-9)分 别 是 L.casei Zhang细胞膜脂肪酸的主要组成部分。在冷冻干燥过程中细胞膜脂肪酸成分发生了明显变化。未添加谷胱甘肽作为保护剂时,饱和脂肪酸(C14∶0,C15∶0,C16∶0,C17∶0,C18∶0)占 所 有 脂 肪 酸 的 比 例 从 45.1%上 升 到72.2%, 同时不饱和脂肪酸 (C18∶1w7,C18∶1w9,C18∶2and C19∶0-9)占所有脂肪酸的比例有明显下降,从54.9%降至27.8%。细胞膜脂肪酸饱和度的变化可能直接影响细胞膜的流动性[14],进而能够反映出细胞在抵抗环境压力时的变化[15]。上述脂肪酸成分的变化表明,在冷冻干燥过程中,细胞膜脂肪酸中含有双键的不饱和脂肪酸大多被氧化,这将会导致细胞膜流动性发生显著变化,进而造成细胞在该过程中的死亡[16]。
有趣的是,在添加谷胱甘肽作为冷冻干燥保护剂后,细胞膜脂肪酸不饱和度(即U/S值)为0.79,是对照样本的2.02倍。与对照样本相比,这一明显上升的细胞膜脂肪酸不饱和度反映了在冷冻干燥过程中,谷胱甘肽能够有效地维持冷冻干燥过程中细胞膜的氧化还原平衡状态,进而保持细胞膜的流动性,减少细胞因冷冻干燥处理造成的活性下降甚至死亡[17-18]。

表4 冷冻干燥前后细胞膜脂肪酸组成与链长的变化aTab.4 Composition and chain length of membrane fatty acids during freeze-drying treatmenta
对不同类型的脂肪酸而言,脂肪酸中双键和环状结构的增加能较好地提高细胞膜的不饱和度[19]。在添加谷胱甘肽的情况下,检测到具有提高细胞膜弹性和流动性的环丙烷脂肪酸 (ΔC19:0-9)的出现[20],而未添加谷胱甘肽的样本则未在脂肪酸组分中检测到环丙烷脂肪酸。此外,进一步研究发现,谷胱甘肽作为冷冻干燥保护剂在保护细胞的同时减少了饱和脂肪酸的链长,这一变化有利于维持细胞膜的流动性。如表4所式,对照样本的饱和脂肪酸链长在经过冷冻干燥后为17.1,而谷胱甘肽参与下,其值下降到16.0。因此推测,谷胱甘肽在乳酸菌细胞冷冻干燥过程中的保护原理与其抵抗冷冻干燥处理诱发的细胞膜脂肪酸氧化,维持细胞膜的流动性具有密切的关系。
2.5 新型冷冻干燥保护剂谷胱甘肽对细胞形态结构的影响
细胞结构的完整性是影响细胞活性的另一重要因素[21-23]。菌体细胞在冷冻干燥过程中往往会出现结构塌陷等情况[21]。将未添加冷冻干燥保护剂与添加谷胱甘肽作为冷冻干燥保护剂的细胞冻干粉通过扫描电镜进行观察。如图3所示,在谷胱甘肽存在的情况下细胞形态较完整,并没有出现因细胞膜破裂而导致的胞内物质外溢(图 3(a),(c));而未添加保护剂的细胞在经过冷冻干燥处理后,细胞结构被破坏,细胞表面粗糙甚至细胞破裂的情况(图3(b),(d))。
3 结语
在应用高效冷冻干燥保护剂制备直投式乳酸菌的研究中,采用单一型、复合型与正交复配保护剂对冷冻干燥保护剂的优化策略进行了研究。结果表明,以传统冷冻干燥保护剂为基础组分,通过添加新型冻干保护剂谷胱甘肽能够显著增强细胞经冷冻干燥处理的存活率。进一步分析表明,谷胱甘肽通过增加冷冻干燥过程中细胞膜脂肪酸的不饱和度以及缩短膜脂肪酸链长等方式增强了细胞膜的流动性,从而有效地维持了冷冻干燥过程中细胞膜结构的完整性。上述研究结果对基于微生物细胞在冷冻干燥过程中的生理状态变化,开拓新型高效的冻干保护剂提供了可借鉴的思路。

图3 冷冻干燥后细胞形态Fig.3 Morphological changes of L.casei Zhang during freeze drying
[1]Fuller R.Probiotics in man and animals[J].J Appl Microbiol,1989,66,365-378.
[2]Duan X,Zhang M,Mujumdar A S,et al.Trends in microwave-assisted freeze drying of foods[J].Drying Technol,2010,28(4):444-453.
[3]Santivarangkna C,Kulozik U,Foerst P.Alternative drying processes for the industrial preservation of lactic acid starter cultures[J].Biotechnol Progress,2007,23(2):302-315.
[4]Tedeschi R,De Paoli P.Collection and preservation of frozen microorganisms[J].Methods Mol Biol,2011,675:313-326.
[5]Castro HP,Teixeira PM,Kirby R.Changes in the cell membrane of Lactobacillus bulgaricus during storage following freezedrying[J].Biotechnol Lett,1996,18(1):99-104.
[6]Montanari C,Sado Kamdem SL,Serrazanetti DI,et al.Synthesis of cyclopropane fatty acids in Lactobacillus helveticus and Lactobacillus sanfranciscensis and their cellular fatty acids changes following short term acid and cold stresses[J].Food Microbiol,2010,27(4):493-502.
[7]Navarta L G,Calvo J,Calvente V,et al.Freezing and freeze-drying of the bacterium Rahnella aquatilis BNM 0523:study of protecting agents,rehydration media and freezing temperatures[J].Lett Appl Microbiol,2011,53(5):565-571.
[8]Otero M C,Espeche M C,Nader-Macías M E.Optimization of the freeze-drying media and survival throughout storage of freezedried Lactobacillus gasseri and Lactobacillus delbrueckii subsp.delbrueckii for veterinarian probiotic applications[J].Process Biochem,2007,42(10):1406-1411.
[9]吴克刚,钱银川.玻璃态微胶囊化技术[J].食品科学,2002,23(008):324-327.WU Ke-gang,QIAN Yin-chuan.Application in food industry of microencapsulation in glass state[J].Food Science,2002,23(8):324-327.(in Chinese)
[10]Perez-Moral N,Adnet C,Noel TR,et al.The aggregative stability of β-lactoglobulin in glassy mixtures with sucrose,trehalose and dextran[J].Eur J Pharm Biopharm,2011,78(2):264-270.
[11]Siaterlis A,Deepika G,Charalampopoulos D.Effect of culture medium and cryoprotectants on the growth and survival of probiotic lactobacilli during freeze drying[J].Lett Appl Microbiol,2009,48(3):295-301.
[12]Heylen K,Ettwig K,Hu Z,et al.Rapid and simple cryopreservation of anaerobic ammonium-oxidizing bacteria[J].Appl Environ Microbiol,2012,78(8):3010-3013.
[13]Carvalho AS,Silva J,Ho P,et al.Effects of various sugars added to growth and drying media upon thermotolerance and survival throughout storage of freeze-dried Lactobacillus delbrueckii ssp.bulgaricus[J].Biotechnol Progress,2004,20(1):248-254.
[14]Gombos Z,Wada H,Murata N.Unsaturation of fatty acids in membrane lipids enhances tolerance of the cyanobacterium Synechocystis PCC6803 to low-temperature photoinhibition[J].Proc Natl Acad Sci USA,1992,89(20):9959-9963.
[15]Beney L,Gervais P.Influence of the fluidity of the membrane on the response of microorganisms to environmental stresses[J].Appl Microbiol Biotechnology,2001,57(1):34-42.
[16]Kurtmann L,Carlsen CU,Risbo J,et al.Storage stability of freeze-dried Lactobacillus acidophilus (La-5)in relation to water activity and presence of oxygen and ascorbate[J].Cryobiology,2009,58(2):175-180.
[17]Zhu D,Damodaran S.Composition,thermotropic properties,and oxidative stability of freeze-dried and spray-dried milk fat globule membrane isolated from cheese whey[J].J Agric Food Chem,2011,59(16):8931-8938.
[18]Wu VC.A review of microbial injury and recovery methods in food[J].Food Microbiol,2008,25(6):735-744.
[19]Zhang Y M,Rock CO.Membrane lipid homeostasis in bacteria[J].Nat Rev Microbiol,2008,6:222-233.
[20]Smittle R,Gilliland S,Speck M,et al.Relationship of cellular fatty acid composition to survival of Lactobacillus bulgaricus in liquid nitrogen[J].Appl Environ Microbiol,1974,27(4):738-743.
[21]Mannazzu I,Angelozzi D,Belviso S,et al.Behaviour of Saccharomyces cerevisiae wine strains during adaptation to unfavourable conditions of fermentation on synthetic medium:cell lipid composition,membrane integrity,viability and fermentative activity[J].Int J Food Microbiol,2008,121(1):84-91.
[22]Piuri M,Sanchez-Rivas C,Ruzal S.Cell wall modifications during osmotic stress in Lactobacillus casei[J].J Appl Microbiol,2005,98(1):84-95.
[23]Sawicka JE,Robador A,Hubert C,et al.Effects of freeze-thaw cycles on anaerobic microbial processes in an Arctic intertidal mud flat[J].ISME J, 2010,4(4):585-594.

