低聚壳聚糖与木糖的美拉德反应及其衍生物抗氧化性能研究
孙 涛 , 胡冬梅 , 陈春红 , 姜志成 , 谢 晶
(1.上海海洋大学 食品学院,上海 201306;2.上海海洋大学 海洋科学研究,上海 201306)
美拉德反应是含羰基化合物(如还原糖)与氨基化合物(胺、氨基酸、肽和蛋白质)之间的复杂反应,不同的反应阶段会产生不同物质。美拉德产物含有类黑精、还原酮及一系列含N、S的杂环化合物。研究表明,这些物质具有一定的抗氧化性能,其中某些物质的抗氧化活性与食品中常用的抗氧化剂相当[1]。此外,在反应过程中还会产生一些色素和荧光物质等小分子化合物,使得体系的光吸收特征(包括紫外和可见)及荧光特征增强。
低聚壳聚糖的抗氧化作用日益受到广泛关注,由于含有大量游离氨基,壳聚糖可以作为氨基的供应体与还原糖发生美拉德反应。作者以美拉德反应作为低聚壳聚糖改性的手段,与木糖反应制得低聚壳聚糖衍生物,研究了美拉德反应的特征,考察了反应时间对低聚壳聚糖衍生物抗氧化性能的影响,为拓宽低聚壳聚糖的改性和开发天然高效的抗氧化剂提供了新思路。
1 材料与方法
1.1 原料与试剂
低聚壳聚糖,购自浙江金壳生物化学有限公司;鲁米诺:DPPH,购自Sigma公司;其余试剂均为分析纯,抗氧化测试所需溶液由二次蒸馏水配制。
1.2 主要设备和仪器
WFZ UV2000型紫外分光光度计:尤尼柯 (上海)仪器有限公司产品;970CRT荧光分光光度计,EQUNOX55傅立叶红外-拉曼光谱仪:美国NICOLE公司产品;Waters 515型凝胶色谱仪:美国Waters公司产品。
1.3 低聚壳聚糖衍生物的制备
称取壳聚糖20.0 g,加入木糖20.0 g,使得壳聚糖氨基和葡萄糖羰基的物量比为1∶1,用200 mL的二次蒸馏水完全溶解,在80℃下回流反应,考察反应过程中吸光度和荧光度的变化。醇提反应4 h和8 h的壳聚糖衍生物,检测无木糖存在,烘干得低聚壳聚糖衍生物CX4和CX8。
1.4 测试表征
红外光谱在EQUNOX55傅立叶红外-拉曼光谱仪上进行,采用KBr压片法制样,测定波数范围为 500~4 000 cm-1,分辨率为 0.8 cm-1。
产物的平均相对分子质量及其分布采用GPC法测定。GPC测试条件如下:流动相:0.1 mol/L硝酸钠水溶液;监测器:Waters 2410示差折光监测器;柱子:Ultrahygrogel 500,120串连;温度:40 ℃;标准物质为:葡聚糖。
1.5 抗氧化性能测定
1.5.1 对超氧阴离子自由基O2-的清除 浓度为1.5×10-3mol/L的鲁米诺溶液用pH=10.20的 0.05 mol/L Na2CO3-NaHCO3缓冲溶液配制,浓度为0.1 mol/L的邻苯三酚储备液用1×10-3mol/L的盐酸配制,使用前用去离子水稀释至1×10-4mol/L。以缓冲液作为溶剂,配制不同浓度的样品溶液。用流动注射化学发光分析仪依次测定从稀到浓的样品溶液,读出峰面积[2]。清除率=(A0-Ai)/A0×100%。其中 A0为空白溶液峰面积;Ai为样品溶液峰面积。经SOD,过氧化氢酶及甘露醇检测,该体系产生的自由基为超氧阴离子O2-。
1.5.2 对羟基自由基OH的清除 浓度为6.4×10-4mol/L的鲁米诺溶液、0.012 mol/L H2O2和0.8 mg/mL亚铁氰化钾溶液用pH=7.40的0.05 mol/L KH2PO4-NaOH缓冲溶液分别配制。以缓冲液作为溶剂,配制成系列不同浓度的样品溶液[2-3]。依上述流动注射化学发光分析方法测定并计算样品清除羟基自由基的活性。
1.5.3 对DPPH自由基的清除 取不同浓度的样品溶液2.0 mL,分别加入在装有2.0 mL的浓度为1×10-4mol/L DPPH无水乙醇溶液的比色管中,室温下避光静置30 min,在517 nm处测量吸光度Ai。用去离子水代替样品溶液,得吸光度A0,无水乙醇代替DPPH,得吸光度Aj。
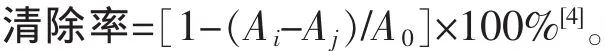
1.5.4 还原能力的测定 还原能力根据文献[5]测定并稍做改进。取2.0 mL不同浓度的样品,加入pH=6.60的0.2 mol/L磷酸缓冲液质量分数1%铁氰化钾溶液各2.5 mL,混匀,50℃水浴20 min后迅速冷却,加入2.5 mL质量分数10%三氯乙酸溶液,混匀后在3 000 r/min下离心10 min,取上清液 2.0 mL,加入2.5 mL去离子水和0.5 mL质量分数0.1%的三氯化铁溶液,静置10min后在700 nm处测定吸光度。
2 结果与分析
2.1 吸光度的变化
图1描述了低聚壳聚糖与木糖美拉德反应过程中的紫外-可见吸收光谱图。由图可知,在278 nm处,随着时间的增加,反应前2 h增幅较大,其后增加缓慢。在酸性条件下,美拉德反应易发生糖的异构和脱水,产生糠醛类物质[6]。羟甲基糠醛是美拉德反应的标示物,在280 nm左右存在特征吸收峰[7]。紫外-可见吸收在280,420 nm附近的吸收,分别代表美拉德中间产物羟甲基糠醛及褐变物质的量[8],美拉德反应过程中褐变物质在不断积累。
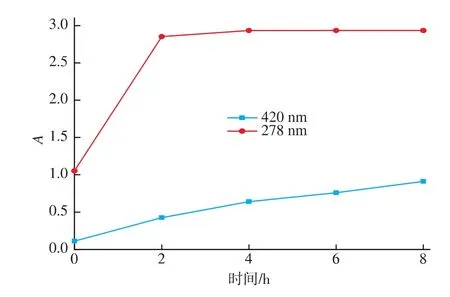
图1 UV-Vis在278和420 nm处的吸光度Fig.1 UV-Vis absorbance at 278 and 420 nm
2.2 荧光值的变化
图2描述的是在美拉德反应过程中,体系在343 nm的激发波长和435 nm发射波长下测得的荧光值变化趋势。可见,反应2 h荧光强度快速升高且达到最大值,这表明具有荧光性质的美拉德产物产生和积累。2 h后,随着反应的进行,荧光强度反而逐渐降低,说明荧光物质不断减少。荧光物质被视为美拉德反应的指示剂,因为它们灵敏地反映了美拉德反应的早期过程[9],美拉德初期产物经过脱水、裂变会产生无色的还原酮与荧光物质,此时,不饱和的羰基化合物增加,如:糠醛、脱氧邻酮醛糖等。由于产生了一些小分子化合物,这个体系的荧光特性增强。反应后期荧光物质将参与类黑素等大分子的形成,所以随着时间增加积累越来越少[9]。

图2 壳聚糖和木糖反应体系的荧光值Fig.2 Fluorescence absorbance of Maillard reaction
有一些研究指出色素与荧光化合物并不完全相同,并且荧光物质可能是色素物质的前体[10]。通常,在褐变与荧光物质形成之前有一个诱导时间,但是荧光物质形成所需的诱导时间要短些[10],所以荧光物质被认为是美拉德反应早期过程的指示剂。
2.3 低聚壳聚糖美拉德产物的结构表征
图3是低聚壳聚糖及其衍生物的红外光谱图。壳聚糖及两种衍生物在1 100 cm-1附近都有3个较强的多糖特征吸收峰,分别是1 037,1 085,1 155 cm-1,这些吸收峰都来自壳聚糖主链环状结构,可作为判定低聚壳聚糖及其衍生物存在的特征吸收峰[4]。 壳低聚糖在 1 622,1 516,1 381 cm-1附近的吸附带,分别归因于酰胺 I(C=O)、自由氨基(-NH2)和酰胺Ⅲ[11]。图中显示低聚壳聚糖美拉德衍生物在1 516 cm-1的峰较低聚壳聚糖有明显降低,表明了自由氨基的减少。
采用Waters 515型凝胶色谱仪,测得样品低聚壳聚糖的相对分子质量为5 100,美拉德反应制得的低聚壳聚糖衍生物CX4和CX8的相对分子质量分别为6 410和7 760。美拉德衍生物的相对分子质量较低聚壳聚糖都有所增加,表明壳低聚糖分子中的游离氨基酸和还原糖基团相互反应形成了更大的分子。
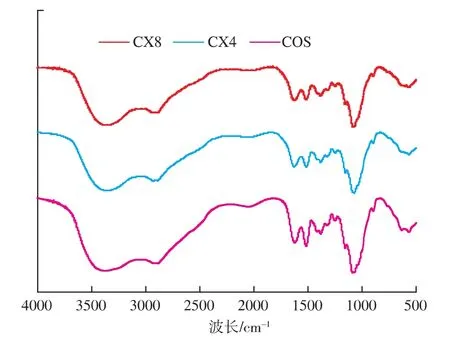
图3 低聚壳聚糖及两种衍生物的红外光谱图Fig.3 FTIR spectra of COS,CX4 and CX8
2.4 超氧阴离子自由基O2-清除
图4描述了低聚壳聚糖及其衍生物对O2-的清除效果。两种衍生物CX4和CX8对于O2-的清除能力均随着浓度而增加,其IC50(对自由基清除率为50%时所需要的自由基清除剂浓度)分别为0.155,0.125 mmol/L,而低聚壳聚糖的IC50为0.458 mmol/L,可见两种衍生物对O2-的清除能力均优于低聚壳聚糖,且CX8的抗氧化性明显优于CX4。研究表明,低聚壳聚糖对O2-的清除活性可能与其分子中的活性羟基和氨基有关[12],低聚壳聚糖作为氨基的供体与提供羰基的木糖发生美拉德反应,与低聚壳聚糖相比,其活性氨基含量下降,但其衍生物对O2-的清除能力有所提升,且反应时间较长所得的衍生物抗氧化性更好。
图4 低聚壳聚糖及其衍生物对超氧阴离子的清除能力Fig.4 Scavenging activitys of COS,CX4 and CX8 on superoxide anion
2.5 对羟基自由基OH的清除
羟基自由基OH是毒性最大的活性氧,对细胞内DNA的破坏作用很大。它可以加成至碱基双键中造成碱基破坏,从而产生突变。低聚壳聚糖及其美拉德衍生物对OH的清除活性如图5所示,其抗氧化能力强弱次序为CX8>CX4>COS。即美拉德反应的低聚壳聚糖衍生物对OH的清除活性较低聚壳聚糖均得到提升,且反应8 h所得的衍生物对OH的清除能力更强,此现象与对O2-的清除效果一致。
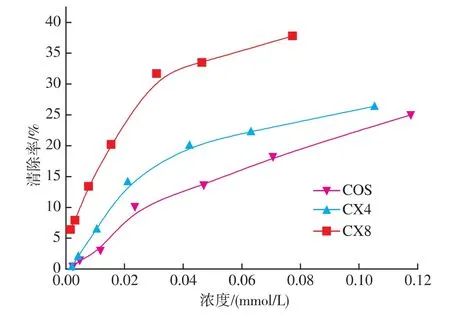
图5 低聚壳聚糖及其衍生物对羟基自由基的清除能力Fig.5 Scavenging activity of COS,CG1∶3,CG1∶1 and CG3∶1 on hydroxyl radicals
2.6 对DPPH自由基的清除
图6描述了壳聚糖及其衍生物对DPPH自由基的清除能力。由图可知,CX8与CX4的IC50分别为0.026和0.049 mmol/L,即对DPPH自由基的清除能力强弱顺序为CX8>CX4>COS。这一结果同样与对O2-和OH的清除结果相仿。
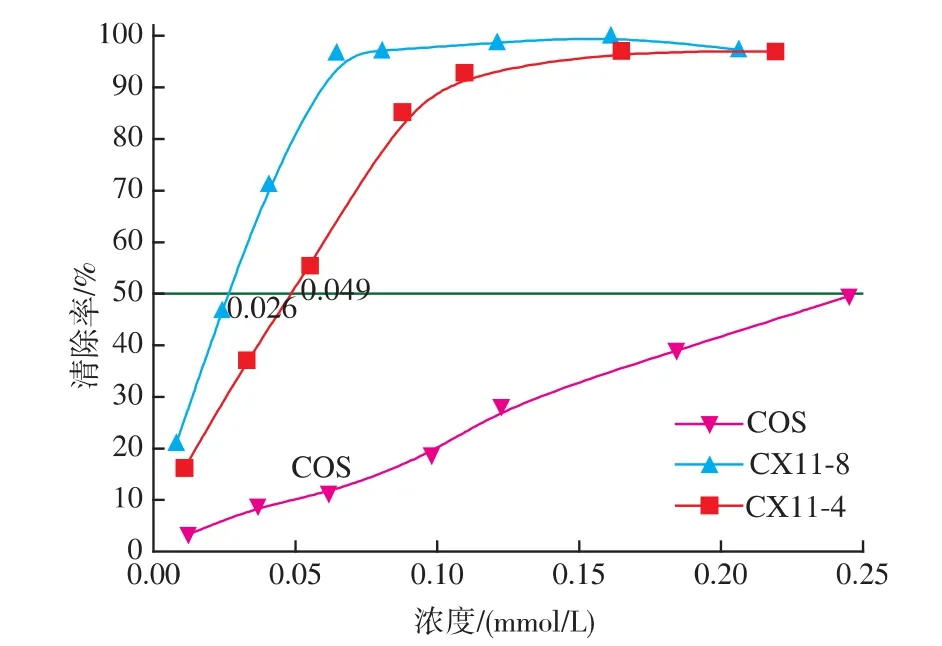
图6 低聚壳聚糖及其衍生物对DPPH的清除能力Fig.6 Scavenging activity of COS,CX4 and CX8 on DPPH radicals
2.7 还原能力的测定
还原能力是表示抗氧化物质提供电子能力的重要指标,通过提供电子,阻断了Fe2+向Fe3+的转变,从而表现出一定的还原能力。研究表明,抗氧化活性和还原能力之间存在着密切的关系[13]。如图7所示,在浓度为0.30 mmol/L时,COS、CX4和CX8的吸光度分别为0.314、1.207和1.524,还原能力强弱顺序为CX8>CX4>COS,这与前面的结果保持一致。
3 结语
以美拉德反应为低聚壳聚糖的改性手段,与木糖反应来制备低聚壳聚糖衍生物,并考察低聚壳聚糖及其衍生物对O2-、OH和DPPH的清除能力以及还原能力。结果显示,衍生物的抗氧化性均优于低聚壳聚糖,故可以认为美拉德反应是低聚壳聚糖改性的有效手段;虽然低聚壳聚糖与木糖反应的荧光强度在2 h达到最大值,其后呈下降趋势,但反应8 h的衍生物抗氧化性优于4 h的衍生物,这说明衍生物的抗氧化性与美拉德早期产物—荧光物质无直接关系,并且反应时间相对越长抗氧化性越佳,这可能与类黑素等褐变物质的积累有关,相关机理还有待进一步研究。
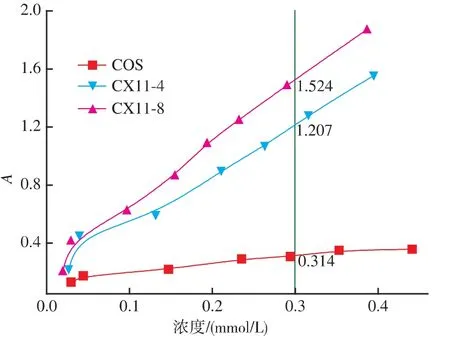
图7 低聚壳聚糖及两种美拉德衍生物的还原能力Fig.7 Reducing power of COS,CX4 and CX8
[1]Wagner K H,Derkits S,Herr M,et a1.Antioxidative potential of melanoidins isolated from a roasted glucose-glycine model[J].Food Chem,2002,78:375-382.
[2]姚倩,孙涛,徐轶霞.低聚壳聚糖衍生物的制备及其抗氧化性能[J].天然产物研究与开发,2008,20(3):530-533.YAO Qian,SUN Tao,XU Yi xia.Preparation of chitosan oligosaccharide derivatives and their antioxidant activity[J].Natural Product Research and Development,2008,20(3):530-533.(in Chinese)
[3]孙涛,银旭红,谢晶,等.取代度相同的N-酰化低聚壳聚糖清除自由基作用的研究[J].食品与生物技术学报,2010,29(3):406-409.SUN Tao,YIN Xu-hong,XIE Jing,et al.The radical scavenging effect of N-Acyl chitosan oligosaccharide[J].Journal of Food Science and Biotechnology,2010,29(3):406-409.(in Chinese)
[4]Yamaguchi T,Takamura H,Matoba T,et al.HPLC Method for evaluation of the free radical-scavenging activity of foods by using 1,1diphenyl-2-picrylhrazyl[J].Biosci Biotech Bioch,1998,62:1201.
[5]Yen G C,Chen H Y.Antioxidant activity of various tea extracts in relation to their antimutagenicity[J].J Agric Food Chem,1995,43:27-32.
[6]孙丽平,汪东风,徐莹.pH和加热时间对美拉德反应挥发性产物的影响[J].食品工业科技,2009,30(4):122-125.SUN Li-ping,WANG Dong-feng,XU Ying.Effect of pH and heating time on volatile products of Maillard reaction[J].Science and Technology of Food Industry,2009,30(4):122-125.(in Chinese)
[7]Moralew F J,Romero C,Jimenez-perez S.Chromatographic determination of bound hydroxymethylfurfural as an index of milk protein glycosylation[J].J Agric food Chem,1997,45:1570-1573.
[8]Wittayachai L,Soottawat B,Munehiko T.Characteristics and antioxidative activity of Maillard reaction products from a porcine plasma protein-glucose model system as influenced by pH[J].Food Chem,2007,100:669-677.
[9]Kim D,Petrisor I G,Yen T F.Geopolymerization of biopolymers:A preliminary inquiry[J].Carbohyd Polym,2004,56:213-217.
[10]Baisier W M,Labuza T P.Maillard browning kinetics in a liquid model system[J].J Agri Food Chem,1992,40:707-713.
[11]QIN Cai-qin,DU Yu-min,XIAO Ling,et al.Enzymic preparation of water-soluble chitosan and their antitumor activity[J].Int J Biol Macromol,2002,31:111-117.
[12]XIE Wen-ming,XU Pei-xin,LIU Qing.Antioxidant activity of water-soluble chitosan derivatives[J].Bioorg Med Chem Lett,2001,11:1699-1701.
[13]Jing H,Kitts D D.Chemical and biochemical properties of casein-sugar Maillard reaction products[J].Food Chem Toxicol,2002,40:1007-1015.

