气相色谱法定量分析共轭亚油酸异构体
王 伟, 杨 虹, 杨天奎
(丰益(上海)生物技术研发中心有限公司,上海200137)
共轭亚油酸(CLA)是由亚油酸衍生的具有共轭双键结构的十八碳二烯酸的位置和几何异构体的统称,目前发现的异构体有20种。大量的研究发现CLA可抑制化学诱导的皮肤癌、胃癌、乳腺癌和结肠癌,具有抗突变,提高免疫功能,防止动脉硬化等生理功能;起关键作用的为两种主要异构体:9c,11t-CLA和10t,12c-CLA[1]。共轭亚油酸及其甘油三酯作为新资源食品,在人类的健康方面发挥着积极的作用。目前针对共轭亚油酸采用的主要分析方法有气相色谱法,银离子高效液相色谱法,气质联用法(GC-MS)等,或者几种方法一起使用,达到对共轭亚油酸异构体的分离和鉴别目的[2-3]。针对两种主要异构体9c,11t-CLA和10t,12c-CLA的分析方法进行研究,建立了两种异构体的准确、灵敏的定量分析方法,以满足实际检测的需求。
1 材料与方法
1.1 仪器与试剂
Agilent 7890A气相色谱仪:美国安捷伦公司产品;漩涡振荡器:上海精科实业有限公司产品;离心机:北京时代北利离心机有限公司产品;9c,11t-CLA甲酯,10t,12c-CLA甲酯:瑞士larodan公司产品。
1.2 色谱条件
毛细管气相色谱柱:VARIAN CP-Sil88(100 m×0.25 mm×0.25 μm), 升温程序:45 ℃保持 4 min,以13℃/min升到175℃保持27 min,以4℃/min升到215 ℃保持 35 min。 载气:氦气;流量:1 mL/min;进样量:1 μL;分流比:10∶1;进样口温度:270 ℃;检测器温度:280℃。标准品和样品经过前处理后按照上述色谱条件分析的色谱图见图1,2。

图1 标准品的色谱图Fig.1 GC chromatograms of standard sample
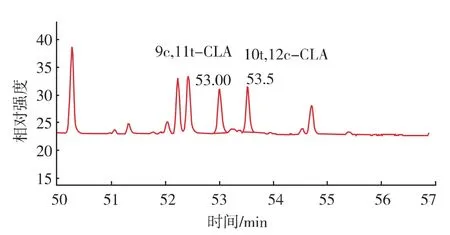
图2 样品的色谱图Fig.2 GC chromatograms of sample
1.3 样品前处理方法
精密称取样品约0.5 g至50 mL离心管中,加入8 mL正己烷溶解,然后加入2 mL 0.5 mol/L的氢氧化钾甲醇溶液,振摇均匀,放入60℃烘箱中反应5 min,振摇后取出放置室温下冷却反应15 min,加入5 mL饱和食盐水溶液,在漩涡振荡器上振荡一分钟,然后以6 000 r/min的转速离心5 min,用滴管吸取上清液放入25 mL容量瓶中,依次加入8 mL正己烷萃取2次,振荡离心后取上清液并入容量瓶中,用正己烷定容至刻度[4]。
1.4 标准曲线的配制
用正己烷溶解 9c,11t-CLA 甲酯,10t,12c-CLA甲酯标准品,至同一个25 mL容量瓶中,用正己烷定容,配制成1 mg/mL的混合标准溶液,作为储备液。然后稀释成 10,20,40,60,80,100 μg/mL 的标准溶液。
2 结果与讨论
2.1 样品前处理方法
2.1.1 甲酯化试剂的选择 选用4种试剂进行甲酯化:体积分数14%三氟化硼甲醇溶液,体积分数0.78%硫酸甲醇溶液,0.5 mol/L甲醇钠甲醇溶液,0.5 mol/L氢氧化钾甲醇溶液。实验样品为共轭亚油酸甘油三酯T80。实验条件为60℃烘箱中反应5 min,振摇后取出放置室温下冷却反应15 min。样品是甘三酯类,实验结果发现采用酸法甲酯化不完全,峰面积很小,故不采用酸法甲酯化。氢氧化钾甲醇溶液与甲醇钠甲醇溶液产生的异构体含量相当,因为氢氧化钾甲醇溶液为实验室常备,且毒性小,故选作甲酯化试剂。不同甲酯化试剂分析共轭亚油酸异构体的面积见表1。
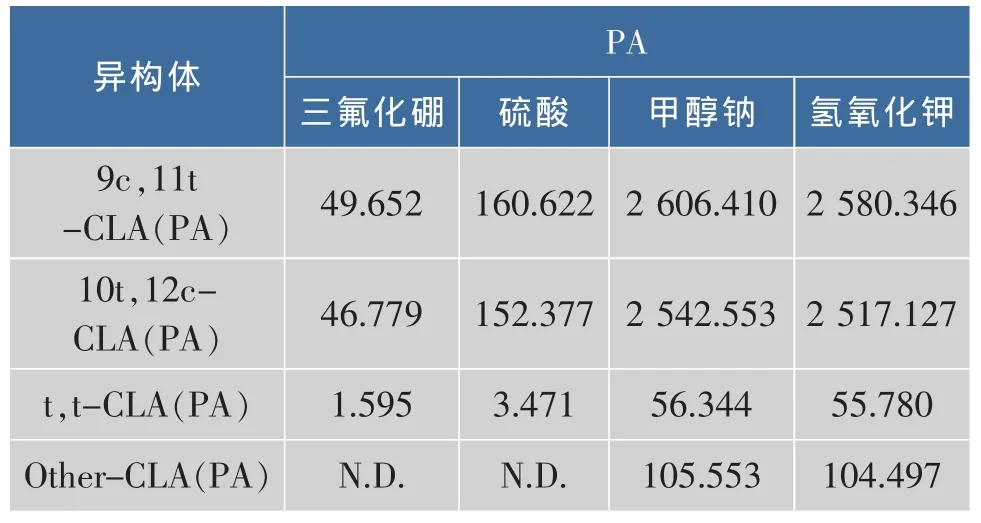
表1 不同甲酯化试剂分析共轭亚油酸异构体的峰面积(PA)Tab.1 Peak area of CLA isomer on different Methylating Agent(PA)
2.1.2 甲酯化试剂添加量的影响 取0.5 mol/L氢氧化钾甲醇溶液 1,2,3,4,5 mL加入样品中, 其他条件按照样品前处理方法进行实验 ,考察氢氧化钾甲醇溶液添加量对产物质量分数的影响,结果如图3所示。
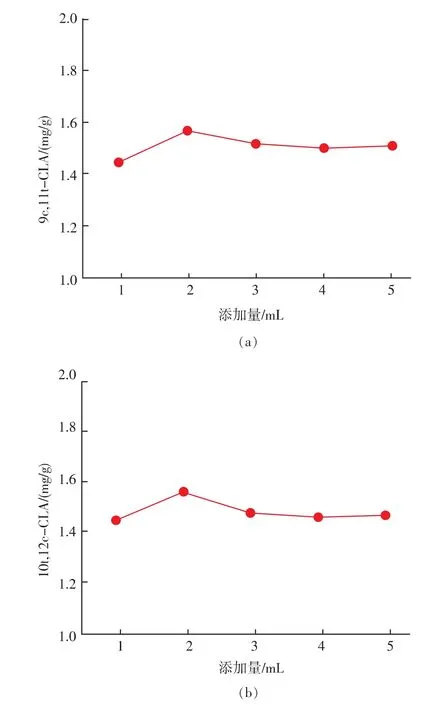
图3 甲酯化试剂的添加量对9c,11t-CLA和10t,12c-CLA质量分数的影响Fig.3 Effect of the amount of Methylating Agent on the CLA content
甲酯化试剂添加量在2 mL时2种共轭亚油酸甲酯质量分数达到最高。当甲酯化试剂太少,可能影响甲酯化完全;甲酯化试剂太多,可能因为共轭亚油酸甲酯在甲醇中有一定的溶解度,从而影响了萃取效率。
2.1.3 甲酯化时间选择 将样品用8 mL正己烷溶解后,加入2 mL 0.5 mol/L的氢氧化钾甲醇溶液,放置在 60℃烘箱中反应 0,5,10,15,20,25 min, 然后放在室温下冷却15 min(见图4)。结果显示样品溶液随着反应时间延长(5 min之后),含量呈降低趋势,发生共轭亚油酸的异构化的可能性增加[5],从而影响定量的准确性。故对甲酯化时间进行选择,确定加热5 min的时间为佳。
2.2 色谱条件的优化
共轭亚油酸的异构体种类多,要达到对主要异构体定量的目的,对异构体分离的要求高。目前国内外报道的文章,主要采用强极性的色谱柱,如CP-sil88,BPX-70,SP-2560 等色谱柱。 采用CPSil88 (100 m×0.25 mm×0.25 μm)的色谱柱进行试验。分别在氢气、氦气做载气情况下,考察了恒流模式(1 mL/min)和恒压模式下对分离的影响。结果表明载气、恒流恒压模式对分离影响不大。升温速率越快,出峰时间越早,但分离度不好;升温速率越慢,峰响应(峰高)越小,影响定量,而且分析时间长,效率低。最终选择合适的升温程序,使分离度和峰响应比较适中,达到准确定量的目的。
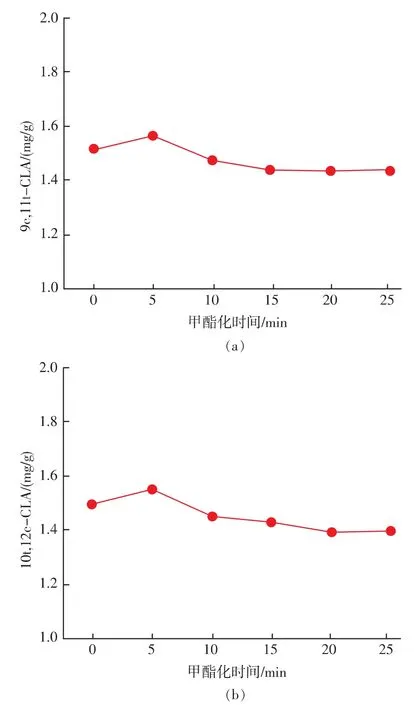
图4 甲酯化时间对 9c,11t-CLA和10t,12c-CLA质量分数的影响Fig.4 Effect of Methylation time on the CLA content
2.3 线性关系考察
以共轭亚油酸甲酯溶液质量浓度为横坐标,峰面积为纵坐标,绘制标准曲线得到曲线方程,在10~100 μg/mL的质量浓度范围内,线性良好,相关系数为0.999,见图 5。
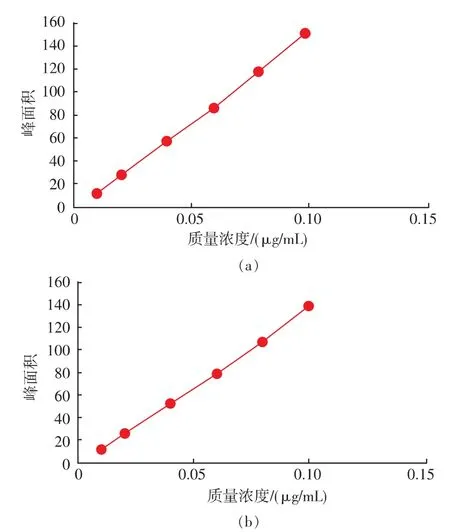
图5 标准品9c,11t-CLA甲酯和 10t,12c-CLA甲酯的线性关系Fig.5 Linearity of standard sample
2.4 检出限、定量限考察
以仪器信噪比S/N=3时标准品的含量为最低检出限,仪器信噪比S/N=10时的含量为仪器的最低定量限,最低检出限(LOD)为2.4 mg/kg,定量限(LOQ)为 8 mg/kg,最低检出量为 0.6 ng,与农业部制定的乳及乳制品中共轭亚油酸的含量测定标准[4]中的最低检出量9 ng及13.8 ng相比,具有更高的灵敏度。
2.5 重复性考察
按照样品的处理方法,平行测试6个样品,含量结果见下表 2。9c,11t-CLA 和 10t,12c-CLA 的平均质量分数分别为1.485,1.449 mg/g,相对标准偏差均小于2%,可见样品测试重复性良好。
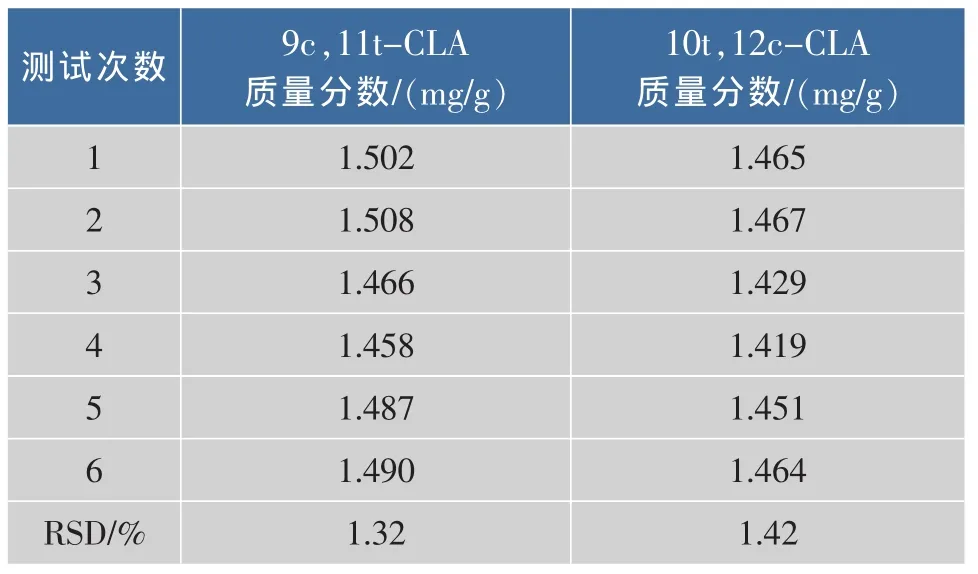
表2 样品重复性测试结果Tab.2 Repeatability of sample
2.6 方法回收率考察
精确称取样品约0.5 g,分别加入高、中、低3种质量浓度的标准品溶液,按供试品的前处理方法进行实验,进气相色谱分析得到的回收率见表3,4。该方法的回收率高,表明分析方法准确度高。
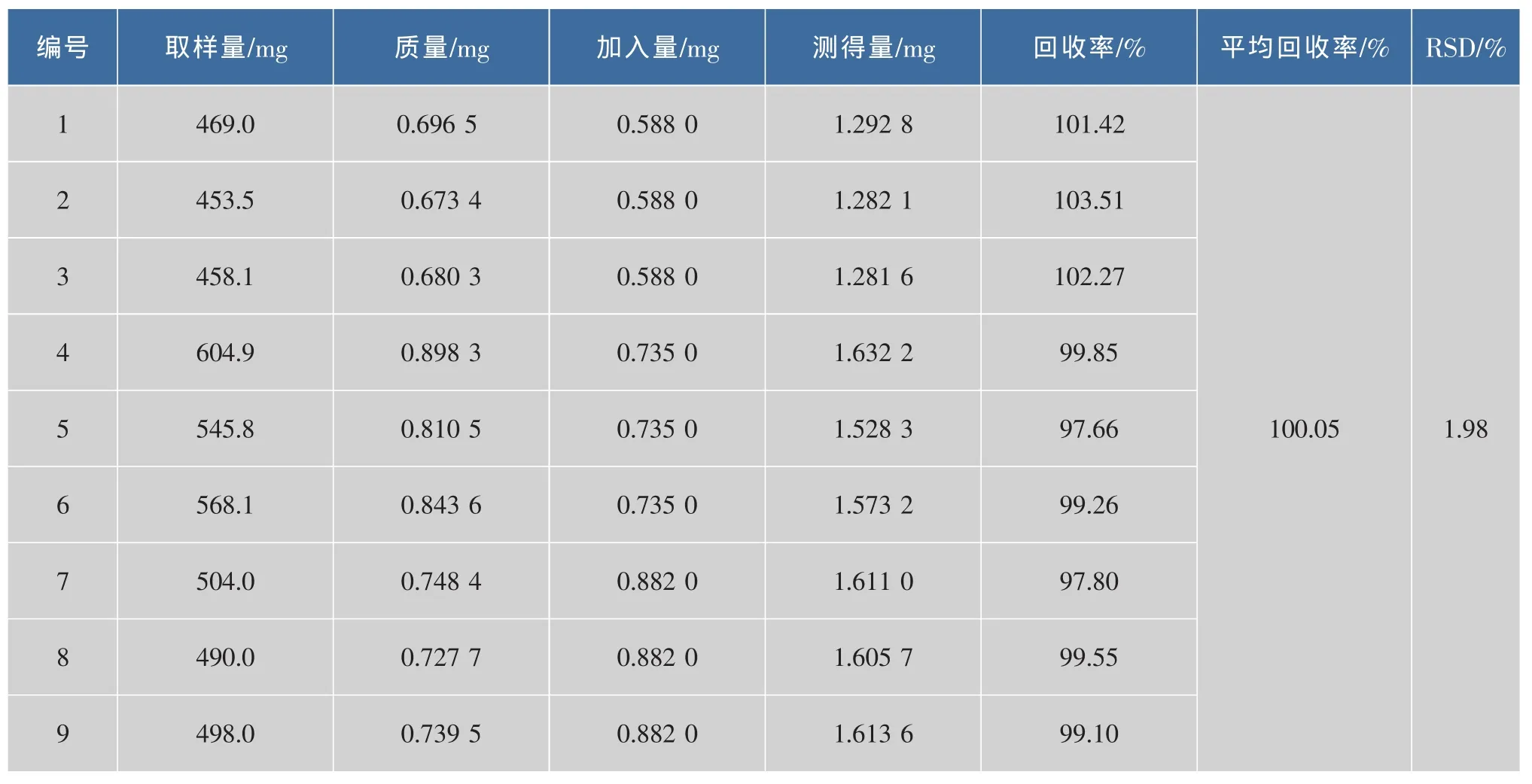
表3 样品中9c,11t-CLA加标回收率Fig.3 Recovery of 9c,11t-CLA in sample
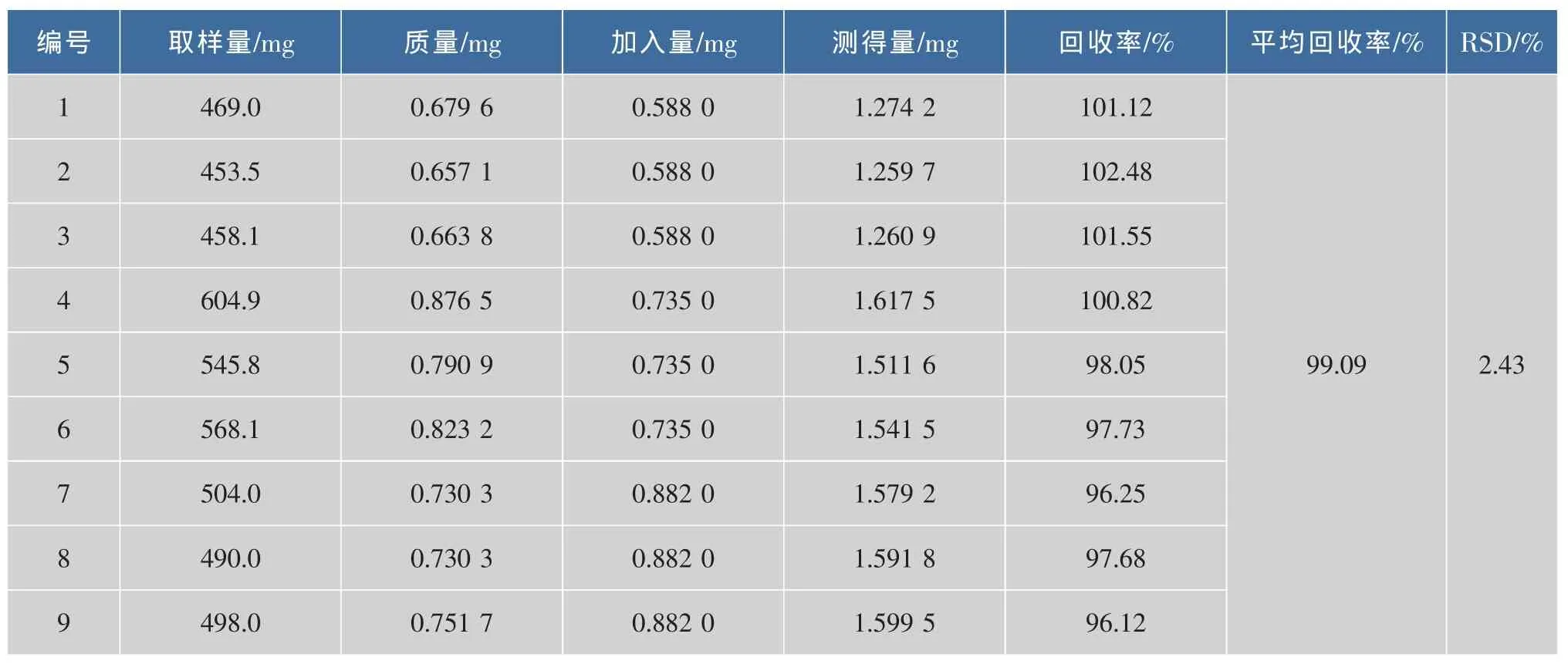
表4 样品中10t,12c-CLA加标回收率Fig.4 Recovery of 10t,12c-CLA in sample
2.7 稳定性考察
将处理好的样品室温下放置6,12,24 h后进样,两种同分异构体的含量在24 h内稳定(见表5)。该方法样品溶液在室温下24 h内稳定性好,是准确定量的前提条件。

表5 样品在室温下的稳定性Tab.5 Stability of sample in room temperature
2.8 样品测定
藏酥油是青藏高原地区牧民用传统手工艺从牦牛奶中提炼出的奶油。其中含有共轭亚油酸,EPA,DHA等功能性脂肪酸,而且纯天然无污染,特别适合于中老年、婴幼儿和体弱人群。近几年针对藏酥油的研究越来越多,取不同产地的天然藏酥油进行分析,得到共轭亚油酸的质量分数,结果见表6。天然藏酥油的共轭亚油酸主要是9c,11t-CLA,在西藏地区的那曲和拉萨的藏酥油9c,11t-CLA含量明显高于四川、西藏日喀则等地区。
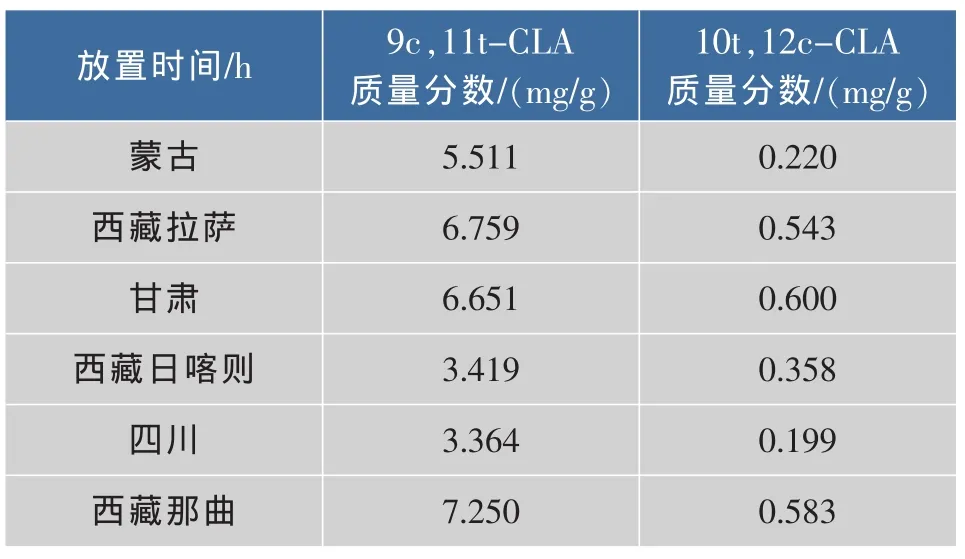
表6 不同地区藏酥油中共轭亚油酸质量分数测定Tab.6 Content of CLA in Tibetan butter in different regions
3 结语
针对共轭亚油酸中 9c,11t-CLA和 10t,12c-CLA两种主要异构体,采用外标法定量,灵敏度高,准确度高,重复性好,不用回流,相对简单易操作。综合考虑了检测限和分离度的要求,达到了很高的灵敏度和分离度。检测了藏酥油中共轭亚油酸两种主要异构体的质量分数,对研究不同地区的藏酥油有参考意义。该方法对油脂类其他相关产品中的共轭亚油酸酯的两种异构体也可进行准确定量分析。
[1]邵群,张慧,边际.功能性油脂-共轭亚油酸研究进展[J].食品科学,2002,23(2):164-166.SHAO Qun,ZHANG hui,BIAN ji.Functional oil-advances in conjugated linoleic acid research[J].Food Science,2002,23(2):164-166.(in Chinese)
[2]刘晓华,曹郁生,陈燕.共轭亚油酸分析方法的研究进展[J].中国油脂,2004(7):48-50.LIU Xiao-hua,CAO Yu-sheng,CHEN Yan.The research progress of analytical method of conjugated linoleic acid[J].Chian Oil And Fat,2004(7):48-50.(in Chinese)
[3]邓泽元,余迎利,John KG Kramer.GC 和 HPLC 对共轭亚油酸的测定[J].中国油脂,2005,30(3):36-38.DENG Ze-yuan,YU Ying-li,John KG Kramer.The determination of conjugated linoleic acid by GC and HPLC[J].Chian Oil And Fat,2005,30(3):36-38.(in Chinese)
[4]中华人民共和国农业部.NY/T 1671-2008[S].北京:中国农业出版社,2008.
[5]Masao Yamasaki,Koji Kishihara,Ikuo Ikeda,et al.A recommended esterification method for gas chromatographic measurement of conjugated linoleic acid[J].JAOCS,1999,78(8):223-228.

