阿德福韦酯耐药的慢性乙型肝炎患者特征分析
赵召霞 梅志勤 戴二黑
阿德福韦酯是被批准上市的第二大类核苷类似物药物,因具有单磷酸腺苷的无环磷酸化核苷类似物,在细胞磷酸化为二磷酸盐,发挥抑制乙肝病毒多聚酶的作用,因而用于乙型肝炎病毒野毒株和拉米夫定耐药相关的YMDD变异株的慢性乙型肝炎患者的治疗。目前文献报道乙型肝炎病毒逆转录酶(reverse transcriptase,rt)区N236T突变是阿德福韦酯的标志性耐药位点,而A181T突变也是阿德福韦酯的主要耐药位点[1],但各自的病毒学特征是否有差异,目前的报道甚少,因此本研究对阿德福韦酯治疗过程中发生病毒学突破的慢性乙型肝炎患者进行rtN236位点、rtA181位点以及两者联合突变的分析,报道如下。
1 资料与方法
1.1 一般资料 选择2009年8月至2010年12月在我住院或门诊就诊的慢性乙型肝炎患者42例,男31例,女11例;年龄19~65岁,平均年龄(44±12)岁。诊断标准依据2000年全国病毒性肝炎与肝脏学术会议修订的诊断标准[2],均排除其他肝炎病毒感染、药物或酒精性肝病。入选标准:(1)口服阿德福韦酯,10 mg/d,疗程在6个月以上。(2)患者开始阿德福韦酯治疗前不存在阿德福韦酯相关耐药突变。(3)应用阿德福韦酯治疗后曾出现HBV DNA转阴或HBV DNA下降>2log拷贝/ml,但在继续治疗过程中,HBV DNA升高>1log拷贝/ml,或HBV DNA反跳至1×105拷贝/ml以上。(4)伴有或不伴丙氨酸氨基转移酶(ALT)升高。(5)排除阿德福韦酯治疗过程中患者依从性差而引起的乙型肝炎病毒学突破。(6)排除其他原因引起的ALT升高。对于符合入选标准的患者,在获取知情同意后留取血清标本,保存于-70℃冰箱内待测。
1.2 检测方法
1.2.1 检测指标:采用罗氏cobas e601电化学发光分析仪检测血清HBsAg含量(试剂为罗氏诊断HBsAgⅡ检测试剂);采用ABI7300实时荧光定量PCR仪进行血清HBV DNA定量检测(试剂购自中山医科大学达安基因诊断中心),最低检测下线为500拷贝/ml;采用美国雅培C8000全自动生化分析仪检测血清ALT。
1.2.2 HBV DNA测序:所有患者开始阿德福韦酯治疗前、出现阿德福韦酯耐药后均采用美国贝克曼CEQ8000进行HBV P区基因测序,试剂购自上海翼和生物技术有限公司,严格按照说明书进行操作。
1.3统计学分析应用SPSS 13.0统计软件,计量资料以±s表示,采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 42例患者发生阿德福韦酯耐药后各耐药位点的变异情况
发生rtA181位点突变27例,其中单纯rtA181变异9例,rtA181野生株和rtA181变异株混合18例;rtN236位点突变6例,其中单纯rtN236变异4例,rtN236野生株和rtN236变异株混合2例。见表1。

表1 阿德福韦酯耐药相关变异分析 例
2.2 阿德福韦酯耐药各变异组间病毒学特点 单纯rtA181变异组血清表面抗原明显低于单纯rtN236变异组和rtA181+rtN236变异组(P=0.04);rtA181+rtN236变异组血清HBVDNA和ALT明显高于单纯rtA181变异组和单纯rtN236变异组(P=0.03,0.04)。见表 2。
2.3 阿德福韦酯耐药慢性乙型肝炎患者乙型肝炎病毒基因型分析 采用基因测序的方法,所有阿德福韦酯耐药慢性乙型肝炎患者乙型肝炎病毒基因型中只有3例是B型,而且这3例均在单纯N236变异组,其他均为C型。
表2阿德福韦酯耐药各变异组间病毒学特点±s
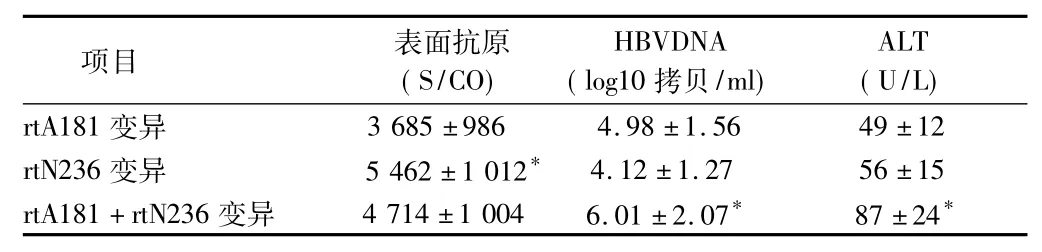
表2阿德福韦酯耐药各变异组间病毒学特点±s
注:与 rtA81 比较,*P <0.05
项目 表面抗原(S/CO)HBVDNA(log10拷贝/ml)ALT(U/L)rtA181变异3 685 ±986 4.98 ±1.56 49 ±12 rtN236变异 5 462±1 012* 4.12±1.27 56±15 rtA181+rtN236变异 4 714±1 004 6.01±2.07* 87±24*
3 讨论
HBV基因组由3 200个碱基对构成的部分双链环状DNA,含有4个开放读码框架,即S、P、C、X区,其中P区是编码HBV逆转录酶的区域,也是目前常用核苷类似物药物作用的区域。RT区又包括7个功能亚区,从rt区上游第1个氨基酸起依次为 A、B、C、D、E、F、G 亚区,rtN236 位点位于 D 亚区,rtA181 位点位于B亚区。Warner等[3]通过体外实验研究认为,HBV rt区A181T突变反映到S基因上可以引起172位原来编码色氨酸(W)的密码子突变为终止密码子,即sW172* 突变,导致HBsAg丢失大部分C末端疏水区,从而抑制HBsAg的分泌。本研究结果显示单纯rtA181变异组血清表面抗原明显低于单纯rtN236变异组和rtA181+rtN236变异组(P=0.04),这一结果也与王春亚等[4]研究一致。HBV rt区A181T突变还会引起病毒在肝细胞内的积聚和HBV DNA载量的下降,这将影响临床上仅仅依据血清HBV DNA水平诊断病毒学突破的结果[3]。本研究结果显示rtA181+rtN236变异组血清HBVDNA和ALT明显高于单纯rtA181变异组和单纯rtN236变异组,这一结果与赵攀等[5]研究一致。rtN236突变与rtA181突变互为补偿突变,一种突变可以增强另一种突变的病毒复制力和适应能力,而且rtN236T与rtA181T联合突变导致患者血清ALT升高,这会引起肝脏炎症的波动。体外药敏实验表明rtN236T单独突变可使HBV对阿德福韦的敏感性下降7倍,而rtN236T+rtA181T联合突变可使药物敏感性下降18倍[6]。
在HBV基因型构成方面,本研究显示,B型与C型相比较,B型容易发生rtN236T单独突变,本研究结果显示有3例是B型,而且这3例均在单纯N236变异组,这一结果与刘峰等[7]的研究结果一致;阿德福韦耐药rtN236T突变株与rtA181T突变株有各自的临床特点,在平时的检测和诊断中应引起足够重视。
1 秦艳丽,张继明,黄玉仙,等.阿德福韦治疗拉米夫定耐药慢性乙型肝炎患者的耐药率及耐药株进化情况.中华肝脏病杂志,2007,15:4-7.
2 中华医学会传染病与寄生虫病学分会、肝病学分会.病毒性肝炎防治方案.中华传染病杂志,2001,19:56-62.
3 Warner N,Locarnini S.The antiviral drug selected hepatitis B virus rtA181T/sW 172* mutant has a dominant negative secretion defect and alters the typical profile of viral rebound.H epatology,2008,48:88-98.
4 王春亚,钟彦伟,杨昊臻,等.HBV逆转录酶区N236T突变与A181T突变患者临床特征的比较.实用医院临床杂志,2010,7:47-48.
5 赵攀,徐东平,李晓东,等.乙型肝炎病逆转录酶区N236T单独突变与N236T+A181T联合突变患者临床特征的比较.第二军医大学学报,2010,31:834-836.
6 Bartholomcusz A,Locarnini S.Antiviral drug resistance:clinical consequences and molecular aspects.Semin Liver Dis,2006,26:1621-1670.
7 刘峰,王磊,王丽娜,等.阿德福韦治疗慢性乙型肝炎过程中发生病毒突破患者(HBV)P基因变异分析.山东大学学报(医学版),2008,46:407-410.

