基因FoxM1介导DFOG抑制人乳腺癌细胞生长和诱导凋亡的研究
刘莉萍,欧阳取长,曹建国,向红琳,全梅芳
(1.湖南省肿瘤医院乳腺内科,湖南长沙,410013;2.湖南师范大学医学院药物工程实验室,湖南长沙,410013)
乳腺癌成为妇女发病率最高的恶性肿瘤之一[1]。目前,化学药物治疗虽在化学综合治疗中占据重要地位,但因其严重的毒副作用及容易产生耐药性,其临床应用价值极大地减少。因此,研制高效低毒的乳腺癌靶向药物具有重大现实意义和广阔的临床应用前景。叉头盒转录基因M1(FoxM1)是叉头盒转录因子家族成员之一[2],已被证明能调控细胞周期G1/S期和G2/M期运转关键基因的转录,包括细胞分裂周期蛋白基因(cdc25A,cdc25B),细胞周期蛋白(cyclin B,cyclin D1,p21蛋白和p27蛋白)[3-5]。研究[6]表明,FoxM1信号网络在人类乳腺癌中存在FoxM1高表达。因此FoxM1可能成为抗乳腺癌药物作用新标靶。7-二氟甲氧基-5,4′-二-正辛烷氧基金雀异黄素(DFOG)是本研究对金雀异黄素(GEN)进行化学改造获得的新化学实体。Wang等[7]研究提示FoxM1可能是GEN抗胰腺癌的新靶标。此外,本组最近研究表明[8]DFOG通过调控FoxM1信号途径发挥抗卵巢癌作用,较先导化合物GEN抗肿瘤活性更强。本研究旨在探讨DFOG抑制人乳腺癌MCF-7和MDA-MB-453细胞生长和诱导凋亡作用及其抗乳腺癌作用的分子机制。
1 材料与方法
1.1 药品与试剂
DFOG(分子量:544,性状:黄色粉末,纯度:98%)参照文献[9]方法制备;碘化丙啶(PI,Sigma公司);GEN(美国 Sigma公司);小鼠抗人FoxM1、CDK1、cyclin B、p27kip1和 β-actin 一抗以及辣根过氧化物酶标记山羊抗小鼠IgG抗体;ECL Western blot检测试剂盒;脂质体2000转染试剂盒。
1.2 细胞培养
人乳腺癌MCF-7和MDA-MB-453细胞购于中国典型培养物保藏中心,将其放入含10%小牛血清的DMEM培养基,加入青霉素100 U/mL+链霉素100 U/mL,于37℃及5%CO2饱和湿度培养箱条件下培养。
1.3 平皿集落形成法
取对数生长期细胞,调节细胞密度为1×103/mL。以每孔 900 μL接种于 24孔板。待细胞贴壁后,分别加入 100 μL配制好的各浓度DFOG(终浓度分别为 10.0 、20.0、40.0 μ mol/L)和GEN(终浓度为 80 μ mol/L)培养基 ,并且设立空白对照组和溶媒对照组[加入含0.1%二甲基亚砜(DMSO)],每个浓度设2个复孔,加药的培养基每隔2 d换1次,置CO2培养箱中培养6 d,经固定、染色后倒置显微镜下记录细胞形成的克隆集落数,集落抑制率IR%=(1-处理组集落均数/对照组集落均数)×100%,实验重复3次。
1.4 PI染色流式细胞术(FCM)分析
按照文献[10]的方法进行,用EPICS XL型流式细胞仪测定细胞的DNA含量,并用SYSTEM II软件分析细胞凋亡率。
1.5 Western Blot分析
按照先前文献[10]描述的方法完成。小鼠抗人FoxM1 、CDK1、cyclin B 、p27kip1和 β-actin 用于一抗,山羊抗小鼠IgG抗体作为二抗反应。用增强型ECL蛋白质印迹分析系统检测目的条带信号。
1.6 FoxM1 siRNA转染
FoxM1 siRNA购自美国Santa Cruz公司,人乳腺癌MCF-7细胞转染采用脂质体2000转染试剂盒,按照试剂盒操作说明进行。
1.7 逆转录PCR(RT-PCR)检测FoxM1基因表达
收集各组细胞,TRlzol提取总RNA和逆转录cDNA的合成按试剂盒说明书操作。引物设计、反应体系及条件按文献[8]方法进行,所得产物经1%琼脂糖凝胶电泳验证。
2 结 果
2.1 DFOG对乳腺癌细胞集落形成的影响
经不同浓度DFOG(10.0、20.0、40.0μ mol/L)作用6 d后,乳腺癌细胞克隆形成数逐渐减少,克隆形成率逐渐下降,MCF-7细胞的集落抑制率分别26.7%、61.6%和84.9%,MDA-MB-453细胞为22.4%、51.3%、72.4%,均明显低于溶媒对照组(P<0.05),GEN对照组对乳腺癌MCF-7与MDA-MB-453细胞的克隆形成抑制率分别为55.8%、44.7%。表明DFOG以浓度依赖的方式显著抑制MCF-7与MDA-MB-453细胞生长。见图1。

图1 DFOG对MCF-7与MDA-MB-453细胞集落形成的影响(,n=3)
2.2 DFOG对乳腺癌MCF-7与MDA-MB-453细胞周期分布的影响
FCM分析发现,与溶媒对照组比较,DFOG(10.0、20.0 、40.0 μ mol/L)处理 24 h,随药物浓度增大MCF-7与MDA-MB-453细胞系G2期细胞百分率逐次增加;同时,G1和S期细胞百分率逐渐减少,见图 2。DFOG将 MCF-7与MDAMB-453细胞阻滞于G2/M期。
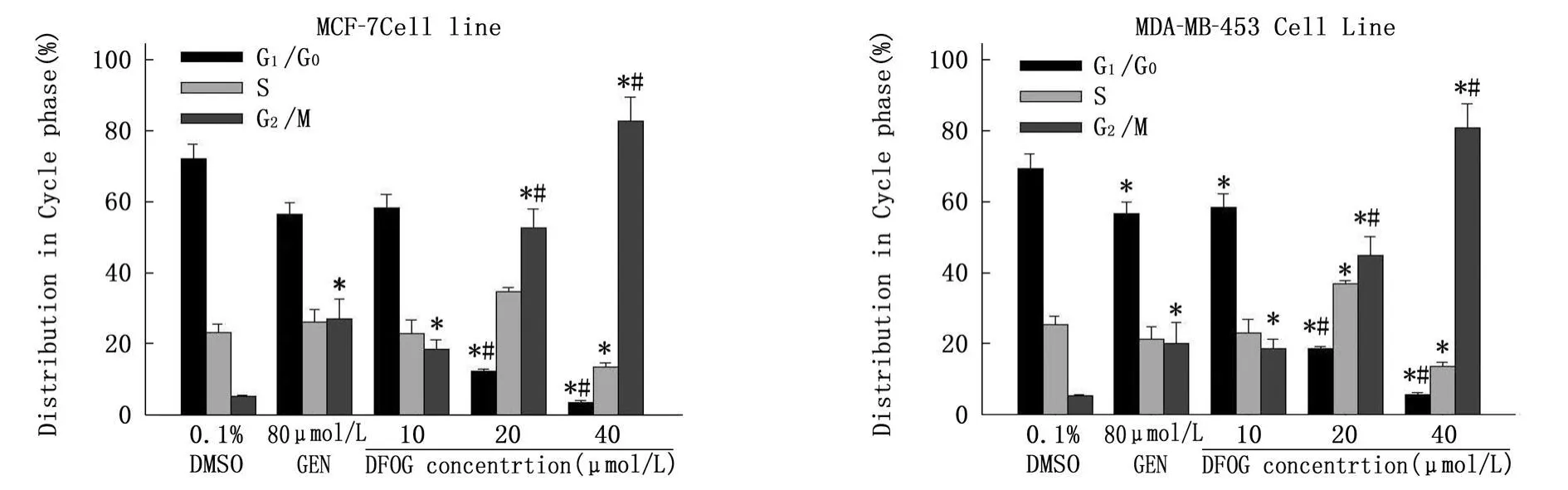
图2 DFOG对MCF-7与MDA-MB-453细胞周期的影响(,n=3)
2.3 DFOG对乳腺癌细胞凋亡率的影响
PI染色FCM 分析结果表明,DFOG(10.0、20.0 和 40.0 μ mol/L)处理 48 h,DFOG 按照浓度依赖的方式显著诱导MCF-7和MDA-MB-453细胞凋亡率增加,见图3。

图3 DFOG对MCF-7与MDA-MB-453细胞凋亡率的影响(,n=3)
2.4 DFOG对乳腺癌细胞FoxM1及其下游基因产物表达的影响
Western blotting分析结果显示,DFOG以浓度依赖的方式下调MCF-7与MDA-MB-453细胞FoxM1及其下游蛋白 CDK1、cyclin B、survivin 表达,上调p27kip1蛋白表达,见图4。

图4 DFOG对MCF-7和MDA-MB-453细胞FoxM1及其下游基因产物表达的影响
2.5 抑制FoxM1基因表达对MCF-7细胞凋亡率的影响
Western blotting结果表明,与溶媒对照组相比,FoxM1 siRNA转染细胞FoxM1蛋白表达水平明显下调。同时,FCM分析结果显示:FoxM1 siRNA转染能可使DFOG诱导人乳腺癌细胞凋亡率的增加(P<0.05),见图5。这些结果充分说明下调FoxM1蛋白表达是DFOG诱导人乳腺癌细胞凋亡的机制之一。

图5 抑制FoxM1基因表达对MCF-7细胞凋亡率的影响
3 讨 论
转录因子FoxM1是Forkhead Box转录因子家族成员之一,与细胞增殖、胚胎发育、衰老、再生和肿瘤等许多病理生理过程密切相关。研究[11]表明,FoxM1信号在细胞发育途径中起着重要的作用,包括维持细胞增殖和凋亡之间的动态平衡,所以FoxM1基因的非正常激活已成为癌变组织的重要特征之一。目前发现,在人类大多数肿瘤中FoxM1都具有较高的表达水平[12-13]。FoxM1在细胞中的特殊功能以及与肿瘤的密切关系,使之成为肿瘤治疗的新靶点。研究[6-7,14]表明,thiostrepton、Gen和gefitinib等多种药物对FoxM1的表达具有抑制作用。
本文的研究结果表明,DFOG及其先导化合物GEN以浓度依赖的方式抑制人乳腺癌MCF-7和MDA-MB-453细胞生长和诱导凋亡,并且伴随G2/M期细胞周期阻滞。DFOG能下调FoxM1及其下游靶标分子CDK1、cyclin B、survivin表达,上调p27kip1蛋白表达。众所周知,CDK1、cyclin B和p27蛋白均为调控细胞周期G2向M期运转的关键因子[15],因此,这些结果充分说明FoxM1通过调节细胞周期相关蛋白CDK1、cyclin B和CDK抑制因子p27的表达影响人乳腺癌细胞的细胞周期分布并抑制细胞生长。另一方面,survivin是凋亡抑制蛋白家族的成员,表达于大多数肿瘤组织中,而在正常组织中未见有表达。survivin主要表达于细胞周期的G2/M期,它可直接抑制细胞凋亡下游终端效应器Caspase-3、Caspase-7的活性,从而阻断细胞的凋亡过程[16]。综上所述,DFOG和GEN介导的细胞生长抑制和诱导凋亡作用可能与FoxM1信号途径的抑制有关。
本研究将FoxM1 siRNA转染MCF-7细胞,以便进一步证明FoxM1是否介导DFOG诱导人乳腺癌细胞凋亡,Western blotting结果表明,与溶媒对照组相比,FoxM1 siRNA转染细胞FoxM1蛋白表达水平明显下调。同时,FoxM1 siRNA转染能可使DFOG诱导人乳腺癌细胞凋亡率的增加。这些结果充分说明下调FoxM1蛋白表达是DFOG诱导人乳腺癌细胞诱导凋亡的机制之一。
总之,DFOG具有抑制人乳腺癌MCF-7和MDA-MB-453细胞生长和诱导凋亡的作用,其诱导细胞凋亡机制涉及下调细胞内FoxM1表达水平。
[1]Hadjeri M,Barbier M,Ronot X,et a1.Modulation of P-glycopretein mediated multidrog resistanceby flavonoid derivatives and analogues[J].Med Chem,2003,46(11):2125.
[2]Wierstra I,Alves J.FOXM 1,a typical proliferation-associated transcription factor[J].Biol Chem 2007,388(12):1257.
[3]Costa R H.FoxM 1 dances with mitosis[J].Nat Cell Biol,2005,7(2):108.
[4]Petrovic V,Costa R H,Lau L F,et al.FoxM1 regulates growth factor-induced expression of kinase-interacting stathmin(KIS)to promote cell cycle progression[J].J Biol Chem,2008,283(1):453.
[5]Chen Y J,Dominguez-Brauer C,Wang Z,et al.A conserved phosphorylation site within the forkhead domain of FoxM 1B is required for its activation by cyclin-CDK1[J].J Biol Chem,2009,284(44):30695.
[6]Kwok J M,Myatt S S,MarsonC M,et al.Thiostrepton selectively targets breast cancer cells through inhibition of forkhead box M1 expression[J].Mol Cancer Ther,2008,7(7):2022.
[7]Wang Z,Ahmad A,Banerjee S,et al.FoxM1 is a novel target of a natural agent in pancreatic cancer[J].Pharm Res,2010,27(6):1159.
[8]Ning Y,Li Q,Xiang H,et al.Apoptosis induced by 7-di-fluoromethoxyl-5,4′-di-n-octyl genistein via the inactivation of FoxM1 in ovarian cancer cells[J].Oncol Rep,2012.[Epub ahead of print].
[9]Fu XH,Wang L,Zhao H,et al.Synthesis of genistein derivatives and determination of their protective effects against vascular endothelial cell damages caused by hydrogen peroxide[J].Bioorg Med Chem Lett,2008,18(2):513.
[10]Xie Z H,Quan M F,Liu F,et al.5-allyl-7-gen-difluoromethoxy chrysin enhances TRAIL-induced apoptosis in human lung carcinoma A549 cells[J].BMC Cancer,2011,11:322.
[11]Laoukili J,Stahl M,M edema R H.FoxM1:at the crossroads of ageing and cancer[J].Biochim Biophys Acta,2007,1775(1):92.
[12]Francis R E,Myatt S S,Krol J,et al.FoxM1 is a downstream target and marker of HER2 overexpression in breast cancer[J].Int J Oncol,2009,35(1):57.
[13]Gemenetzidis E,Bose A,Riaz A M,et al.FOXM1 upregulation is an early event in human squamous cell carcinoma and it is enhanced by nicotine during malignant transformation[J].PLoS One,2009,4(3):e4849.
[14]M cGovern U B,Francis R E,Peck B,et al.Gefitinib(Iressa)represses FOXM 1 expression via FOXO3a in breast cancer[J].Mol Cancer Ther,2009,8(3):582.
[15]Zhou B B,Bartek J.Targeting the checkpoint kinases:chemosensitization versus chemoprotection[J].Nat Rev Cancer,2004,4(3):216.
[16]Cheung C H,Chen H H,Kuo C C,et al.Survivin counteracts the therapeutic effect of microtubule de-stabilizers by stabilizing tubulin polymers[J].Mol Cancer,2009,8:43.

