紫杉醇脂质体联合顺铂治疗晚期食管癌的临床疗效研究
丁令池,张晓东,姚卫东,陆俊国
(江苏省南通市肿瘤医院肿瘤科,江苏南通,226361)
食管癌的发病率占全世界恶性肿瘤的第九位,其发病率具有明显的区域性。在我国,食管癌的发病率与病死率位居第四位,高发区为河南林县、太行山区、苏北地区等,严重威胁人民健康,是我国确定的重点癌症防治之一[1-2]。食管癌的早期症状不明显,明确诊断时多为中晚期,约50%食管癌患者在就诊时已为晚期,因而失去手术机会。化疗是晚期食管癌的主要治疗手段,可延长生存期,改善症状,提高生活质量。本科自2010年6月—2011年6月采用紫杉醇脂质体联合顺铂(DDP)与顺铂联合氟尿嘧啶(5-Fu)治疗38例晚期食管癌患者,现汇报如下。
1 资料与方法
1.1 一般资料
2010年6月—2011年6月收治的食管癌患者38例,其中男 28例,女10例,年龄43~72岁,中位年龄62岁。肺转移13例,肝转移10例,锁骨上淋巴结转移17例,纵隔淋巴结转移29例,腹腔淋巴结转移16例,骨转移8例。鳞癌32例,腺癌6例;初治患者26例,复治患者12例。入选标准:①均经病理学和影像学证实为晚期食管癌;②均有可测量的病灶;③无严重脏器功能障碍;④肝、肾功能及血常规正常;⑤一般情况良好,无严重营养不良;⑥预计生存期>3个月。所有患者随机分为2组:其中试验组19例,对照组19例,2组患者年龄、性别、分期均无统计学差异,具有可比性(P>0.05)。
1.2 方法
试验组:紫杉醇脂质体135 mg/m2静脉滴注,第1天;顺铂 25 mg/m2静脉滴注,第1~3天,紫杉醇脂质体先于DDP使用,紫杉醇脂质体(商品名:力扑素,南京思科药业有限公司生产)。对照组:5-Fu 0.75 mg/m2静脉滴注,第1~5天;顺铂25 mg/m2静脉滴注,第1~3天。2组均 21 d为1周期。初次使用紫杉醇脂质体化疗前30 min分别给予地塞米松10 mg、西咪替丁400 mg静脉注射,苯海拉明40 mg肌注预防过敏治疗,初次用药无过敏反应则第2次以后使用紫杉醇脂质体地塞米松可改为5 mg静脉注射或不用。化疗前血常规、肝肾功能、心电图均正常,体力活动状态(PS)评分<2分,且预计生存期>3个月。每2周期化疗后评价疗效。
1.3 评价标准
参照RECIST实体瘤疗效评定标准,完全缓解(CR):所有目标病灶消失;部分缓解(PR):基线病灶最大径之和至少减少30%;病变进展(PD):基线病灶最大径之和至少增加20%或出现新病灶;病变稳定(SD):基线病灶最大径之和有减少但未达PR或有增加但未达PD;有效率(RR)=CR+PR。毒性反按NCI-CTC毒性标准分0~4级。
1.4 随访
随访时间自化疗结束时开始计算至死亡或随诊结束。疾病进展时间(TTP)从开始本方案治疗的第1天至疾病进展,总生存时间(OS)从开始治疗的第1天至死亡。采用电话随访,每月1次,所有入组病例均未失访。
2 结 果
2.1 疗效
全部共完成126个周期,其中治疗组完成74个周期,对照组完成52个周期。试验组CR 2例,PR 8例,SD 5例,PD 4例,总有效率为 49.65%;试验组CR 0例,PR 5例,SD 6例,PD 8例,总有效率为26.31%。2组组间疗效差异存在统计学意义(P<0.05),见表1。

表1 2组疗效比较[n(%)]
2.2 生存期和疾病进展
试验组中位疾病进展时间(mTTP)4.6个月,中位生存期(mOS)10.3个月;对照组mTTP 3.7个月,mOS 9.2个月。2组生存期无显著统计学意义。
2.3 毒性反应
所有患者均未出现水钠潴留、过敏性休克、心脏损害等严重不良反应,无治疗相关性死亡。出现的主要不良反应为骨髓抑制、胃肠道反应、周围神经毒性及脱发,试验组与对照组相比,2组不良反应无明显差异(P>0.05),见表2。2组患者血清中CA125和CEA含量治疗前差异无统计学意义(P>0.05),治疗后均显著下降(P<0.01),且治疗后观察组的CA125和CEA含量显著低于对照组(P<0.01),见表2。
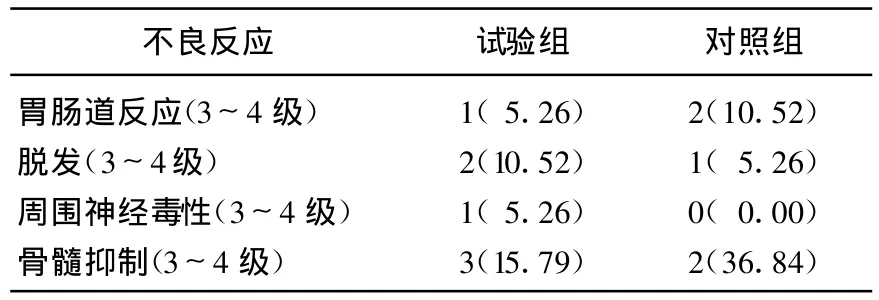
表2 2组不良反应比较[n(%)]
3 讨 论
随着肿瘤基础理论研究的进展,抗癌新药的问世,经过临床研究工作者的不懈努力,使食管癌的临床疗效有了显著的提高,生存时间明显延长。20世纪70年代,食管癌化疗以单药为主,有效率较高的药物有5-Fu、甲氨蝶呤(MTX)、丝裂霉素(MMC)、博来霉素(BLM)、长春碱性类(VDS)等。80年代以DDP+5-Fu的联合方案成为食管癌的标准治疗方案,有效率约25%~35%[3]。DDP和5-Fu联合新药是目前研究的主要方向,紫杉醇(PTX)显示出了良好的单药疗效18%,无论是辅助化疗、同步放化疗,还是晚期姑息化疗,PTX联合DDP/5-Fu方案都是大家公认的疗效较好的方案,有效率在 30%~50%。Zhang等[4]采用PTX、DDP化疗方案治疗食管癌和贲门癌,有效率腺癌为46%,鳞癌为25%。Huang等[5]在晚期食管鳞癌Ⅱ期研究中,方案为PTX+DDP,结果有效率59.3%,中位疾病进展时间5个月,中位生存期9.7个月,Ⅲ、Ⅳ度粒细胞减少在17.9%。国内黄镜等[5]综合分析了国外学者的临床研究结果,认为三药联合(PTX+DDP+5-FU)的疗效并不高于两药联合(PTX+DDP),且毒性反应大,耐受性差。
紫杉醇(PTX)为从紫杉皮中提取后人工半合成,通过促进微管蛋白的集聚,抑制有丝分裂。但紫杉醇在水中几乎不溶,因此其注射剂处方中加入助溶剂聚氧乙基蓖麻油和无水乙醇。助溶剂在体内降解时会引起严重的变态反应。近年来发现,脂质体能够提高难溶药物的水溶性,特别是还能减轻过敏反应的发生,并提高药物穿透肿瘤血管的能力[7]。紫杉醇脂质体静脉给药最大耐受剂量可达200 mg/kg,而其注射制剂的最大耐受剂量仅为30 mg/kg[8]。另外脂质体可延长药物在体内的循环时间[9],同时由于脂质体与细胞膜有类似的磷脂结构[10-11],可增加药物与癌细胞的亲和力,选择性杀伤癌细胞。
本治疗组采用紫杉醇脂质体联合顺铂治疗晚期食管癌,CR10.52%,PR39.13%,RR 49.65%;mT TP 4.6个月,mOS 10.3个月。与Zhang等[4]及Huang等[5]运用紫杉醇联合顺铂治疗晚期食管癌结果相近。紫杉醇脂质体与顺铂联合方案的主要毒性反应是剂量限制性骨髓抑制和脱发、胃肠道反应,其中骨髓抑制以白细胞减少为主,Ⅲ~Ⅳ度骨髓发生率较低,经用粒细胞集落刺激因子治疗后均能恢复正常,不影响下一周期的治疗。紫杉醇脂质体过敏反应少,可减少激素的使用或不需激素预处理,在不降低疗效的前提下副反应相对更少甚至有增加疗效的作用,其临床使用前景更广泛,值得临床进一步推广。
[1]Bader F G,Lordick F,Fink U,et al.Paclitaxel in the neoadjuvant treatment for adeno carcinoma of the distal esophagus(AEG I).A comparison of two phase II trials with long-term follow-up[J].Onkologie,2008,31(7):366.
[2]苏丽,张纬建,洪金省,等.食管癌三种放疗技术的剂量学比较[J].实用临床医药杂志,2010,14(9):37.
[3]Vashi P G,Gupta D,Tan B.Colon Carcinoma with Unusual Metastasis to the Esophagus Manifesting asM ultiple Nodules and Dysphagia:Management with Systemic Chemotherapy[J].Case Rep Gastroenterol,2012,6(2):484.
[4]Zhang X,Shen L,Li J,et al.A phase II trial of paclitaxel and cisplatin in patients with advanced squamous-cell carcinomaof the esophagus[J].Am J Clin Oncol,2008,31(1):29.
[5]Huang J,Cai R G,Meng P J,et al.PhaseⅡ study of paclitaxel and cisplatin for advanced squamous cell carcinoma of esophagus[J].Zhonghua Zhong Liu Za Zhi,2004,26(12):753.
[6]黄镜,蔡锐刚,孟平均,等.紫杉醇联合顺铂治疗晚期食管鳞癌[J].中华肿瘤杂志,2004,26(12):753.
[7]Chen Q,Krol A,Wright A,et al.Tumormicrovascularpermeability is a key determinant for antivascular effects of doxorubicin encapsulated in a temperature sensitive liposome[J].Int J Hyperthermia,2008,24(6):475.
[8]Holvoet C,Vander H Y,Lories G,et al.Preparation and evaluation of paclitaxel-containing liposomes[J].Pharmazie,2007,62(2):126.
[9]赵锐,赵玮玮.抗癌植物药紫杉醇研究进展与动态[J].中草药,2009,7(7):1172.
[10]Strieth S,Eichhorn M E,WernerA,et al.Paclitaxel encapsulated in cationic liposomes increases tumor microvessel leakiness and improves therapeutic efficacy in combination with Cisplatin[J].Clin Cancer Res,2008,14(14):4603.
[11]Campbell R B,Ying B,Kuesters G M,et al.Fighting cancer:from the bench to bedside using second generation cationic liposomal therapeutics[J].J Pharm Sci,2009,98(2):411.

