通心络通过PI-3K/Akt/HIF信号通路改善血管内皮细胞缺氧损伤*
梁俊清, 徐海波, 陈小娟, 邢志军, 尹蓓珮, 吴 琨, 张梓倩, 周丽涛, 吴以岭
(1河北以岭医药研究院,河北 石家庄 050035 ;2承德医学院附属医院,河北 承德 067000;3第二军医大学附属东方肝胆外科医院国际合作生物信号转导研究中心,上海 200438;4上海医药工业研究院, 上海 200040)
1000-4718(2012)05-0846-06
2011-11-21
2012-03-16
国家重点基础研究发展计划(国家973计划)项目(No.2012CB518606;No.2005CB523300);国家自然科学基金青年基金资助项目(No.81102768);十二五科技重大专项重大新药创制课题(No.2011ZX0940-020)
△通讯作者 Tel: 010-59705120; E-mail: liangjunqing1234@163.com
通心络通过PI-3K/Akt/HIF信号通路改善血管内皮细胞缺氧损伤*
梁俊清1△, 徐海波2, 陈小娟1, 邢志军2, 尹蓓珮4, 吴 琨3, 张梓倩1, 周丽涛1, 吴以岭1
(1河北以岭医药研究院,河北 石家庄 050035 ;2承德医学院附属医院,河北 承德 067000;3第二军医大学附属东方肝胆外科医院国际合作生物信号转导研究中心,上海 200438;4上海医药工业研究院, 上海 200040)
目的观察通心络对缺氧血管内皮细胞中缺氧诱导因子(HIF)及其上游信号转导通路PI-3K/Akt的影响,探讨PI-3K/Akt/HIF信号通路在通心络改善血管内皮细胞抗缺氧损伤中的作用。方法将体外培养的人脐静脉血管内皮细胞(HUVECs)分为常氧对照组、通心络组、缺氧组和缺氧+通心络组。采用CCK-8试剂盒检测各组细胞的活性,Western blotting 检测HIF-1α、Bcl-2、Mcl-1、Bax表达变化及Akt的磷酸化情况。利用HIF-1α的显性负性突变体(DN-HIF)瞬时转染HUVECs,流式细胞仪分析细胞的凋亡情况。利用PI-3K和Akt的显性负性突变体瞬时转染HUVECs,探讨PI-3K/Akt信号通路在通心络改善血管内皮细胞抗缺氧损伤中的作用。结果与常氧条件下比较,通心络对缺氧内皮细胞虽有明显的促增殖作用,但程度明显减弱。通心络可显著上调HIF-1α、Bcl-2、Mcl-1蛋白表达水平及Akt磷酸化水平,且下调Bax的表达。利用DN-HIF抑制HIF-1α的活化后,通心络提高缺氧HUVECs活性的程度明显下降,但仍可一定程度上降低细胞凋亡百分率。进一步利用PI-3K显性负性突变体(Δp85)和Akt显性负性突变体(DN-Akt)阻断HIF-1α上游信号通路PI-3K/Akt后,通心络上调缺氧HUVECs HIF-1α蛋白表达的作用明显减弱,促进Akt磷酸化的作用基本消失。结论在缺氧条件下,通心络上调HUVECs HIF-1α蛋白表达水平,促进抗凋亡因子同时抑制促凋亡因子的表达,降低细胞凋亡率,从而提高缺氧细胞的增殖率,这些作用在一定程度上依赖于PI-3K/Akt/HIF通路的活性。
通心络; 缺氧诱导因子; 血管内皮细胞; 信号转导; 缺氧损伤
越来越多的研究表明,在各种心脑血管病的发病过程中均伴有不同程度的缺氧[1]。缺氧诱导因子(hypoxia-inducible factor, HIF)是缺氧条件下活化的一个异源二聚体的重要转录因子,可通过与靶基因上的缺氧反应元件(hypoxia response element,HRE)结合,调节下游靶基因如血管内皮生长因子(vascular endothelial growth factor,VEGF)、促红细胞生成素(erythropoietin,EPO)、葡萄糖转运蛋白(glucose transporters,Glut)等转录,从而产生一系列对缺氧的代偿反应,促进细胞的生长和代谢[2-5]。通心络(Tongxinluo,TXL)为纯中药制剂,到目前为止,已有600多万心脑血管病患者在服用通心络,其能有效改善稳定型心绞痛的发作,提高一氧化氮(nitric oxide, NO)水平、保护超氧化物歧化酶(superoxide dismutase,SOD)、抑制内皮素(endothelin, ET-1)和丙二醛(malondialdehyde, MDA)的产生[6]。VEGF是目前所知的作用最强的血管生成刺激因子,其基因也是HIF-1的重要靶基因。通心络可明显提高反复缺氧小鼠脑组织HIF-1α和VEGF表达,提高小鼠缺氧耐受性[7]。通心络还可明显抑制缺氧引起的血管内皮细胞caspase-3活性增高并减少缺氧所诱导的动脉内皮细胞凋亡[8]。但通心络能否通过影响HIF-1α的表达实现缓解或对抗心脑血管病变中针对缺氧过程带来的损伤尚未见文献报道。本研究以缺氧人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)为模型,通过分析通心络对细胞存活率、凋亡率、HIF-1α及其上游信号转导通路PI-3K/Akt的影响,探讨通心络提高血管内皮细胞抗缺氧损伤能力的分子机制。
材 料 和 方 法
1材料
1.1细胞 HUVECs购于中国典型培养物保藏中心细胞库。
1.2主要试剂 通心络超微粉[9](石家庄以岭药业股份有限公司提供,批号为071201)贮存液的配制:称取一定量的通心络超微粉溶解于无血清DMEM培养基中,超声促溶1 h,6 500×g离心10 min, 收集上清液,应用0.22 μm微孔滤器过滤除菌,同时将所得沉淀于60 ℃条件下加热烘干,计算实际溶解于无血清DMEM培养基中通心络超微粉量,制备成 2 000 mg/L通心络超微粉贮存液,-20 ℃贮存备用,实验前利用无血清DMEM培养基稀释成100 mg/L,作为给药浓度。
2主要方法
2.1实验分组 (1)常氧对照组:于正常条件下进行培养;(2)通心络组:加入含通心络超微粉(终浓度为100 mg/L)在正常培养条件下进行孵育,(3)缺氧组:于95%N2+4% CO2+1% O2条件下培养;(4)缺氧+通心络组:加入含通心络(终浓度为100 mg/L)的无血清DMEM培养基后,在95%N2+4%CO2+1% O2条件下继续培养。
2.2细胞活性的测定 各组分别于缺氧0 h、12 h、24 h、48 h后测定细胞活性,采用CCK-8检测试剂盒检测,操作严格按照说明书进行。
2.3瞬时转染 将生长良好的HUVECs以2.5×105cells/well的密度接种于10 cm培养皿中,在37 ℃、CO2培养箱中培养至80%~90%铺满时,开始实验,实验分为8组:(1)质粒对照组(GFP组);(2)GFP+TXL组;(3)DN-HIF组;(4)DN-HIF+TXL组;(5)Δp85组;(6)Δp85+TXL组;(7)DN-Akt组;(8)DN-Akt+TXL组。各组均按jetPEI转染试剂盒的说明书以5 μg显性负性突变体 GFP、DN-HIF、Δp85和DN-Akt分别进行转染,12 h后,换完全培养液继续培养,24 h后,(2)、(4)、(6)、(8)组分别加入含通心络(终浓度为100 mg/L)的无血清DMEM培养基与其余各组在95%N2+4% CO2+1% O2条件下进行培养。
2.4HIF-1α、Bcl-2、Mcl-1、Bax及磷酸化Akt表达的测定 采用Western blotting 检测目的蛋白的表达。将生长良好的HUVECs以2×105cells/well接种于6孔培养板,37 ℃进行培养。待细胞生长至70%~80%铺满时,以含0.1% FBS的DMEM继续培养24 h。处理的细胞及对照细胞经预冷的PBS洗涤后,用细胞裂解液于4 ℃裂解5 min。将全细胞裂解产物经30×2 s超声后进行蛋白定量。取30 μg蛋白进行SDS-PAGE并转印至硝酸纤维素膜上,用HIF-1α、Bcl-2、Mcl-1、Bax及磷酸化Akt相应的特异性Ⅰ抗[HIF-1α(1∶1 000)和p-Akt(1∶1 000)单克隆抗体由Santa Cruz提供]进行识别后,以相应的荧光Ⅱ抗和ECF 蛋白印迹分析仪检测目的蛋白。
2.5细胞凋亡百分率的测定 各组分别于缺氧0 h、12 h、24 h、48 h后测定细胞凋亡率。收集各组细胞,PBS洗2次,70%乙醇固定30 min,PBS洗1次,悬浮于50 μL中,加RNase(2 mL/L)37 ℃、30 min,加PI(10 mg/L)避光染色40 min,过滤。以流式细胞仪(EPICS ELITE ESP)分析凋亡细胞百分比。
3统计学处理

结 果
1通心络对缺氧内皮细胞活性的影响
与常氧对照组比较,应用通心络(100 mg/L)孵育内皮细胞后,随着时间的延长,其活性呈上升趋势;与常氧条件下比较,缺氧组内皮细胞活性显著降低,通心络干预后各个时点的细胞活性有所增加,以24 h效果最显著,见表1。
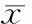
表1 各组内皮细胞活性的变化
*P<0.05,**P<0.01vscontrol group;△P<0.05vshypoxia group.
2HIF对通心络改善细胞活性的影响
与质粒对照组比较,阻断HIF的表达后,缺氧内皮细胞的活性显著下降,同时通心络提高HUVECs活性的程度随之明显下降,见图1。
3通心络对HIF-1α表达及Akt磷酸化水平的影响
Western blotting结果显示,与对照组比较,缺氧组HIF-1α的表达呈现一定程度升高,p-Akt明显下调。与缺氧组比较,通心络处理后的缺氧内皮细胞HIF-1α蛋白水平进一步显著上调,Akt磷酸化水平明显升高,见图2。
4PI-3K/Akt信号通路对通心络上调HIF-1α表达的影响
与对照质粒组比较,HUVECs细胞瞬时转染Δp85后,再应用通心络干预,HIF-1α蛋白被诱导的程度明显受抑。瞬时转染DN-Akt后,通心络对HIF-1α蛋白表达的诱导程度同样明显减弱,见图3。
5HIF-1α对通心络改善细胞凋亡率的影响
与常规缺氧对照组比较,利用DN-HIF抑制HIF的表达后,缺氧内皮细胞的凋亡率显著升高,利用通心络处理后,其降低细胞凋亡率的程度较通心络处理后的常规缺氧组明显减弱,见表2。


图1HIF表达下调后各组细胞活性的变化


图2各组细胞HIF-1α及Akt磷酸化水平的变化
6通心络对凋亡相关因子Bcl-2、Mcl-1和Bax表达的影响
免疫印迹检测结果显示,与对照组比较,缺氧组Bcl-2表达显著下调,而Bax表达明显上调。与缺氧组比较,通心络处理后的缺氧内皮细胞Bcl-2和Mcl-1显著上调,而Bax明显下调,见图4。
讨 论
通心络是近些年来在临床上广泛应用于治疗心脑血管病的复方中药[10]。大量的研究表明,在各种心脑血管病的发病过程中均伴有不同程度的缺氧过程。复方中药通心络能否缓解或对抗缺氧给血管内皮细胞带来的损伤尚未见报道。在本研究中,我们探讨了通心络提高血管内皮细胞在缺氧条件下抗缺氧损伤能力的机制,研究结果证实,通心络可依赖PI-3K/Akt/HIF依赖的信号通路上调血管内皮细胞中HIF的表达,进而提高血管内皮细胞抗缺氧损伤的能力。
HIF-1最先由Semenza等[11]在缺氧诱导的Hep3B细胞核提取物中发现,是一种DNA结合性蛋白质分子,能与EPO和VEGF基因的3′增强子序列结合,促进其转录,发挥血管保护作用,缺血缺氧时HIF-1的表达被认为是内源性保护机制的始动因子和共同途径[12]。另有研究表明,HIF-1α能在缺氧的心肌组织内聚集并被激活,通过诱导血管生成和调节能量代谢等途径,增强心肌细胞抵抗缺氧缺血损伤的能力[13]。在缺氧条件下,通心络能否通过上调HIF 的表达提高血管内皮细胞抗缺氧损伤能力尚未见报道。本研究结果显示,与常氧条件下比较,应用通心络处理缺氧内皮细胞其增殖活性显著升高,但较常氧条件下促细胞增殖的程度明显减弱。进一步研究结果显示,利用HIF的显性负性突变体下调HIF 的表达后,缺氧内皮细胞的增殖活性进一步显著下降,通心络提高HUVEC增殖活性的程度随之明显降低,提示通心络改善血管内皮细胞抗缺氧损伤能力的机制对HIF 的表达具有一定程度的依赖性。


图3PI-3K/Akt信号通路对通心络上调HIF-1α表达的影响
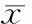
表2 HIF对缺氧内皮细胞凋亡百分率的影响
*P<0.05,**P<0.01vshypoxia group;△P<0.05,△△P<0.01vshypoxia+DN-HIF group.


图4通心络对缺氧内皮细胞凋亡相关分子Bcl-2、Mcl-1和Bax表达的影响
有研究报道,转染具有持续活性的HIF-1α至肾内后,可保护肾脏对抗缺血所造成的损伤[14]。另有研究发现,激活并促进Akt磷酸化可导致细胞内发生变化,从而促进细胞存活[15]。通心络能否进一步提高缺氧条件下HIF-1α及Akt磷酸化表达水平,进而提高内皮细胞对抗缺氧损伤能力尚未见报道。本研究结果显示,与常氧对照组比较,缺氧组HIF-1α的表达呈现一定程度的升高,而磷酸化Akt则明显下调。与缺氧组比较,通心络处理后的缺氧内皮细胞HIF-1α蛋白水平表达进一步显著上调,同时Akt磷酸化水平明显升高。结合已有的研究报道,提示通心络提高缺氧血管内皮细胞的存活率与HIF-1α及Akt磷酸化表达水平可能具有一定关系。
文献报道,缺氧诱导因子HIF的活化还与PI-3K/Akt信号通路有关[16-17],PI-3K/Akt信号通路可激活一系列生长信号通路,阻断一系列凋亡信号通路[18],从而促进细胞的增殖活性。PI-3K/Akt与HIF-1α之间关系非常密切[19]。Chen等[20]应用PI-3K抑制剂Ly294001抑制肾上皮细胞中PI-3K的活性后,HIF的表达明显受到抑制。本研究发现利用Δp85和DN-Akt抑制PI-3K/Akt信号通路后,通心络对HIF蛋白表达水平的上调作用被明显抑制,提示通心络对HIF表达的诱导作用在一定程度上是通过激活PI-3K/Akt信号通路实现的。
细胞凋亡可能是细胞缺氧导致损伤的主要原因之一[21]。通心络能否通过抗凋亡作用实现对缺氧内皮细胞的保护也是本研究所要解决的主要问题。本研究结果显示,与常氧对照组比较,缺氧组Bcl-2表达显著下调,而Bax表达明显上调。通心络处理后的缺氧组细胞Bcl-2和Mcl-1被显著诱导上调,而Bax显著下调,流式细胞仪检测结果进一步证实,与常氧对照组比较,缺氧内皮细胞其凋亡率显著升高,应用通心络处理后,其凋亡百分率明显降低,进一步研究显示,利用DN-HIF抑制HIF-1α的表达后,内皮细胞的凋亡率显著升高,利用通心络处理后,其降低细胞凋亡率的程度较通心络处理后的常规缺氧组明显减弱,综合比较提示,通心络对缺氧内皮细胞具有明显的抗凋亡作用,而该作用对HIF-1α具有一定程度的依赖性。
综上所述,在缺氧条件下,进一步上调HIF蛋白表达水平,促进抗凋亡因子同时抑制促凋亡因子的表达,提高缺氧细胞的增殖活性,降低细胞凋亡率可能是通心络提高血管内皮细胞对抗缺氧损伤的分子机制之一,而通心络对PI-3K/Akt通路的激活则是缺氧条件下其进一步上调HIF的信号转导机制之一。值得一提的是,目前的研究证明: HIF-1活性至少在mRNA水平、蛋白质水平和HIF-1二聚化水平调节,其中最主要发生在蛋白质水平,即通过HIF-1α蛋白的羟化、乙酰化、磷酸化的调节和信号转导途径来提高蛋白质的稳定性和增强其转录活性[22]。通心络能否通过上述环节发挥上调HIF作用而提高细胞耐缺氧能力,值得进一步研究。
[1] Resar JR, Roguin A, Voner J, et al. Hypoxia-indu-cible factor 1α polymorphism and coronary collaterals in patients with ischemic heart disease[J]. Chest,2005, 128(2):787-791.
[2] Kaur C, Sivakumar V, Lu J, et al. Increased vascular permeability and nitric oxide production in response to hypoxia in the pineal gland[J]. J Pineal Res,2007, 42(4):338-349.
[3] Semenza GL. Regulation of mammalian O2homeostasis by hypoxia-inducible factor 1[J]. Ann Rev Cell Dev Biol, 1999, 15(1):551-578.
[4] Goldberg MA,Dunning SP,Bunn HF. Regulation of the erythropoietin gene: evidence that the oxygen sensor is a heme protein[J]. Science, 1988, 242(4884): 1412-1415.
[5] Semenza GL,Nejfelt MK,Chi SM, et al. Hypoxia-inducible nuclear factors bind to an enhancer element located 3’ to the human erythropoietin gene[J]. Proc Natl Acad Sci U S A, 1991, 88(13):5680-5684.
[6] 钱孝贤, 陈燕铭, 刘 勇, 等. 通心络治疗稳定型心绞痛的临床疗效及对内皮功能的影响[J]. 中国病理生理杂志, 2006, 26(9):2698-2701.
[7] 吴相春, 吴相锋, 贾振华, 等. 通心络对小鼠反复缺氧耐受性的影响[J]. 中华医学杂志, 2010, 90(22):1571-1573.
[8] 曾和松, 刘正湘, 马业新. 通心络抑制缺氧诱导的血管内皮细胞凋亡及机制研究[J]. 中国实验方剂学杂志, 2004, 10(3):27-30.
[9] Chen WQ, Zhang L, Ji XP, et al. Chinese medicine tongxinluo significantly lowers serum lipid levels and stabilizes vulnerable plaques in a rabbit model[J]. J Ethnopharmacol,2009,124(1):103-110.
[10]陈燕铭, 吴 琳, 刘 勇, 等. 通心络对同型半胱氨酸损伤的内皮细胞的基因表达谱的影响[J]. 中国病理生理杂志, 2011, 27(1):42-47.
[11]Semenza GL, Wang GL. A nuclear factor induced by hypoxia via de novo protein synthesis binds to the human erythropoietin gene enhancer at a site required for transcriptional activation[J]. Mol Cell Biol, 1992, 12(12):5447-5454.
[12]张昱, 吉训明, 李文斌, 等.低氧诱导因子在脑缺血中的双重作用[J]. 中国病理生理杂志, 2009, 25(1):197-200,204.
[13]唐彬轶, 屈 艺, 母得志. 缺氧诱导因子1α在缺氧缺血性损伤中的研究进展[J]. 中国修复重建外科杂志,2009, 23(6):755-758.
[14]Manotham K, Tanaka T, Ohse T, et al. A biologic role of HIF-1 in the renal medulla[J]. Kidney Int, 2005, 67(4):1428-1439.
[15]Wick A, Wick W, Waltenberger J, et al. Neuroprotection by hypoxic preconditioning requires sequential activation of vascular endothelial growth factor receptor and Akt[J]. J Neurosci, 2002, 22(15): 6401-6407.
[16]Sakamoto N, Ishibashi T, Sugimoto K, et al. Role of LOX-1 in monocyte adhesion-triggered redox, Akt/eNOS and Ca2+signaling pathways in endothelial cells[J]. J Cell Physiol,2009,220(3):706-715.
[17]Kobayashi N,Mita S,Yoshida K, et al. Celiprolol activates eNOS through the PI3K-Akt pathway and inhibits VCAM-1 via NF-κB induced by oxidative stress[J]. Hypertension,2003, 42(5):1004-1013.
[18]符江琳, 刘承云, 徐 晓, 等. Gas6经PI3K/Akt 通路对缺氧复氧诱导H9c2细胞凋亡的影响[J]. 中国病理生理杂志, 2011, 27(8):1508-1512.
[19]Patten DA, Lafleur VN, Robitaille GA, at al. Hypoxia-inducible factor-1 activation in nonhypoxic conditions: the essential role of mitochondrial-derived reactive oxygen species[J]. Mol Biol Cell, 2010, 21(18):3247-3257.
[20]Chen TH,Wang JF,Chan P, et al. Angiotensin II stimulates hypoxia-inducible factor 1α accumulation in glomerular mesangial cells[J]. Ann N Y Acad Sci,2005, 1042(1):286-293.
[21]焦向英, 罗 宁, 赵荣瑞. 预缺血对大鼠心肌缺血再灌注凋亡的影响[J]. 中国动脉硬化杂志, 2002, 10(1): 41-44.
[22]王 静, 戴爱国. 多种翻译后修饰对低氧诱导因子-1α稳定性调控的机制[J]. 中国生物化学与分子生物学报, 2011, 27(10):914-919.
Tongxinluoimprovesanti-hypoxiaabilityofvascularendothelialcellsviaPI-3K/Akt/HIFpathway
LIANG Jun-qing1, XU Hai-bo2, CHEN Xiao-juan1, XING Zhi-jun2, YIN Bei-pei4, WU Kun3, ZHANG Zi-qian1, ZHOU Li-tao1, WU Yi-ling1
(1HebeiYilingPharmaceuticalResearchInstitute,Shijiazhuang050035,China;2AffiliatedHospitalofChengdeMedicalCollege,Chengde067000,China;3InternationalCooperationLaboratoryonSignalTransduction,EasternHepatobiliarySurgeryHospitalAffiliatedtoSecondMilitaryMedicalUniversity,Shanghai200438,China;4ShanghaiInstituteofPharmaceuticalIndustry,Shanghai200040,China.E-mail:liangjunqing1234@163.com)
AIM: To investigate the effects of PI-3K/Akt/HIF pathway on anti-hypoxia ability of vascular endothelial cells influenced by Tongxinluo under hypoxic condition.METHODSHuman umbilical vein endothelial cells (HUVECs) were divided into the following groups: control group, Tongxinluo (100 mg/L) group, hypoxia group and hypoxia+Tongxinluo (100 mg/L) group. The CCK-8 assay were used to detect the viability and proliferation rate of the cells in each group. The protein levels of HIF-1α, Bcl-2, Mcl-1, Bax and phosphorylated Akt were studied by immunoblotting analysis. The HUVECs were transiently transfected with the dominant negative mutant of HIF-1α (DN-HIF). The apoptotic rates were analyzed by flow cytometry (FCM). The HUVECs were transiently transfected with the dominant negative mutant of PI-3K (Δp85) or Akt (DN-Akt) to investigate the role of PI-3K/Akt signal pathway in the anti-hypoxia ability of Tongxinluo on endothelial cells.RESULTSUnder hypoxic condition, although the proliferation rate increased significantly in Tongxinluo group compared with hypoxia group, the degree was notably weak compared with control group. The protein levels of HIF-1α, Bcl-2, Mcl-1 and phosphorylated Akt were up-regulated by Tongxinluo. Meanwhile, the expression of Bax was down-regulated. Inhibition of HIF-1α activation by DN-HIF and inhibition of the PI-3K/Akt pathway by Δp85 or DN-Akt attenuated the increase in HIF-1α expression and HUVEC viability induced by Tongxinluo. The percentage of apoptotic HUVECs was down-regulated to a certain extent by Tongxinluo.CONCLUSIONTongxinluo improves the anti-hypoxia ability of vascular endothelial cells by up-regulating the protein level of HIF-1α, promoting the expression of anti-apoptotic factors, improving the cell viability and eventually reducing the apoptotic rate.These effects of Tongxinluo depend on PI-3K/Akt signal pathway.
Tongxinluo; Hypoxia-inducible factor; Vascular endothelial cells; Signal transduction; Hypoxic injury
R363
A
10.3969/j.issn.1000-4718.2012.05.014

