HA/ZrO2不同复合材料对MSCs贴壁、增殖及成骨分化影响的差异*
全仁夫, 汤样华, 杨迪生, 黄忠名, 李 伟, 徐金渭, 吴晓春
(1萧山区中医院骨科,浙江 杭州 311200;2浙江大学附属第二医院骨科,浙江 杭州 310009;3上海大学材料学院, 上海 200072)
1000-4718(2012)05-0777-08
2011-11-13
2012-02-09
浙江省医学科研基金资助项目(No.2007A170);杭州市科技发展计划项目(No.20080333B23)
△通讯作者 Tel: 0571-82727212;E-mail:quanrenf@263.net
HA/ZrO2不同复合材料对MSCs贴壁、增殖及成骨分化影响的差异*
全仁夫1△, 汤样华1, 杨迪生2, 黄忠名1, 李 伟1, 徐金渭1, 吴晓春3
(1萧山区中医院骨科,浙江 杭州 311200;2浙江大学附属第二医院骨科,浙江 杭州 310009;3上海大学材料学院, 上海 200072)
目的观察间充质干细胞(MSCs)在不同生物材料表面的生长及成骨分化情况。方法采用干铺法制备氧化锆(ZrO2)单层复合羟基磷灰石(HA)及ZrO2梯度复合HA 两种复合材料,观察复合材料表面形貌特征。分离和培养兔MSCs,分别培养于HA/ZrO2单层复合材料、HA/ZrO2梯度复合材料、纯HA及ZrO2材料薄片上,观察细胞贴壁、增殖情况和碱性磷酸酶活性,提取细胞总RNA并检测Ⅰ型胶原、骨钙蛋白和骨桥蛋白mRNA 表达情况。结果制备的HA/ZrO2单层复合材料具有不连续的HA表面层,可以清晰地观察到部分ZrO2基体。而HA/ZrO2梯度复合材料表面较为粗糙,呈多孔状。X射线衍射分析显示,经高温烧结后,两种复合材料表面的ZrO2相依旧存在,HA相转变为β-Ca3(PO4)2(β-TCP)、α-Ca3(PO4)2(α-TCP)和CaZrO3相。细胞培养显示,HA/ZrO2梯度复合材料更有利于细胞贴壁。细胞在纯HA上碱性磷酸酶活性较其它组显著升高;细胞在复合材料和纯HA上Ⅰ型胶原、骨钙蛋白和骨桥蛋白表达较对照组均有不同程度升高,其中Ⅰ型胶原表达升高更为明显。结论HA/ZrO2梯度复合材料可促进MSCs的增殖,并可促进MSCs的成骨分化。
氧化锆; 羟基磷灰石类; 间充质干细胞
在组织工程骨构建过程中,通常将种子细胞种植到支架材料表面以达到更好地修复骨缺损。细胞与支架共培养过程中,细胞将在支架表面增殖及分化。羟基磷灰石(hydroxyapatite,HA)由于其良好的生物相容性及骨传导性而被用做组织工程骨的支架材料[1]。而以支架材料复合种子细胞构建的组织工程骨较传统的填充材料在修复程度、修复速度、新生骨形态等方面具有更多的优越性[2]。我们之前研制了一种新型的支架材料——HA/氧化锆(zirconium oxide,ZrO2)复合材料,现拟探究此种复合材料对目前常用的种子细胞——间充质干细胞(mesenchymal stem cells, MSCs)的生长增殖及成骨分化的影响。为此新型复合支架材料的进一步研究提供科学依据,为该复合支架的临床应用奠定理论基础。
材 料 和 方 法
1动物
健康新西兰兔,6月龄新西兰兔30只,雌雄不分,体重约2.5~3.0 kg。浙江大学实验动物中心提供。
2主要试剂
淋巴细胞分层液购自上海生化试剂厂;RPMI-1640培养液购自Gibco;胎牛血清DMEM培养液购自杭州四季青生物公司;PrimeScript RT reagent kit试剂盒购自TaKaRa;MTT试剂盒购自碧云天公司;Giemsa染液购自上海生化试剂公司。
3方法
3.1HA/ZrO2复合材料的制备 HA/ZrO2复合材料分为ZrO2单层复合HA(以下简称单层复合)和ZrO2梯度复合HA(以下简称梯度复合)2种,使用干铺法制备。单层复合生物材料的制备方法:在钢模中先铺上一层HA料粉,再铺上ZrO2料粉,最后在ZrO2料粉表面再对称平铺一层HA料粉。梯度复合生物材料的制备方法:在ZrO2基体上下表面由表及里分别对称平铺上按不同比例的纳米HA粉体与纳米ZrO2粉体混合而成的粉料(表1),形成纯HA到HA+ZrO2逐层过渡,再到ZrO2基体的梯度过渡层。将料粉按不同规格在钢模中逐层平铺好后,使用液压式万能力学测试实验机,在设定的成型压力单向干压,形成素坯。将素坯放在刚玉坩埚中,置于立式硅钼棒炉内,1 600 ℃无压烧结3 h,随后对烧结体采用慢冷的方式冷却,即让其在炉内自然冷却后取出。
3.2性能测试 应用D/max-2550 X射线衍射仪分析粉体以及复合材料的相组成。用HITACHI S-570扫描电子显微镜(scaning electron microscope,SEM)观察了复合材料表面及其断口截面的形貌。
表1HA/ZrO2复合材料不同比例粉体的配方设计
Table 1. The recipe formulation of the different proportion of the composite particles
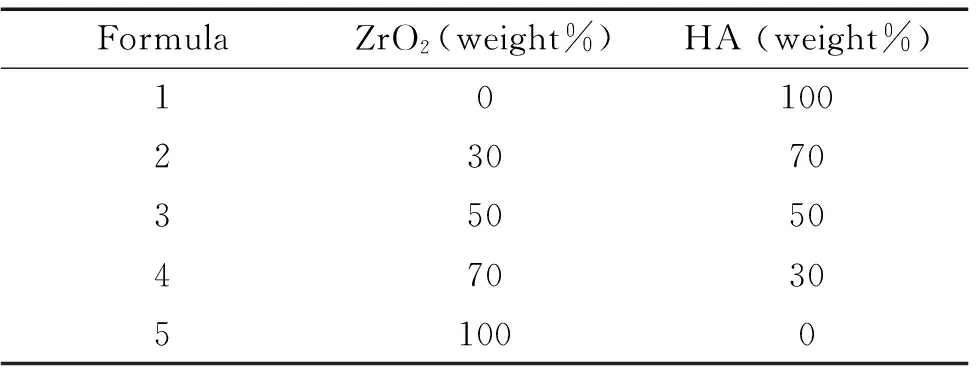
FormulaZrO2(weight%)HA(weight%)1010023070350504703051000
用EDAX能谱仪对梯度复合材料截面的Zr、Ca两元素沿复合层厚度方向上的分布做了线扫描分析。弯曲强度采用济南试验机厂制造的WDW-100A电子式万能试验机测得(根据国家标准GB 6569-86,加载速度为0.5 mm/min,跨距为30 mm)。复合材料的表面粗糙度使用FTSS4c触针式表面粗糙度轮廓测量仪测试(根据国家标准GB 10610-1998,高频滤波,λc/λs=300/1)。
3.3MSCs的分离、培养及鉴定 新西兰兔经3%戊巴比妥钠1.5 mL/kg 麻醉后,以8%硫化钠去除胫骨近端被毛。术野经碘伏及75%乙醇消毒后,以骨髓穿刺针从胫骨结节外侧穿刺,穿刺针旋转刺入髓腔,接5 mL注射器(注射器内预留肝素钠2 000 U),抽取骨髓液3~4 mL。吸出的骨髓液缓慢注入预先加入4 mL淋巴细胞分层液的试管内,密度梯度离心,2 500 r/min离心30 min, 离心后吸取中间的单个核细胞层,PBS洗1次,以3×105/cm2的密度接种于25 cm2培养瓶内,加15%胎牛血清DMEM培养液3 mL(含青霉素钠1×105U/L,链霉素100 g/L,pH 7.2~7.4),5%CO2、37 ℃培养。3~5 d后半量换液。继续培养且全量每周换液2次。待细胞长满底面后, 用0.25%胰酶消化5 min,即得到原代MSCs悬液,再以1×104/cm2的密度传代培养。
3.3.1绘制细胞生长曲线图 从第1 d起,取贴壁细胞消化成单细胞悬液后,每天各取3孔计数,每孔计数3次,计算均值,连续6 d,描绘生长曲线。观察骨髓间充质干细胞生长状况。
3.3.2流式细胞术鉴定 取培养的骨髓间充质干细胞,经2.5 g/L胰蛋白酶和1 mmol/L EDTA消化后,加入含1%小牛血清的PBS,调整细胞浓度至1×1010/L,分别加入小鼠抗大鼠CD45-PE、CD54-PE和CD90-FITC单克隆抗体, 4 ℃孵育30 min,PBS清洗后进行流式细胞术分析鉴定。
3.4细胞培养 将灭菌的、直径为20 mm的HA/ZrO2复合材料置于内径为21 mm的12孔板中。以普通孔板底面为对照。以5×103/cm2的密度将MSCs分别种植在HA/ZrO2单层复合、HA/ZrO2梯度复合、纯HA与纯ZrO2材料上,加入诱导培养液(含10 mmol/L β-磷酸甘油、50 g/L α-维生素C和100 nmol/L地塞米松)进行诱导培养。每3 d更换培养液。
3.5细胞贴壁和增殖评定
3.5.1细胞贴壁率的定量评定 于培养6、12和24 h后,弃去培养液及未贴壁细胞,PBS洗涤细胞样本,以1 mmol/L EDTA和0.25%胰酶解离细胞。以血细胞计数板计数。细胞贴壁率以贴壁细胞数量占初始种植细胞数量的百分比表示。
3.5.2细胞增殖评定(MTT 法) 细胞培养1、3、5、7 d后分别行MTT检测。每孔加入MTT(5 g/L)100 μL,培养3 h,弃上清,加入200 μL DMSO,振荡12 min,取上清200 μL至96孔板,酶联免疫检测仪测定490 nm的吸光度(A)值。
3.6碱性磷酸酶(alkaline phosphatase, ALP)活性测定 将待检样本每孔加入2%Triton X-100 400 μL于 4 ℃冰箱过夜以裂解细胞。取细胞裂解液与无色对硝基苯基磷酸钠反应,生成黄色对硝基苯酚,于405 nm处测定吸光度(A)值,并与标准比对计算酚生成量。以酚生成量(mg)与相应总蛋白含量之比定义ALP活性。测定重复4次。
3.7总RNA提取及RT-PCR 细胞样本经PBS清洗3遍,吸尽PBS。加1 mL Trizol,吹打均匀,室温放置5 min。加入0.2 mL氯仿/mL Trizol,振荡15 s,室温放置8 min。后4 ℃、12 000×g离心15 min。吸取上层水相,加入0.5 mL异丙醇/mL Trizol,室温放置20 min。于4 ℃、12 000×g离心10 min,弃上清。加入1 mL 75%乙醇/mL Trizol, 4 ℃、8 000×g离心5 min,吸尽上清乙醇,室温敞口干燥10 min, RNase-free水20 μL重溶,于核酸蛋白定量仪测定A值。RT-PCR反应体系配方: 2~5 μL cDNA,1 μL引物A(10 μmol/L),1 μL引物B(10 μmol/L),2.5 μL 10×PCR buffer,3 μL MgCl2(25 mmol/L),0.25 μL 5 U/μL Taq Plus Ⅰ(DNA聚合酶)及适量灭菌水使反应体系总体积为25 μL。引物序列见表2。PCR仪设置条件:94 ℃ 2 min预变性,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30~35个循环,4 ℃ 暂停1 h。电泳后以Image-Pro Plus软件分析条带面积及灰度,并计算二者乘积以IA表示。
3.8ELISA法检测成骨标志蛋白 裂解液中成骨标志蛋白I型胶原(collagen I)、骨钙蛋白(osteocalcin)和骨桥蛋白(osteopontin)含量使用ELISA方法检测(RapidBio Lab)。检测方法参照说明书。将100μL细胞裂解液加入抗I型胶原、骨钙蛋白和骨桥蛋白抗体分别包被的96孔板中,并在室温下孵育1 h。在用PBS充分冲洗后,将100 μL基质液加入孔板,并在室温条件下孵育15 min。随后,加入100 μL酸性终止液。在450 nm下测量A值,并与标准曲线比较。各种标志蛋白含量用总蛋白含量标准化。实验重复4次。

表2 RT-PCR引物序列
4统计学处理
结 果
1复合材料的SEM分析
图1显示HA/ZrO2单层复合材料具有不同的表面形貌,图1A为不连续的HA表面层,可以清晰地观察到部分ZrO2基体;而图1B中的HA表面层几乎连续地覆盖在ZrO2基体上。从图1可见,复合材料的表面较为粗糙,而粗糙的表面有利于其在生物体内与周围组织的结合,能为新生的生物组织长入提供有利条件[2],从而提高复合材料的生物相容性。
HA/ZrO2梯度复合材料的表面见图2。HA/ZrO2梯度复合材料的表面较为粗糙,且表面是多孔状的,分布着大小为2~25 μm的孔洞。孔洞深浅不一,呈连通状。

Figure 1. Scaning electron micographs of the surface of HA/ZrO2monolayer composite(×1 000).A:discontinuous HA surface;B:continuous HA surface.
图1HA.ZrO2单层复合材料表面扫描电镜照片

Figure 2. Scaning electron micographs of the surface of HA/ZrO2gradient composite (A:×300;B:×1 500).
图2HA/ZrO2梯度复合材料表面扫描电镜照片
图3为HA/ZrO2梯度复合材料断口截面的SEM结果。图3A显示,表面层的厚度大约100 μm,并且较好地附着在基体上,芯部基体组织与表面层均匀过渡结合,没有明显界面,相互之间是冶金结合。图3B显示线扫描结果,受断口表面结构高低起伏的影响,Zr、Ca元素含量的线分布起伏较大。但仍可见在基体部分,Zr元素维持在相对稳定的值,而过渡到表
面层后,Zr元素减少到基线。相反,基体部分的Ca元素维持在基线,而到表面层后,Ca元素突然增加到了一个稳定的高值。由此判断,断口的芯部基体组织为ZrO2,不含有HA;而断口表面层组织为HA,不含有ZrO2。
图3C、D分别为断口基体和表面层的放大SEM照片。由断口基体的照片观察发现断口基体较为粗糙,呈现出明显的凹凸不平状,多为沿晶断裂,韧性断裂,表示基体材料的致密度较高,韧性佳。基体材料ZrO2晶粒较细小、均匀,由于ZrO2独特的增韧机制,使得复合材料基体部分表现出良好的机械性能。而组织为HA的断口表面较为平整,断面上气孔分布少,HA层晶粒粗大,断口为脆性断裂,表示HA表面层为脆性材料,强度低,力学性能较差。在高韧性的ZrO2基体表面复合HA,能够将基体材料优良的力学性能和HA的生物活性相结合,提高其综合性能。
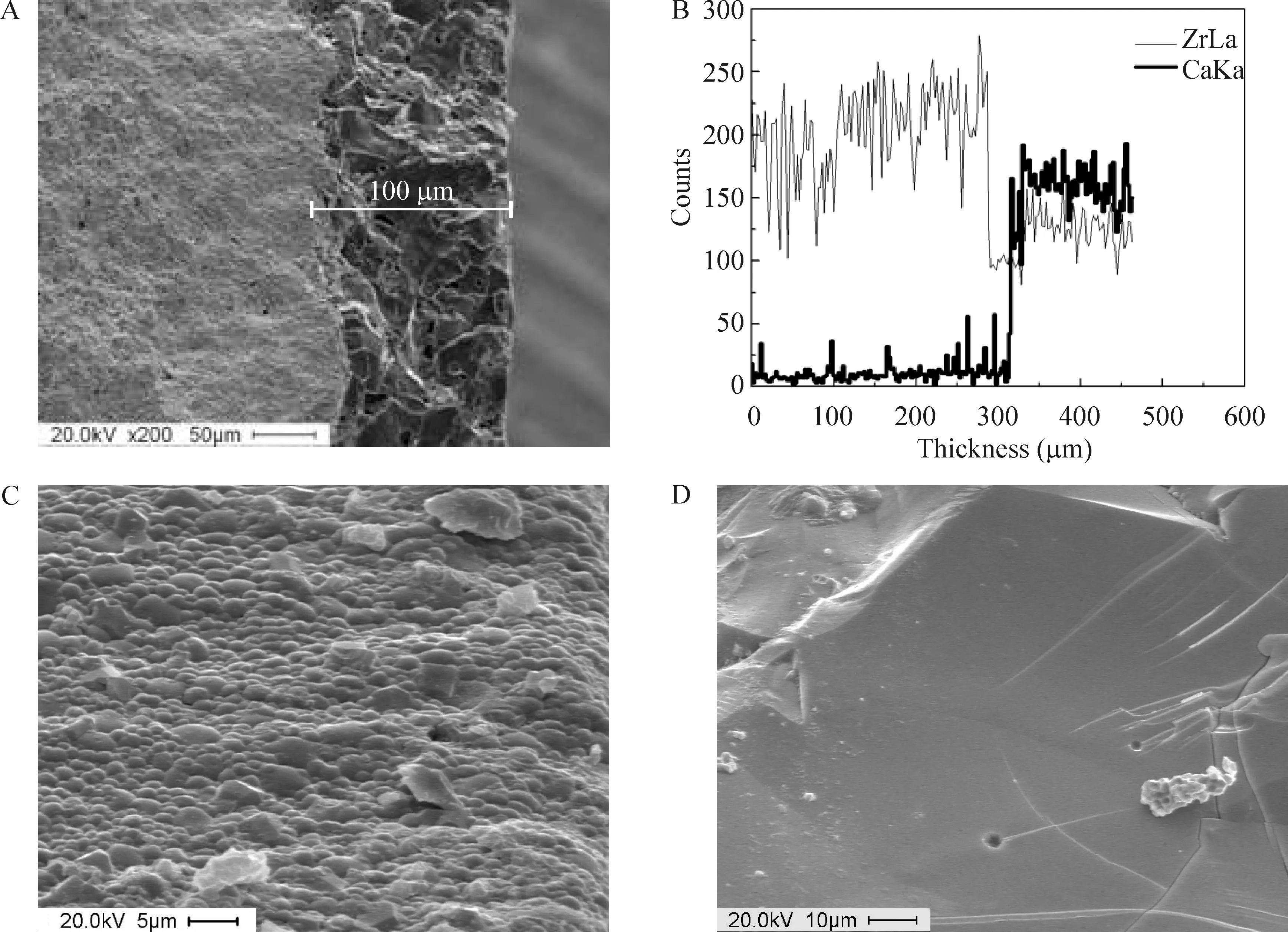
Figure 3. Scaning electron micrographs of the fracture surface of HA/ZrO2gradient composite.A: fractured composite(×200); B:line scaning of Zr and Ca in A; C: base of the fracture section(×2 000); D: surface of the fracture section(×1 000).
图3HA/ZrO2梯度复合材料断口的扫描电镜照片
2复合材料的表面粗糙度测试
成骨细胞的附着和增殖能力随着表面粗糙度的升高而增强,当表面粗糙度大时(Ra>1.5 μm时),有利于成骨细胞的附着和增殖。本次测试结果表明,单层复合材料的表面粗糙度为3.12 μm,梯度复合材料的表面粗糙度为1.95 μm。该粗糙度对于成骨细胞的长入是有利的[3]。
3复合材料的X射线衍射(X-raydiffraction,XRD)分析
通过复合材料表面的XRD可以观测到,在1 600 ℃烧结后,复合材料表面的ZrO2相依旧存在,而HA相消失。HA相转变为β-Ca3(PO4)2(β-TCP)、α-Ca3(PO4)2(α-TCP)和CaZrO3相,见图4。这是因为在HA转变为β-TCP的过程中,释放出了CaO。在复合材料表面的XRD中并未发现CaO,这是由于CaO完全溶解于ZrO2,并在ZrO2相中稳定,两者相互反应生成 CaZrO3。复合材料烧结后,β-TCP相的出现是由于六方晶型的HA结构增强效应的结果。少量α-TCP相则是由β-TCP转变而来的。
上述反应可以用如下反应式来表达:Ca10(PO4)6(OH)2⟺3β-Ca3(PO4)2+CaO+H2O;CaO+ZrO2⟺CaZrO3;β-Ca3(PO4)2⟺α-Ca3(PO4)2。
与纯HA相比,β-TCP在人体液中具有更好的溶解性、良好的生物降解性、生物相容性和骨引导能力,已经应用于骨组织修复。
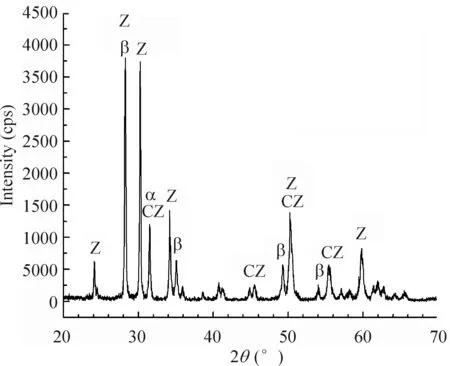
Figure 4. The XRD pattern of the surface of an HA/ZrO2composite sintered at 1 600 ℃. Z: ZrO2; CZ: CaZrO3; α: α-Ca3(PO4)2; β: β-Ca3(PO4)2.
图41600℃烧结后复合材料表面的XRD图
为了更好地定性界面上是否有新的物质产生,将剥落后的试样界面进行XRD测试,如图5所示,黑色线是典型的HA分解产物的曲线,而烧结后的界面(红色线)明显改变,对比标准卡片,在30.0°、34.7°、50.0°和59.4°处出现了CaZrO3的峰。另外,对比可以发现,TCP峰明显减少,并且峰强明显减弱,说明在界面处TCP的含量较少。
4复合材料的力学性能
表3中单层复合和梯度复合两种复合材料的平
均抗弯强度分别为732.85 MPa与689.04 MPa。该值明显高于纯HA的50~150 MPa,也高于传统的ZrO2和HA粉体混料烧结制备的复合材料[4]。可见,以ZrO2和HA相复合的方法,制备的材料能使HA增强,有望满足人体承重部位的人工种植体的力学要求。
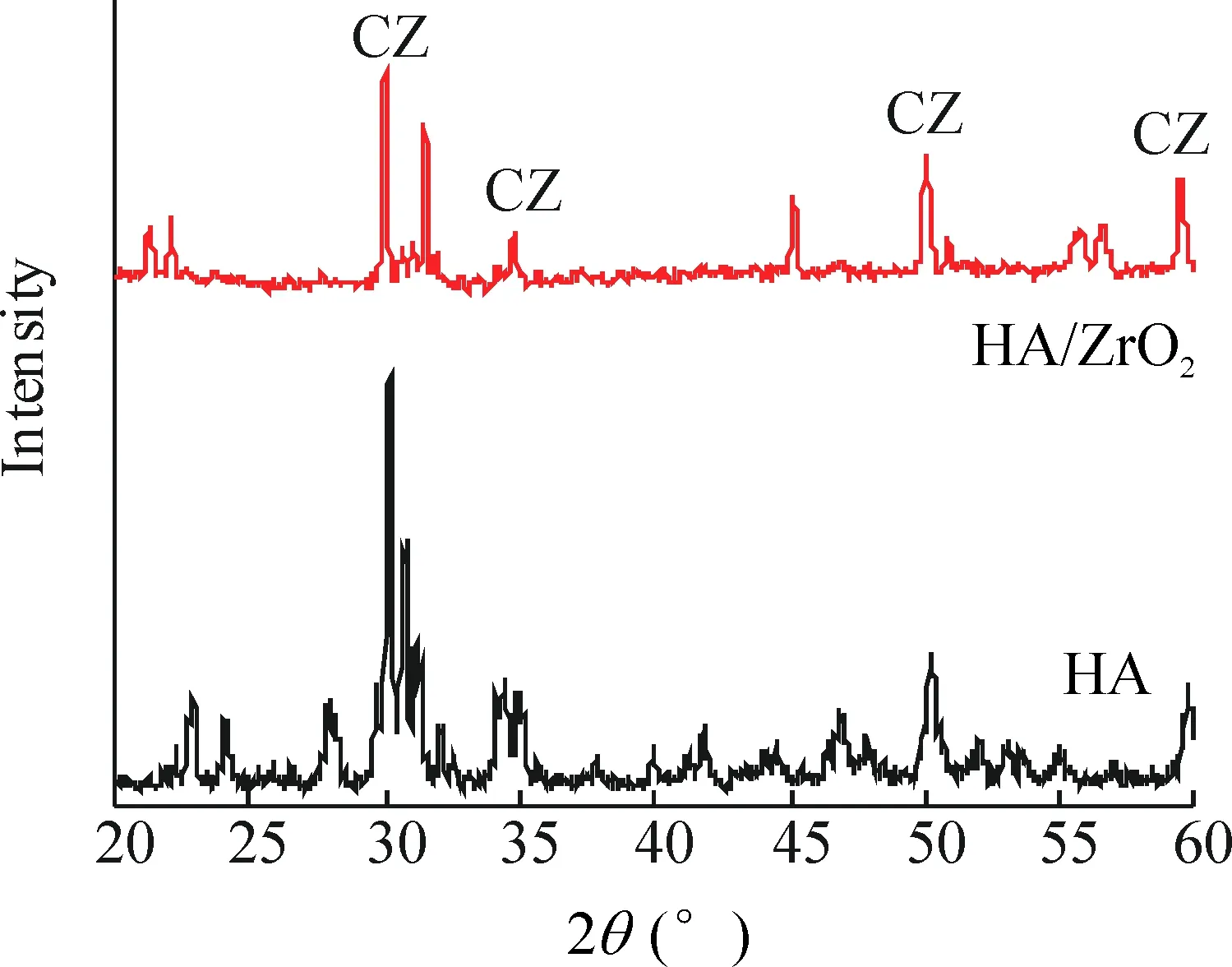
Figure 5. The XRD pattern of the spalling interface of a sample. CZ: CaZrO3; the rest are Ca3(PO4)2.
图5剥落后试样界面的XRD图
表3复合材料的抗弯强度
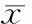
SampleBendingstrength(MPa)HA-ZrO2732.85±116.70HA-70%HA-50%HA-30%HA-ZrO2689.04±131.20*
*P<0.05vsHA-ZrO2.
5MSCs的原代培养形态、生长曲线及鉴定
将用密度梯度法分离的细胞接种于培养瓶中,镜下可见大量悬浮的细胞,接种24 h后便有少量的细胞贴壁, 多为梭形或成纤维细胞样,经换液后,非贴壁细胞逐渐减少,贴壁细胞逐渐呈克隆样生长,约10 d后,细胞逐渐融合,呈放射样、爆花样或漩涡样。细胞长满瓶底约需10~15 d。传代培养细胞生长稳定,约3~4 d传代1次,可传20代以上,见图6。MSCs以1×104/cm2接种时4 d可长满瓶底,传1代细胞可扩增4倍。增殖倍增时间约为24 h,见图7。

Figure 6. The morphosis of primarily cultured MSCs (×300). A: the colony-like MSCs; B: the blasting-like cells; C: the vortex-like cells.
图6MSCs原代培养细胞的形态
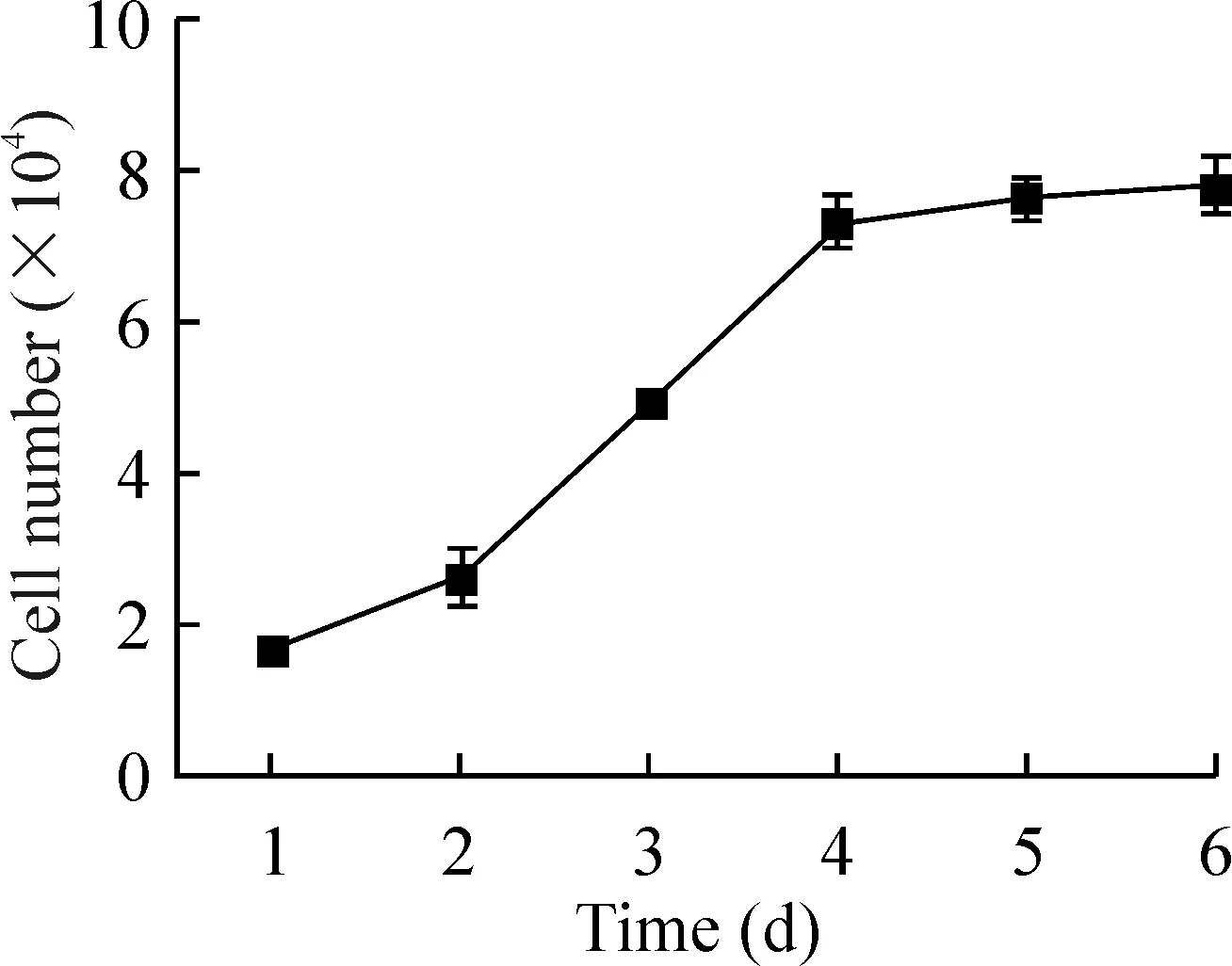

图7MSCs生长曲线
根据国际细胞治疗协会(International Society for Cellular Therapy,ISCT) 对MSCs的定义,认为MSCs是贴壁生长,表达特定表面抗原,并具有间充质分化潜能。如图8所示,经诱导后出现成骨细胞、成脂细胞表型,高表达CD90(98.60%)和CD44(63.14%),低表达CD45(0.96)和CD31(1.65%),符合ISCT给出的标准。
6细胞贴壁和增殖
如图9 所示,在12 h和24 h时,HA/ZrO2梯度复合材料上的细胞贴壁率显著高于其它材料组(P<0.05)。HA/ZrO2单层复合材料组各时点的细胞贴壁率均高于纯HA和纯ZrO2组,但差异无统计学意义(P>0.05)。这些数据说明HA/ZrO2梯度复合材料更有利于细胞贴壁。
如图10所示,在1 d和9 d时细胞在HA/ZrO2梯度复合材料上的数量均显著高于其它材料组。尽管在5 d时不存在显著差异,但梯度复合材料组的细胞数量均值仍高于其它材料组。这些数据说明HA/ZrO2梯度复合材料更有利于细胞增殖。
7MSCs在复合材料上的成骨分化
7.1ALP活性 如图11所示,纯HA薄片上细胞ALP活性显著升高。梯度复合和单层复合薄片上细胞ALP活性略有升高,但差异不显著;纯ZrO2与对照组比较差异无显著。
7.2I型胶原、骨钙蛋白和骨桥蛋白mRNA和蛋白表达 由图12、13可知,在诱导培养液中,细胞4种基质上都有I型胶原、骨钙蛋白和骨桥蛋白表达。复合材料和纯HA组Ⅰ型胶原、骨钙蛋白和骨桥蛋白表达较对照组(常规培养基质上)均有不同程度升高,其中Ⅰ型胶原表达升高更为明显。纯ZrO2组Ⅰ型胶原和骨钙蛋白表达较对照组稍有降低,骨桥蛋白表达升高程度与复合材料和纯HA组差异不大。这进一步说明复合材料基质有利于促进MSCs成骨分化。
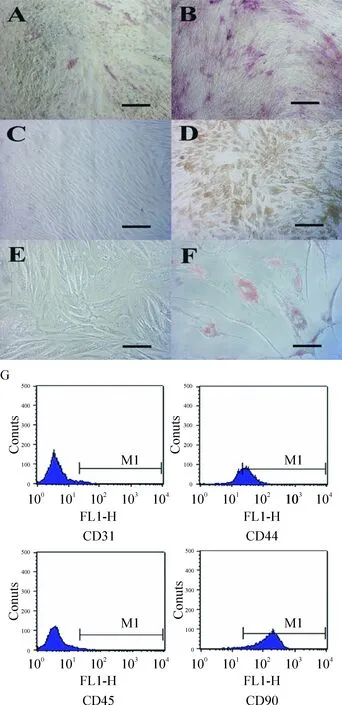
Figure 8. Identification of MSCs. A, B: alkaline phosphatase (ALP, an osteogenetic marker) staining; C, D: von Kossa staining (showing mineral deposition); E, F: Sudan III staining (showing fat deposition); A, C, E: before induction; B, D, F: after induction; G: surface CD molecules of MSCs detected by flow cytometry. Scale bars in A~F present 50 μm.
图8MSCs的鉴定
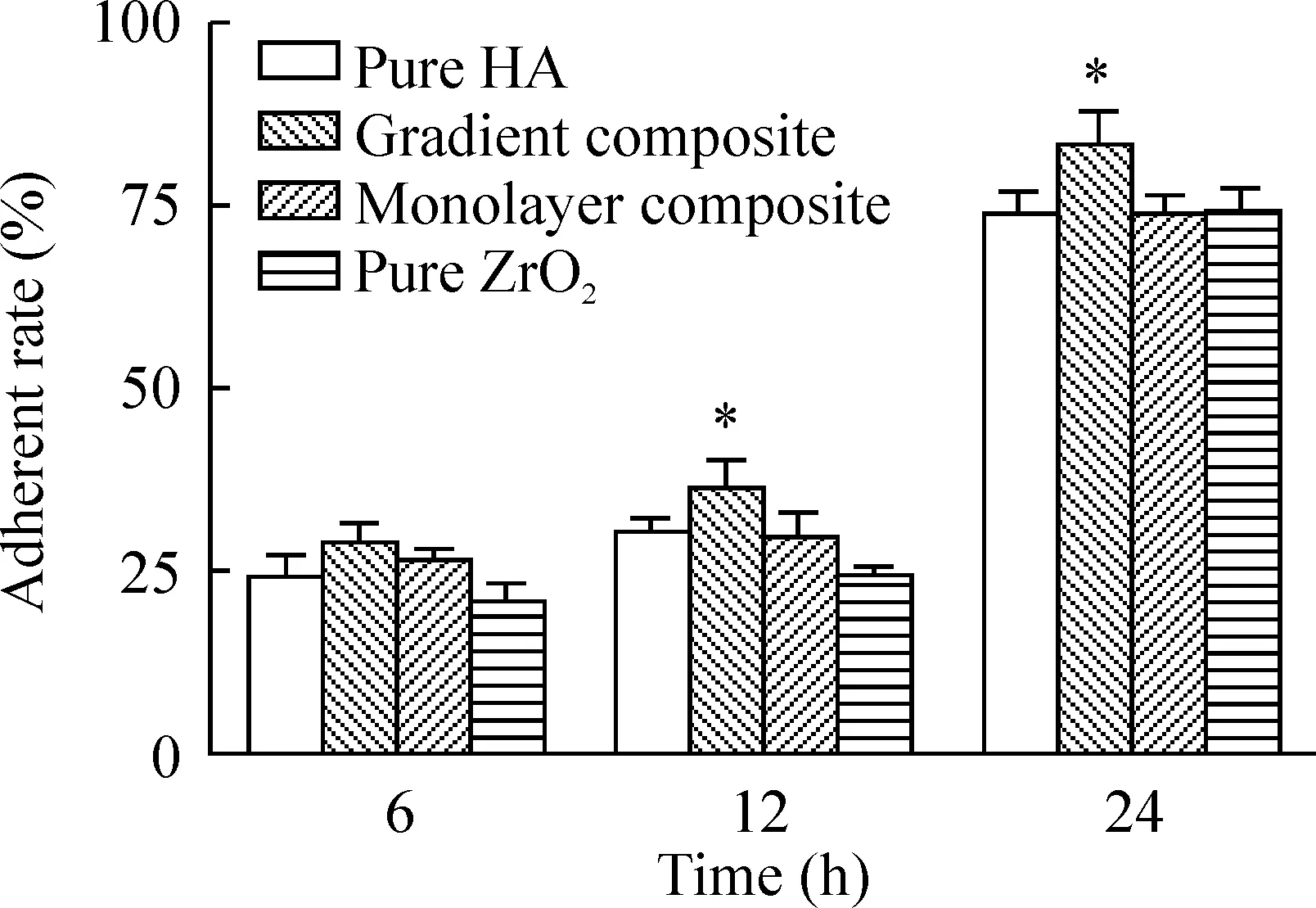

图9MSCs在4种材料薄片上的贴壁率
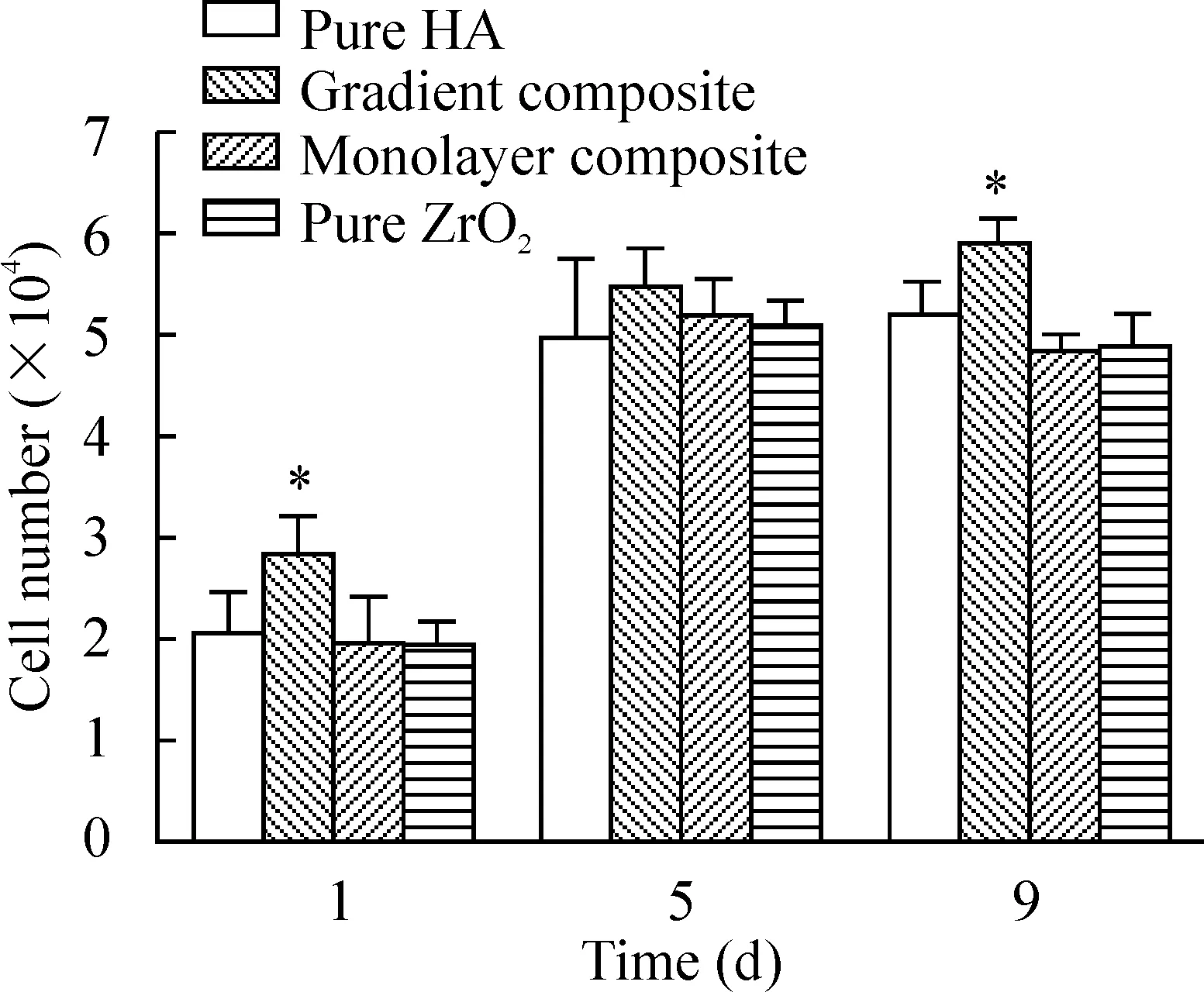

图10MSCs在4种材料薄片上的增殖
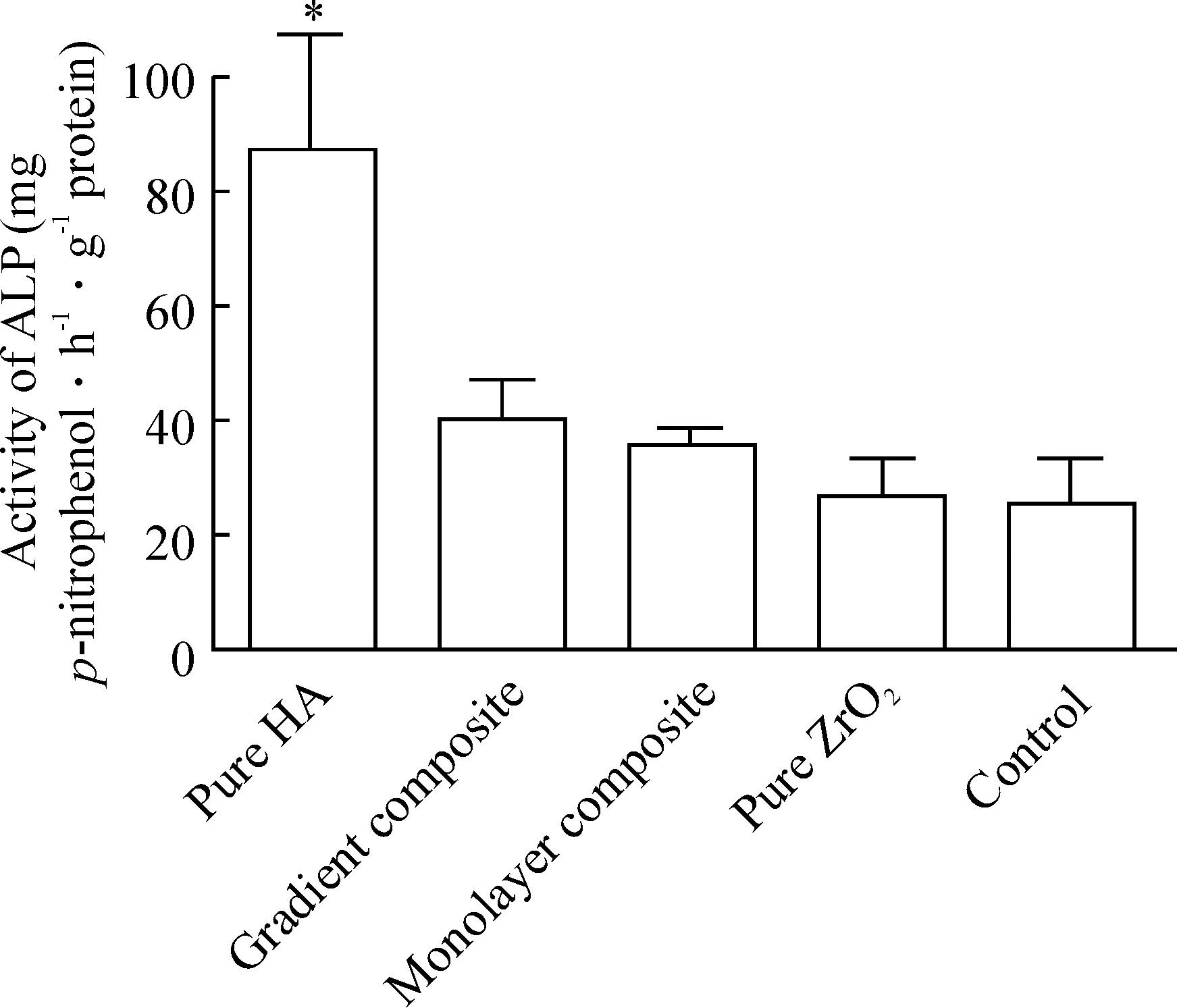

图11MSCs在4种材料薄片上的碱性磷酸酶活性
讨 论
种子细胞与支架材料的相互作用是骨组织工程研究的重要领域, 作为支架材料的组织工程材料不但须具有一定的亲水性和粗糙度,有利于细胞的黏附、贴壁,而且还须提供细胞生长基质如多孔的表面形貌等,这样才能进行细胞迁徙、分化和增殖。其次,作为种子细胞本身也必须具有黏附、 分化和增殖的特性。因而要具备以上2种特性才能应用于临床,其中骨种子细胞与支架材料的黏附是研究的基础。本实验以常规细胞培养基质为对照,来探索MSCs在HA/ZrO2不同的复合材料基质表面的贴壁、增殖及成骨分化。
HA/ZrO2复合材料具有一定的亲水性和粗糙度,电镜下HA/ZrO2梯度复合材料表面有多孔形貌,均匀分布着2~25 um的小孔,已研究证实复合材料的微孔结构有利于MSCs触角深入到其表面的微孔[5]。
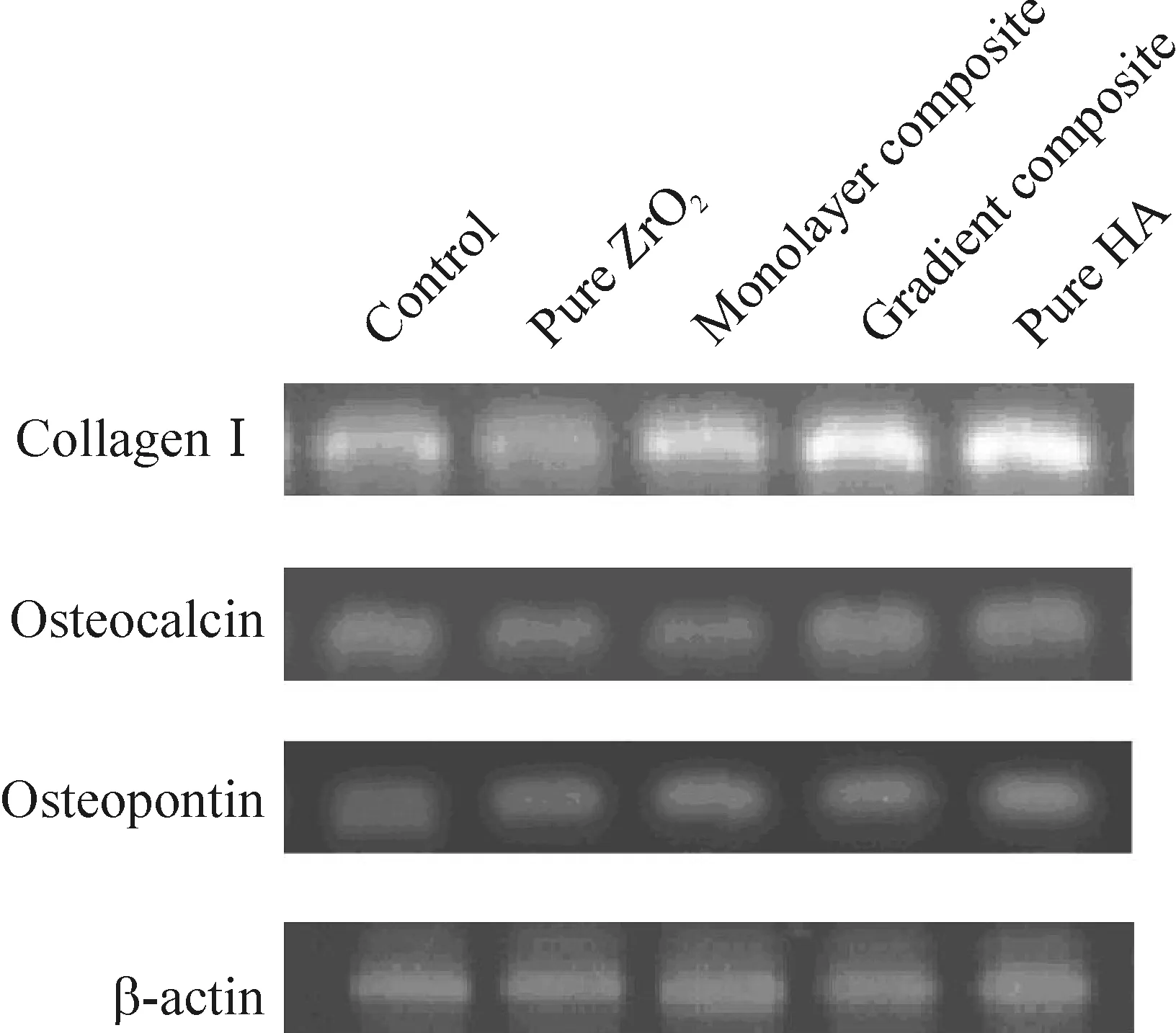
Figure 12. Collagen I, osteocalcin and osteopontin mRNA expression in MSCs on the four materials.
图12MSCs在4种材料薄片上I型胶原、骨钙蛋白和骨桥蛋白mRNA的表达
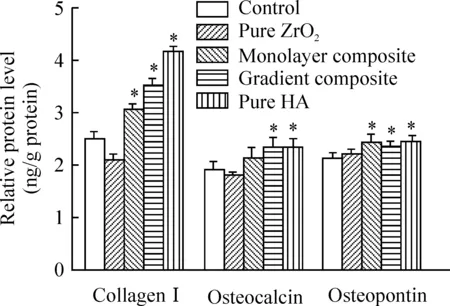

图13MSCs在4种材料薄片上I型胶原、骨钙蛋白和骨桥蛋白的表达
因此,HA/ZrO2复合材料有利于MSCs细胞贴壁和增殖,其中以梯度复合材料更为显著。HA/ZrO2复合材料成分的XRD检测结果表明,经1 600 ℃烧结后HA相已全部消失,生成了新相β-TCP、α-TCP和CaZrO3;当未水合的高温磷酸盐(TCP相)与水、体液接触后,在37 ℃下形成HA,并分解出Ca2+和HPO42-沉积于陶瓷基体表面,经过一段时间的接触,陶瓷基体成分发生了微小的变化,β-TCP相减少,HA相增多, HA可吸附血清蛋白等大分子物质,有利于吸附血清蛋白,更有利于细胞贴壁[6]。与纯HA相比,HA的分解产物β-TCP具有更好的溶解性、生物降解性和生物相容性以及骨引导能力,可提供良好的细胞黏附生长环境,促进细胞增殖[7]。因此,在HA/ZrO2复合材料上,MSCs的增殖率增高说明该材料表面的这些特征或成分促进了MSCs的增殖。此外,也可归因于平滑的基质表面。有文献显示平滑表面较粗糙表面更有利于细胞贴壁及增殖[9]。相对于粗糙表面,细胞附着于平滑表面具有更大的黏着斑,这确保了细胞与基质间的牢固结合,也是细胞黏着增强的原因之一。有很多研究表明,生长基质表面粗糙程度会对细胞增殖速率构成影响[9,11],成骨细胞在纳米相陶瓷上也出现贴壁增强[10]。因此,我们推测贴壁依赖性细胞都会出现在HA/ZrO2复合材料上贴壁增强的现象,贴壁增强是另一个导致增殖速率增强的原因。另外,基质表面粗糙程度会影响细胞基因表达,从而影响增殖速率[12-13]。
前面已经提及I型胶原、ALP、骨钙蛋白和骨桥蛋白是常用的评价MSCs成骨分化的指标[14]。未分化的MSCs可少量表达I型胶原,但不表达ALP、骨钙蛋白和骨桥蛋白。发生成骨分化后I型胶原表达加强,细胞同时可表达ALP、骨钙蛋白和骨桥蛋白。本实验结果显示在成骨诱导培养液中MSCs在HA/ZrO2梯度复合材料基质表面的ALP、I型胶原、骨钙蛋白和骨桥蛋白表达均增强。说明HA/ZrO2梯度复合材料基质可促进MSCs的成骨分化。I型胶原是骨组织的有机成分。MSCs在HA/ZrO2梯度复合材料基质上的I型胶原表达增强意味着在以HA/ZrO2梯度复合材料为支架材料时种植在上面的种子细胞MSCs可产生更多的骨组织的有机成分。显然这将非常有利于损伤骨组织的修复。此外,骨钙蛋白的主要功能之一是参与损伤组织的修复[15]。在HA/ZrO2梯度复合材料基质上的高表达同样更有利于损伤骨组织的修复。骨钙蛋白的生理功能尚不完全清楚,但由于它只在骨组织中特异性表达,因而许多文献将其作为成骨细胞的标志[16]。骨钙蛋白在HA/ZrO2梯度复合材料基质上的高表达可能意味着更多的MSCs可分化为成骨样细胞。ALP是成骨细胞的主要功能酶,它与骨组织的矿化密切相关。由于技术上的原因,本研究未评价MSCs在HA/ZrO2梯度复合材料基质上的矿化情况。但根据前一部分数据推测,MSCs可能在HA/ZrO2梯度复合材料基质上的矿化程度减弱。ALP的表达增强可能并不能增强MSCs的矿化。但由于HA本身就是骨组织的主要无机成分,以HA/ZrO2梯度复合材料为支架材料时MSCs矿化的减弱并不会影响新生骨组织的矿化程度。
修复骨缺损的生物陶瓷材料的生物相容性极其重要。我们的研究显示,与HA/ZrO2单层复合材料、纯HA和ZrO2基质相比,HA/ZrO2梯度复合材料基质更适于MSCs的贴壁和增殖。在组织工程骨的构建中,用HA/ZrO2梯度复合材料作为支架材料,有望获得更为优良的成骨性能。
[1] Cai YR, Liu YK, Yan WQ, et al. Role of hydroxyapatite nanoparticle size in bone cell proliferation[J]. J Mater Chem, 2007, 17(36): 3780-3787.
[2] Zhou GS, Su ZY, Cai YR, et al. Different effects of nanophase and conventional hydroxyapatite thin films on attachment, proliferation and osteogenic differentiation of bone marrow derived mesenchymal stem cells[J]. Biomed Mater Eng, 2007, 17(6): 387-395.
[3] Hayami JW, Waldman SD, Amsden BG. A photocurable hydrogel/elastomer composite scaffold with bi-continuous morphology for cell encapsulation[J]. Macromol Biosci, 2011, 11(12): 1672-1683.
[4] 黄传勇,孙淑珍,张中太.生物陶瓷复合材料的研究[J].中国生物医学工程学报,2000,19(3):281-287.
[5] 杨 成,李源莹,吴晓玲,等.微弧氧化陶瓷膜表面骨髓间充质干细胞生物相容性实验[J].生物骨科材料与临床研究,2008,5(1):12-14,18.
[6] Santos O, Kosoric J, Hector MP, et al. Adsorption behavior of statherin and a statherin peptide onto hydroxyapatite and silica surfaces byinsituellipsometry[J]. J Colloid Interface Sci, 2008, 318(2): 175-182.
[7] 焦 强,卫小春,陆向东,等.转化生长因子-β1和血清对人骨髓基质干细胞增殖及向软骨细胞诱导分化的影响[J]. 中华创伤骨科杂志,2005,7(10):960-963.
[8] 郭希民,王常勇,薄 斌,等.骨髓间质干细胞复合生物陶瓷构建组织工程化人工软骨[J].中国修复重建外科杂志,2003,17(2):147-151.
[9] Rosa AL, Beloti MM. Effect of cpTi surface roughness on human bone marrow cell attachment, proliferation, and differentiation [J]. Braz Dent J, 2003, 14(1): 16-21.
[10]Webster TJ, Ergun C, Doremus RH, et al. Enhanced functions of osteoblasts on nanophase ceramics[J]. Biomaterials, 2000, 21 (17): 1803-1810.
[11]Baharloo B, Textor M, Brunette DM. Substratum roughness alters the growth, area, and focal adhesions of epithelial cells, and their proximity to titanium surfaces [J]. J Biomed Mater Res A, 2005, 74(1): 12-22.
[12]Brett PM, Harle J, Salih V, et al. Roughness response genes in osteoblasts[J].Bone, 2004, 35(1): 124-133.
[13]全仁夫,汤样华,杨迪生,等.HA/ZrO2复合材料颗粒的体外基因毒性的初步研究[J].中国病理生理杂志,2011,27(1):175-178.
[14]Takahashi Y, Yamamoto M, Tabata Y. Osteogenic differentiation of mesenchymal stem cells in biodegradable sponges composed of gelatin and β-tricalcium phosphate[J].Biomaterials,2005,26(17): 3587-3596.
[15]Myers DL, Harmon KJ, Lindner V, et al. Alterations of arterial physiology in osteopontin-null mice[J]. Athroscler Thromb Vasc Biol, 2003, 23(6):1021-1028.
[16]Weiβenböck M, Stein E, Undt G, et al. Particle size of hydroxyapatite granules calcified from red algae affects the osteogenic potential of human mesenchymal stem cellsinvitro[J]. Cells Tissues Organs, 2006 ,182(2): 79-88.
EffectsofdifferentHA/ZrO2compositesonadherence,proliferationandosteogenesisofculturedMSCs
QUAN Ren-fu1, TANG Yang-hua1, YANG Di-sheng2, HUANG Zhong-ming1, LI Wei1, XU Jin-wei1, WU Xiao-chun3
(1DepartmentofOrthopedics,TCMHospitalofXiaoshanDistrict,Hangzhou311200,China;2DepartmentofOrthopedics,theSecondAffiliatedHospitalofZhejiangUniversity,Hangzhou310009,China;3MaterialCollegeofShanghaiUniversity,Shanghai200072,China.E-mail:quanrenf@263.net)
AIM: To study the adherence, proliferation and osteogenesis effects of different composites on cultured mesenchymal stem cells (MSCs).METHODSZirconium oxide (ZrO2) with monolayer hydroxyapatite (HA) composite and ZrO2with gradient HA composite were prepared using dry-laying method. The surface topography of the composites was observed. The rabbit MSCs were isolated and cultured on HA/ZrO2monolayer composite, HA/ZrO2gradient composite, pure HA or pure ZrO2slices. The adherence, proliferation and osteogenesis of the MSCs were assayed. The activity of alkaline phosphatase was detected. The mRNA expression of collagen I, osteocalcin and osteopontin was determined by RT-PCR.RESULTSThe discontinuous or continuous HA surface was observed in HA/ZrO2monolayer composite,while the surface of prepared HA/ZrO2gradient composite was fairly rough with porosity. The X-ray diffraction analysis shows that after megatemperature sintering, the ZrO2phase on the surface of the composite still remained, while the HA phase transformed to β-Ca3(PO4)2(β-TCP), α-Ca3(PO4)2(α-TCP) and CaZrO3phases. Cell culture showed that the HA/ZrO2gradient composite was in favour of cell adherence. The alkaline phosphatase activity in MSCs on pure HA slice was significantly increased compared compared with other groups.The mRNA expression of collagen I, osteocalcin and osteopontin in MSCs on HA/ZrO2composites and pure HA silice was higher than that in control group,especially the expression of collagen I.CONCLUSIONThe HA/ZrO2garded composite promotes the proliferation of MSCs to a certain extent, and also promotes the osteogenesis differentiation of MSCs.
Zirconium oxide; Hydroxyapatites; Mesenchymal stem cells
R318
A
10.3969/j.issn.1000-4718.2012.05.002

