姜黄素通过抑制Ras-ERK和Shh-GLI1信号诱导胰腺癌细胞凋亡*
孙晓东, 刘杏娥
(1浙江大学医学院附属邵逸夫医院普外科, 浙江 杭州 310016; 2浙江医院肿瘤科, 浙江 杭州 310013)
1000-4718(2012)06-0996-05
2011-12-19
2012-03-22
浙江省自然科学基金资助项目(No.Y2100434)
△通讯作者 Tel: 0571-87987373;E-mail: xingel@sohu.com
姜黄素通过抑制Ras-ERK和Shh-GLI1信号诱导胰腺癌细胞凋亡*
孙晓东1, 刘杏娥2△
(1浙江大学医学院附属邵逸夫医院普外科, 浙江 杭州 310016;2浙江医院肿瘤科, 浙江 杭州 310013)
目的探讨姜黄素对胰腺癌PANC-1细胞的影响及可能机制。方法不同浓度的姜黄素作用于PANC-1细胞后,采用MTT法检测细胞增殖,流式细胞术检测细胞凋亡,Western blotting检测K-Ras、细胞外信号调节激酶1/2(ERK1/2)、磷酸化细胞外信号调节激酶(p-ERK1/2)、Sonic hedgehog(Shh)和胶质瘤相关癌基因同系物1(GLI1)的表达水平。结果不同浓度的姜黄素与PANC-1细胞共培养后,浓度为30 mmol/L的姜黄素组能明显抑制PANC-1细胞的增殖, 与其余各组相比,差异显著(P<0.01)。PANC-1细胞经30 mmol/L姜黄素处理后,其细胞凋亡率(37.57%)明显高于对照组(4.62%)(P<0.01)。经姜黄素处理的PANC-1细胞,其K-Ras、p-ERK、Shh和GLI1表达明显低于对照组(均P<0.01)。结论姜黄素通过抑制Ras-ERK和Shh-GLI1信号通路的活化,抑制胰腺癌PANC-1细胞增殖,并诱导细胞凋亡。
姜黄素; 胰腺肿瘤; Hedgehog; Ras-ERK通路; Shh-GLI1通路
姜黄素(curcumin)是一种从姜科植物姜黄中提取的酚化合物,具有强烈的抗炎、抗氧化、抗突变等特性[1]。近年来的研究表明,姜黄素可通过多种机制抑制多种肿瘤细胞的生长、侵袭和转移,诱导凋亡,并能提高肿瘤细胞对化疗药物和放疗的敏感性[2-3]。
胰腺癌细胞中K-ras基因的突变率可达70%~100%,提示K-Ras信号在胰腺癌的起始、发展及转移过程中起着重要的作用[4]。Hedgehog(Hh)信号通路的异常激活在胰腺癌的发生、发展、侵润及转移中也起重要作用[5-6]。我们通过研究姜黄素对胰腺癌细胞体外增殖、细胞凋亡等影响,同时检测K-Ras、磷酸化细胞外信号调节激酶(phosphorylated extracellular signal-regulated kinase 1/2,p-ERK1/2)、Sonic hedgehog(Shh)和胶质瘤相关癌基因同系物1(glioma-associated oncogene homolog 1,GLI1)蛋白表达水平,探讨姜黄素对胰腺癌细胞的作用及可能的分子机制。
材 料 和 方 法
1细胞株及主要试剂
PANC-1(K-ras突变)胰腺癌细胞购自中科院上海细胞库。姜黄素为Sigma产品。兔抗人K-Ras、ERK1/2、p-ERK1/2、Shh和GLI1 Ⅰ抗为Cell Signaling产品,鼠抗兔Ⅱ抗购自北京中杉金桥生物技术有限公司。Annexin V/PI凋亡检测试剂盒购自联科生物技术有限公司。DMEM、胎牛血清为Gibco产品。MTT为Sigma产品。
2方法
2.1MTT法检测细胞增殖抑制率 胰腺癌细胞经DMEM常规培养后用0.25%胰酶消化, 以1×107/L接种于96 孔培养板中,37 ℃过夜。将细胞分对照组和姜黄素处理组(10 mmol/L、20 mmol/L和30 mmol/L),培养48 h后将96孔板中的细胞以500×g离心3 min,弃100 μL上清液,加MTT 10 μL(5 g/L),37 ℃ 孵育4 h,加DMSO 100 μL,振荡10 min后上酶标免疫测定仪检测A490值。细胞增殖抑制率(%)= (1-处理组A/对照组A)×100%。
2.2采用Annexin V-FITC/PI双染法检测姜黄素诱导胰腺癌细胞凋亡的实验 按试剂盒说明书操作,PANC-1细胞经DMEM常规培养后用0.25%胰酶消化, 以1×108/L接种于6 孔培养板中培养过夜,将细胞分为对照组和姜黄素处理组(10 mmol/L、20 mmol/L和30 mmol/L )。经48 h处理后胰酶消化收集细胞,经800×g、离心5 min,再经PBS洗3次,分别加缓冲液50 μL、V-FITC 5 μL和PI 10 μL,避光5 min以上,行流式细胞术检测。
2.3姜黄素对ERK1/2磷酸化的影响 应用Western blotting技术检测K-Ras、ERK1/2和p-ERK1/2表达水平。PANC-1细胞经DMEM常规培养,用0.25%胰酶消化后, 以1×108/L接种于6 孔培养板中培养过夜,将细胞分对照组和姜黄素30 mmol/L处理组,48 h后收集各组细胞,一步法裂解细胞,13 000 r/min离心10 min,取上清液进行蛋白定量。常规制备10%SDS-PAGE分离胶和积层胶。每孔上样蛋白量50 μg,加4×上样缓冲液,混匀后煮沸5 min,上样后100 V电泳至染料跑出胶。轻轻取下胶,用Millipore H2O洗胶1次,100 V转膜2 h,用封闭液37 ℃封闭2 h,加入相应的Ⅰ抗(1∶1 000)4 ℃过夜,TBST洗膜4次,每次10 min,加辣根过氧化物酶标记的Ⅱ抗(1∶5 000)室温1 h,TBST洗膜4次,每次10 min,最后加ECL液曝光显色。结果用Band Leader软件进行条带灰度半定量分析。
2.4姜黄素对Shh和GLI1表达的影响 应用Western blotting技术检测Shh和GLI1的表达水平。同方法2.3,结果用Band Leader软件进行条带灰度半定量分析。
3统计学处理
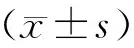
结 果
1MTT检测增殖结果
随着姜黄素浓度的逐渐增加,PANC-1细胞的增殖抑制率也逐渐增加,10 mmol/L姜黄素处理组与对照组相比,PANC-1细胞的增殖明显被抑制,差异显著(P<0.01);20 mmol/L姜黄素处理组与10 mmol/L姜黄素处理组相比,PANC-1细胞的增殖抑制差异不显著(P>0.05),与对照组相比,细胞增殖明显被抑制,差异显著(P<0.01);30 mmol/L姜黄素处理组与20 mmol/L姜黄素处理组相比,PANC-1细胞的增殖明显被抑制,差异显著(P<0.01),与10 mmol/L姜黄素处理组相比,细胞增殖明显被抑制,差异显著(P<0.01),与对照组相比,细胞增殖抑制率明显增高,差异显著(P<0.01),见表1。
表1PANC-1细胞增殖抑制率
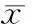

GroupGrowthinhibioryrateControl0Curcumin(10mmol/L)12.58±3.52**Curcumin(20mmol/L)15.43±3.63**##Curcumin(30mmol/L)60.21±6.83**##△△
**P<0.01vscontrol group;##P<0.01vs10 mmol/L curcumin group;△△P<0.01vs20 mmol/L curcumin group.
2流式细胞术检测凋亡结果
流式细胞术检测姜黄素诱导PANC-1细胞凋亡的结果见图1、表2。10 mmol/L姜黄素处理组与对照组相比,PANC-1细胞的凋亡率明显增高,差异显著(P<0.01);20 mmol/L姜黄素处理组与10 mmol/L姜黄素处理组相比,凋亡率无显著差异(P>0.05),与对照组相比,凋亡率明显增高,差异显著(P<0.01);30 mmol/L姜黄素处理组与20 mmol/L姜黄素处理组相比,PANC-1细胞的凋亡率明显增高,差异显著(P<0.01),与10 mmol/L姜黄素处理组相比,凋亡率明显增高,差异显著(P<0.01),与对照组相比,凋亡率也明显增高,差异显著(P<0.01)。
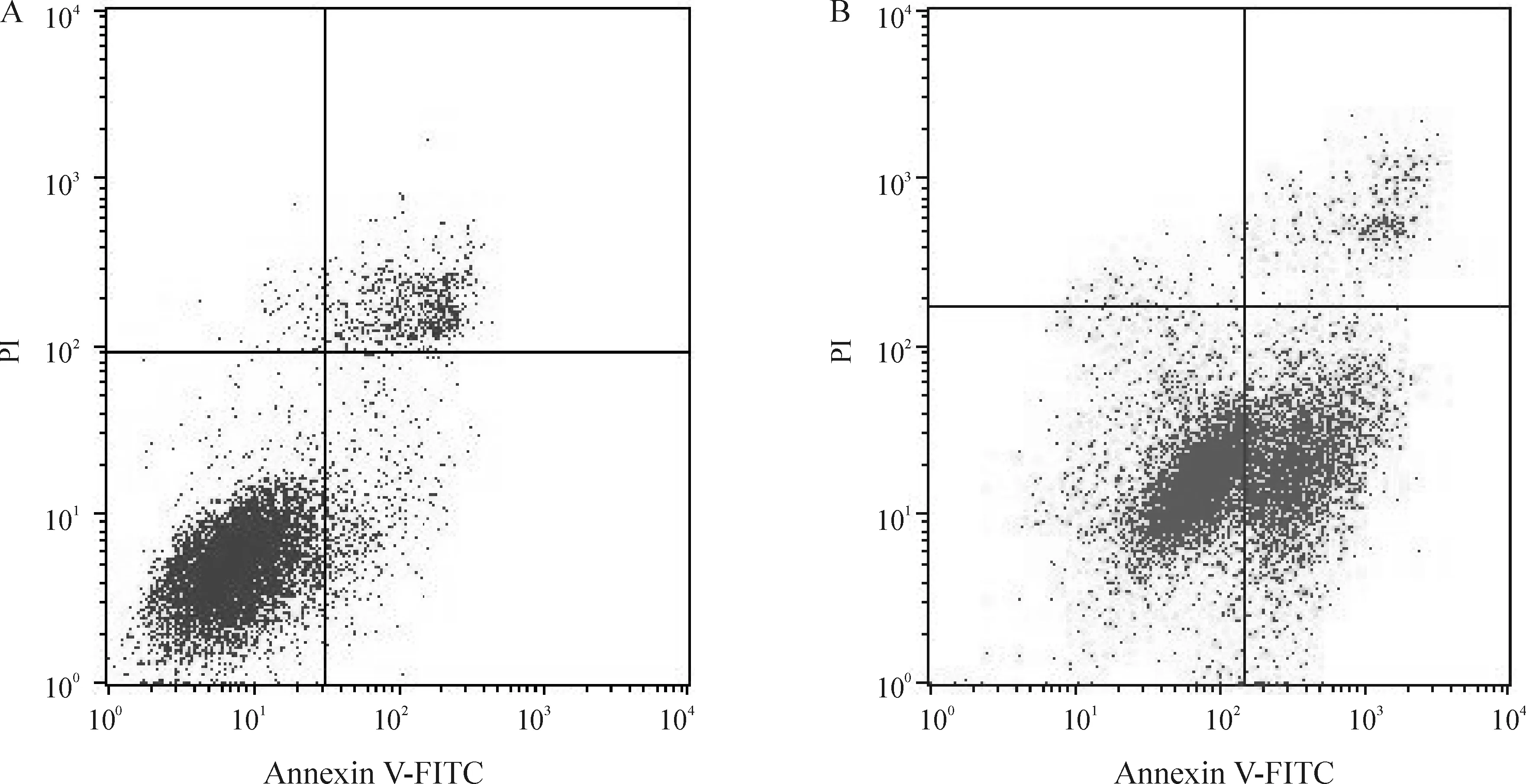
Figure 1. Apoptosis of PANC-1 cells detected by flow cytometry.A: control group;B:curcumin treatment group(30 mmol/L).
图1PANC-1细胞的凋亡
表2PANC-1细胞凋亡率
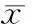
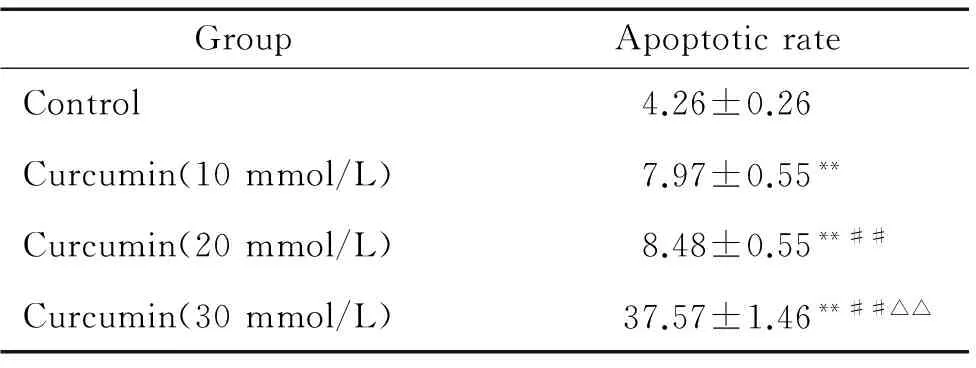
GroupApoptoticrateControl4.26±0.26Curcumin(10mmol/L)7.97±0.55**Curcumin(20mmol/L)8.48±0.55**##Curcumin(30mmol/L)37.57±1.46**##△△
**P<0.01vscontrol group;##P<0.01vs10 mmol/L curcumin group;△△P<0.01vs20 mmol/L curcumin group.
3姜黄素抑制PANC-1细胞K-Ras的表达及ERK1/2磷酸化水平
与对照组相比,K-Ras在姜黄素组中的表达明显降低,差异显著(P<0.05);与对照组相比,ERK1/2在姜黄素组中的表达无明显变化(P>0.05);与对照组相比,p-ERK1/2在姜黄素组中的表达明显降低,差异显著(P<0.01)。这些结果提示姜黄素可抑制PANC-1细胞K-Ras及其下游信号分子的活化,见图2。
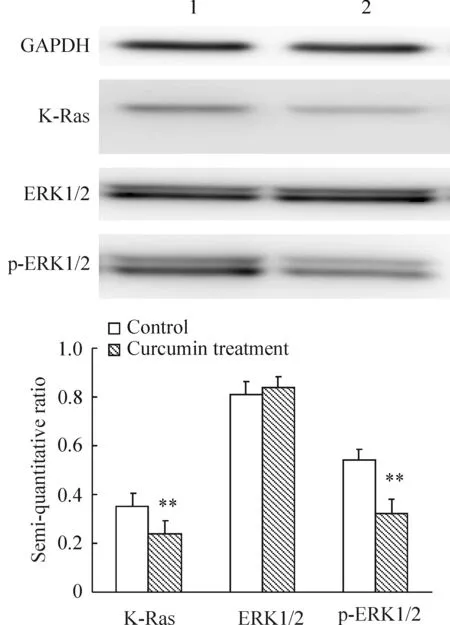
图2Westernblotting检测K-Ras、ERK1/2和p-ERK1/2的表达
4姜黄素抑制PANC-1细胞Shh和GLI1的表达
与对照组相比,Shh在姜黄素组中的表达明显降低,差异显著(P<0.01);与对照组相比,GLI1在姜黄素组中的表达明显降低,差异显著(P<0.01)。这些结果提示姜黄素可抑制Hedgehog信号通路,见图3。
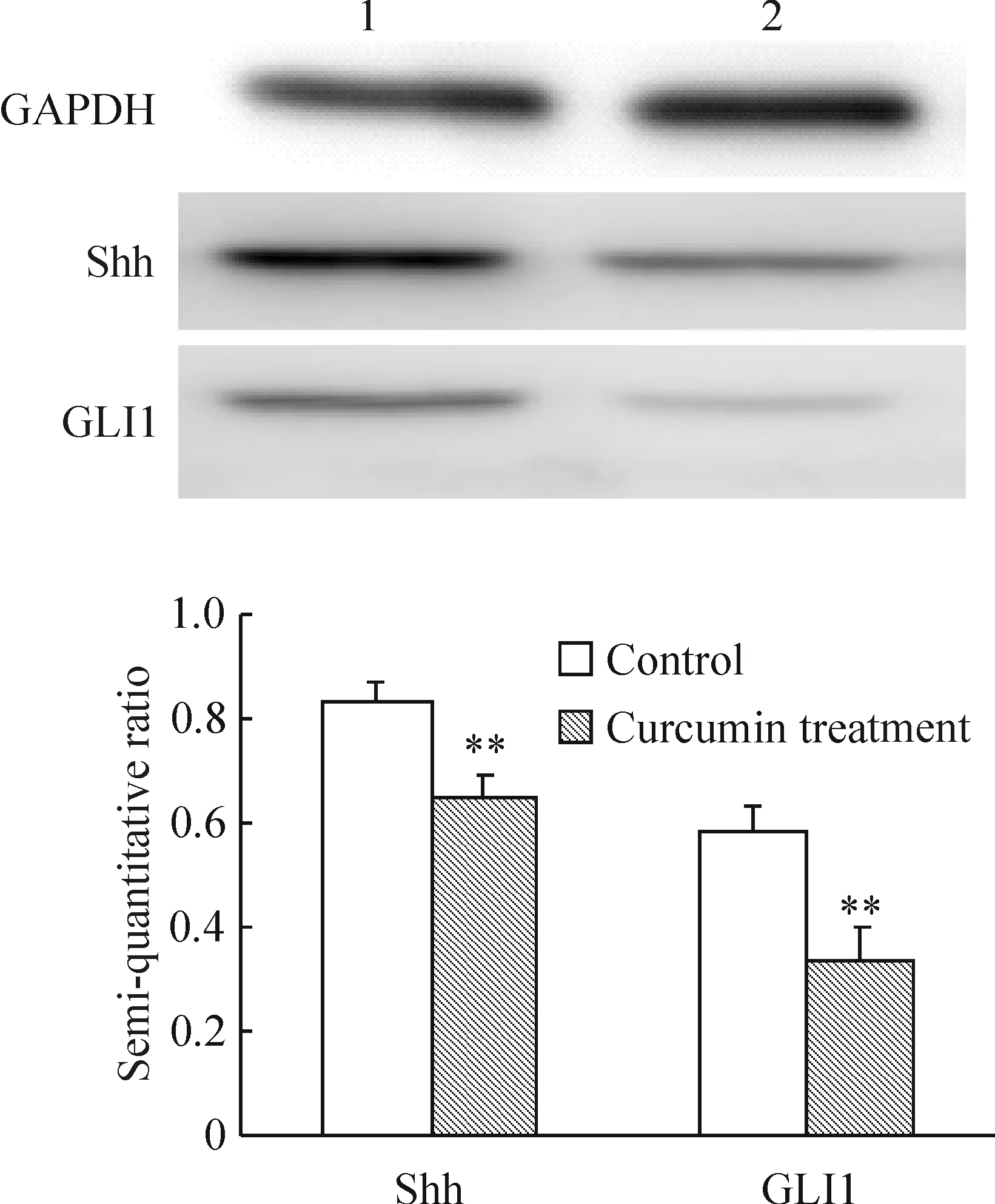
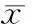
图3Westernblotting检测Shh和GLI1的表达
讨 论
多条信号通路的异常和持续活化是恶性肿瘤发生、发展、侵润、转移及复发、耐药等的主要机制[7-8]。研究表明,姜黄素因具有抗炎、抗HIV-1、抗肺纤维化、预防肿瘤、抑制肿瘤、放化疗增敏等多种药理活性作用,近年来在肿瘤领域受到极大关注。姜黄素对多种肿瘤细胞,包括乳腺癌、胃癌、大肠癌、肺癌、胰腺癌等均具有化学预防及治疗作用[7,9]。姜黄素抗肿瘤作用的机制主要是通过调节多条信号通路分子,如下调EGFR、HER-2、Shh/GLI1、Wnt/β-catenin及其下游信号分子ERK、Akt、NF-κB、STATs等,上调p21、p27、细胞周期激酶抑制剂等[8,10-12]。
在胰腺癌中,姜黄素具有抑制胰腺癌细胞增殖、诱导凋亡、抗血管生成、化疗增敏等作用,其机制尚未完全清楚,可能与姜黄素能抑制EGFR、STAT-3、NF-κB及其下游靶基因——多药耐药相关蛋白5表达等有关[13-16]。姜黄素通过下调NF-κB依赖基因和Sp1、Sp2、Sp3转录因子抑制Panc28和L3.6pL胰腺癌细胞增殖[13]。姜黄素腹腔内注射能抑制裸鼠L3.6pL胰腺癌细胞移植瘤的生长[15]。姜黄素还能提高吉西他滨对BxPC-3、Panc-1和Miapaca-2胰腺癌细胞的抗增殖及诱导凋亡效应[13,16]。在胰腺癌动物模型中,姜黄素和吉西他滨联合应用比吉西他滨单药更有效地抑制肿瘤生长及抗血管生成[13,16]。姜黄素的化疗增敏作用部分是通过抑制STAT-3和NF-κB调节基因如cyclins、c-myc、bcl-2、bcl-XL、MMPs、VEGF等的表达[13,16]。
在所有恶性肿瘤中,胰腺癌的K-ras基因突变率最高,可达70%~100%。K-ras基因突变后,转为癌基因,其表达产物Ras 蛋白发生构型改变,功能也随之改变,不需外界生长信号的刺激便自身活化,主要通过Ras-Raf- MEK - ERK等信号转导途径,影响细胞的生长、分化和凋亡等。K-ras基因突变是胰腺癌发生过程中的早期分子事件,在胰腺癌的起始、发展及转移过程中起着重要的作用[3]。
Hh信号通路是一条高度保守的信号转导通路,主要由信号分子Shh、膜受体Patched(Ptch)、Smoothened (Smo)和下游的核转录因子GLI组成(即Shh-Ptch-Smo-GLI)。GLI的靶基因涉及到肿瘤细胞的生长、凋亡、转移、上皮间质转化、新生血管形成等多个方面[17]。近年来的研究表明,Hh/GLI信号通路的异常激活在胰腺癌的发生、发展、侵润及转移中起重要作用[4-5]。
而有关Hh和Ras- Raf-MEK-ERK信号通路之间串联对话的报道很少。研究发现,在Hh/GLI信号介导的肿瘤发展过程中,其它癌基因产物(如突变的K-Ras)以及Hh与不同生长因子,包括酪氨酸激酶受体[如表皮生长受体EGFR、Wnt/β-catenin和转化生长因子-β(TGF-β)/TGF-β受体]之间的串联对话同样起着重要作用[18]。Morton等[19]的研究也发现,Hh信号通路与活化的K-Ras具有协同作用,Hh通过降低肿瘤细胞对MAPK和PI3-K/Akt/mTOR信号持续活化的依赖,从而增强K-Ras诱导的胰腺癌发生、发展。但也有研究表明,在胰腺导管腺癌中,Hh信号通路下游的核转录因子GLI1可不依赖于上游Shh-Ptch-Smo的信号,而受TGF-β和K-Ras信号的调控[20]。
我们研究姜黄素对PANC-1细胞(K-ras基因突变)的增殖抑制及诱导凋亡作用。结果发现,不同浓度的姜黄素与PANC-1细胞共培养后,随着姜黄素浓度的逐渐增加,PANC-1细胞的增殖抑制率也逐渐增加,浓度为30 mmol/L的姜黄素能明显抑制PANC-1细胞的增殖。PANC-1细胞经姜黄素处理后,细胞凋亡率明显高于对照组,提示姜黄素能在体外诱导PANC-1细胞凋亡,抑制细胞增殖。我们的实验研究发现,姜黄素能显著抑制PANC-1细胞K-Ras的表达和ERK1/2的磷酸化水平。而ERK1/2是K-Ras下游主要的信号分子之一,结果提示姜黄素能抑制K-Ras及其下游信号分子的活化。我们同时还检测了Shh和GLI1的表达水平。经姜黄素处理后,PANC-1细胞Shh和GLI1的表达水平均明显下降。GLI1蛋白是Smo下游的转录因子,在Hh通路中起关键作用。GLI1也是Hh信号活化后的靶基因,GLI1表达下降,提示Hh信号通路被抑制。
综上所述,姜黄素能抑制胰腺癌细胞PANC-1的体外增殖,并可能通过抑制细胞K-Ras下游信号分子ERK1/2的磷酸化和Hedgehog信号通路信号分子Shh、GLI1的表达来诱导PANC-1细胞的凋亡。
[1] 郭鲁燕,涂荣波,董 军,等. 姜黄素对TNF-α损伤大鼠海马神经元的功能性保护作用及机制[J]. 中国病理生理杂志,2010,26(7):1390-1394.
[2] Goel A, Aggarwal BB. Curcumin, the golden spice from Indian saffron, is a chemosensitizer and radiosensitizer for tumors and chemoprotector and radioprotector for normal organs[J]. Nutr Cancer,2010,62(7):919-930.
[3] Basnet P, Skalko-Basnet N. Curcumin: an anti-inflammatory molecule from a curry spice on the path to cancer treatment[J]. Molecules,2011,16(6): 4567-4598.
[4] Rachagani S, Senapati S, Chakraborty S, et al. Activated KrasG12Dis associated with invasion and metastasis of pancreatic cancer cells through inhibition of E-cadherin[J]. Br J Cancer, 2011,104(6):1038-1048.
[5] Dai J, Ai K, Du Y, et al. Sonic hedgehog expression correlates with distant metastasis in pancreatic adenocarcinoma[J]. Pancreas,2011,40(2):233-236.
[6] Kelleher FC. Hedgehog signaling and therapeutics in pancreatic cancer[J]. Carcinogenesis,2011,32(4):445-451.
[7] Mimeault M, Batra SK. Potential applications of curcumin and its novel synthetic analogs and nanotechnology-based formulations in cancer prevention and therapy[J]. Chin Med,2011,6:31.
[8] Nautiyal J, Banerjee S, Kanwar SS, et al. Curcumin enhances dasatinib-induced inhibition of growth and transformation of colon cancer cells[J]. Int J Cancer,2011,128(4):951-961.
[9] 刘嘉伟,张剑威,杨广鑫,等. 姜黄素衍生物B50对不同辐射抗拒的同源鼻咽癌细胞增殖及凋亡的作用[J].中国病理生理杂志,2011,27(6):1077-1083.
[10]Kunnumakkara AB, Anand P, Aggarwal BB. Curcumin inhibits proliferation, invasion, angiogenesis and metastasis of different cancers through interaction with multiple cell signaling proteins[J]. Cancer Lett,2008,269(2):199-225.
[11]Yallapu MM, Maher DM, Sundram V, et al. Curcumin induces chemo/radio-sensitization in ovarian cancer cells and curcumin nanoparticles inhibit ovarian cancer cell growth[J]. J Ovarian Res,2010,3:11.
[12]Aggarwal BB, Banerjee S, Bharadwaj U, et al. Curcumin induces the degradation of cyclin E expression through ubiquitin-dependent pathway and up-regulates cyclin-dependent kinase inhibitors p21 and p27 in multiple human tumor cell lines[J]. Biochem Pharmacol,2007, 73(7):1024-1032.
[13]Kunnumakkara AB, Guha S, Krishnan S, et al. Curcumin potentiates antitumor activity of gemcitabine in an orthotopic model of pancreatic cancer through suppression of proliferation, angiogenesis, and inhibition of nuclear factor-κB-regulated gene products[J]. Cancer Res,2007, 67(8):3853-3861.
[14]Ali S, Ahmad A, Banerjee S, et al. Gemcitabine sensitivity can be induced in pancreatic cancer cells through modulation of miR-200 and miR-21 expression by curcumin or its analogue CDF[J]. Cancer Res,2010, 70(9):3606-3617.
[15]Jutooru I, Chadalapaka G, Lei P, et al. Inhibition of NFκB and pancreatic cancer cell and tumor growth by curcumin is dependent on specificity protein down-regulation[J]. J Biol Chem,2010, 285(33):25332-25344.
[16]Ramachandran C, Resek AP, Escalon E, et al. Potentiation of gemcitabine by Turmeric ForceTMin pancreatic cancer cell lines[J]. Oncol Rep, 2010, 23(6):1529-1535.
[17]Katoh Y, Katoh M. Hedgehog target genes: mechanisms of carcinogenesis induced by aberrant Hedgehog signaling activation[J]. Curr Mol Med, 2009, 9(7):873-886.
[18]Mimeault M, Batra SK. Frequent deregulations in the Hedgehog signaling network and cross-talks with the epidermal growth factor receptor pathway involved in cancer progression and targeted therapies[J]. Pharmacol Rev, 2010, 62(3):497-524.
[19]Morton JP, Mongeau ME, Klimstra DS, et al. Sonic hedgehog acts at multiple stages during pancreatic tumorigenesis[J]. PNAS, 2007, 104(12): 5103-5108.
[20]Nolan-Stevaux O,Lau J,Truitt ML,et al. GLI1 is regulated through Smoothened-independent mechanisms in neoplastic pancreatic ducts and mediates PDAC cell survival and transformation[J]. Genes Dev, 2009, 23(1):24-36.
CurcumininducesapoptosisofpancreaticcancercellsbyinhibitingRas-ERKandShh-GLI1signalpathways
SUN Xiao-dong1, LIU Xing-e2
(1DepartmentofGeneralSurgery,SirRunRunShawHospitalAffiliatedtoZhejiangUniversitySchoolofMedicine,Hangzhou310016,China;2DepartmentofOncology,ZhejiangHospital,Hangzhou310013,China.E-mail:xingel@sohu.com)
AIM: To investigate the effects of curcumin on pancreatic cancer cells and the possible molecular mechanisms.METHODSThe pancreatic cancer PANC-1 cells were treated with curcumin. Growth inhibitory rate of the cells was measured by MTT assay. Apoptosis of the cells was detected by flow cytometry. The expression levels of K-Ras,extracellular signal-regulated kinase 1/2(ERK1/2),phosphorylated ERK1/2(p-ERK1/2),Sonic hedgehog (Shh) and glioma-associated oncogene homolog 1(GLI1) were determined by Western blotting.RESULTSThe growth inhibitory rate of the cells in 30 mmol/L curcumin group was significantly different from that in other groups. Apoptotic rate in 30 mmol/L curcumin group (37.57%) was significantly higher than that in control group (4.62%). The expression levels of K-Ras, p-ERK1/2, Shh and GLI1 in curcumin groups were significantly lower than those in control group.CONCLUSIONCurcumin inhibits proliferation and induces apoptosis of pancreatic cancer cells by inhibiting Ras-ERK and Shh-GLI1 signal pathways.
Curcumin; Pancreatic neoplasms; Hedgehog; Ras-ERK pathway; Shh-GLI1 pathway
R735.9
A
10.3969/j.issn.1000-4718.2012.06.007

