远志皂苷元对氧化应激损伤的视网膜神经节细胞的保护作用*
别 曼, 徐 颖, 胡慧玲, 逯 丹, 朱丽红, 戚仁斌, 王华东, 陆大祥△
(1暨南大学医学院病理生理学系,暨南大学脑科学研究所,国家中药管理局三级科研实验室,2暨南大学-香港大学脑功能与健康联合实验室,广东广州510632;3中山大学中山眼科中心,广东广州510060)
视神经损伤是眼科和神经科的常见疾病,也是致盲的主要原因之一,病因涉及诸多因素。研究表明,外伤、青光眼[1]、缺血[2]及神经轴突损伤等[3-4]因素造成的视神经损伤,能够引发视神经节细胞(retinal ganglion cells,RGCs)内氧化应激的发生,从而导致RGCs原发或(和)继发性死亡,且死亡形式主要为细胞凋亡。
抗氧化的药物目前有多种,如中药类、维生素类及多糖类等。在中药类药物中,单体远志皂苷元(senegenin,Sen)在改善学习与记忆能力[5]、抗衰老[6]及抗氧化等[7]方面有显著作用。本教研室的前期研究发现,远志皂苷元具有抑制Aβ25-35诱导的PC12细胞凋亡,并且对缺氧/复氧损伤的PC12细胞,远志皂苷元也表现出一定的保护作用。然而远志皂苷元对氧化应激损伤的RGCs有何影响尚不清楚。本研究选取远志皂苷元作用于发生氧化应激损伤的RGCs,观察其是否对损伤的RGCs有保护作用,并初步探讨其作用机制。
材料和方法
1 材料
1.1 动物 出生3~5 d的SPF级Sprague-Dawley(SD)乳鼠,由南方医科大学动物实验中心提供。动物合格证编号为SCXK(粤)2006-0015。
1.2 主要试剂 荧光金(fluorogold,FG;Invitrogen),neurobasal培养基(含 L-glutamine,Gibco),甲基纤维素(methycellulose,Stemcell Technologies),硫酸庆大霉素 (Amresco),B27(Gibco),L-谷氨酸盐(Sigma),木瓜蛋白酶 (Worthington),L-半胱氨酸 (Sigma),多聚赖氨酸(poly-L-lysine,PLL,Sigma)[8-9],H2O2(广州化学试剂厂),Sen(中国药品生物制品检定所,纯度>98%),β3-tubulin抗体 (CST),荧光Ⅱ抗 Alexa Fluor 594(Invitrogen),Hoechst 33258凋亡试剂盒(江苏碧云天生物技术研究所),3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体 (CST),Bcl-2 抗体(Abcam),细胞色素 C抗体 (CST),cleaved caspase-3抗体 (CST)。
1.3 仪器 超净台,CO2恒温培养箱,荧光显微镜(Leica-DFC 310FX),微量进样器 (Hamilton,10 μL),Western blotting蛋白印迹电泳仪和蛋白印迹电转仪(Bio-Rad)。
2 方法
2.1 上丘FG逆行标记视神经节细胞 取出生3~5 d SD大鼠,以囟点Bregma为起始点,水平旁开1 mm处左右各取1点。每个点注射深度分别为2.0 mm和1.5 mm,0.6%FG溶液在每个深度注射量为1.25 μL。注射后微量进样器针头留置2 min,每侧注射总量为 2.5 μL[8-9]。
2.2 视神经节细胞的体外培养与鉴定
2.2.1 提前24 h在24孔板的孔内铺直径1.3 cm的无菌圆玻片,0.1%PLL包被玻片。取提前3~4 d上丘FG标记的SD乳鼠,无菌条件下取双侧视网膜,以5×105U/L木瓜蛋白酶37℃消化后,制备成混合细胞悬液[5-6]。测细胞密度为(4 ~8)×109/L。混合均匀后分到各孔中,每孔含细胞液体量达300 μL。待3 h细胞基本贴壁,再培养细胞15 h。之后用4%多聚甲醛固定细胞20 min,PBS液洗3遍,每次5 min。RGCs鉴定采用免疫细胞化学法,以β3-tubulin(1∶1 000)特异性标记视网膜神经细胞。能被FG和β3-tubulin标记的视网膜神经细胞即为视神经节细胞。
2.2.2 计算细胞活力 培养15 h,用4%多聚甲醛固定冲洗,抗荧光淬灭剂封片后,Leica荧光显微镜(激发波长361 nm,发射波长536 nm)观察,×10视野拍照,×40视野计数。采用双盲法计数[8-9],在玻片上固定一点作为计数起始点,计数相邻80个视野(×40)带荧光RGCs的总和。只对荧光显微镜下FG荧光清晰、同时对应白光视野下细胞形态完整的细胞纳入计数范围,其它情况不予计数。RGCs活力=各组带荧光RGCs总数/control组带荧光RGCs总数×100%,以control组RGCs数之和作为基数100%。实验重复4~5次,算出每次各组的RGCs活力。
2.3 H2O2损伤RGCs模型的建立 随机分为control组和 H2O24 个浓度(25、50、100、200 μmol/L)组。待细胞铺板3 h贴壁后,加入含H2O2的培养液进行损伤。15 h培养后计算RGCs活力。
2.4 Sen对氧化应激损伤的RGCs的影响
2.4.1 Sen对正常RGCs的影响 随机分为control组和 Sen 10、20、40、80、160 μmol/L 组。待细胞铺板3 h左右贴壁后,更换含有不同浓度Sen的培养基,培养15 h。细胞固定封片后,计算RGCs活力。
2.4.2 Sen对 H2O2损伤 RGCs的影响 随机分为control组、0.1%DMSO 组、50 μmol/L H2O2组和H2O250 μmol/L+Sen(10、20 和 40 μmol/L)组。培养15 h后固定封片,计算RGCs活力。
2.5 视网膜细胞凋亡和凋亡蛋白的表达 分离的视网膜体外培养,随机分组为control组、50 μmol/L H2O2组、H2O250 μmol/L+Sen 40 μmol/L 组和 Sen 40 μmol/L组。培养15 h后,进行如下处理。
2.5.1 Sen H2O2损伤视网膜细胞凋亡的影响 Hoechst 33258可以透过细胞膜,与DNA结合后形成蓝色荧光,常用于检测细胞凋亡。视网膜细胞在处理后,弃去培养基加入4%多聚甲醛固定20 min,PBS洗2遍后,加入Hoechst 33258染液避光反应5 min,PBS洗2遍后封片,荧光显微镜下拍照(激发波长350 nm,发射波长460 nm)。
2.5.2 Western blotting 检测胞浆 Bcl-2、细胞色素C和cleaved caspase-3蛋白的表达 吸去板中培养液,每孔加60 μL细胞裂解液冰上裂解30 min后,转移到离心管,4℃ 12 000 r/min离心5 min,上清分装转移到离心管中,-20℃保存。蛋白经BCA法定量后,配置SDS-PAGE凝胶,上样电泳,电转蛋白,抗体孵育后显影。结果以目的条带与内参照GAPDH条带的灰度比值来评定蛋白质表达的相对含量。
3 统计学处理
结 果
1 逆行标记和体外培养
1.1 FG标记视网膜 FG通过轴浆逆向传输从上丘到达视网膜神经节细胞。视网膜的矢状切片(图1A、B)可见被绿色荧光标记的细胞位于视网膜的是神经节细胞胞体层。视网膜平铺片(图1C、D)可以清楚看到整个视网膜满布被FG标记的RGCs,呈放射状分布,图中放射状分布的黑线为血管,见图1。
1.2 体外培养 视神经节细胞体外培养能够存活至少15 h,并能被FG和β3-tubulin成功双标,见图2。
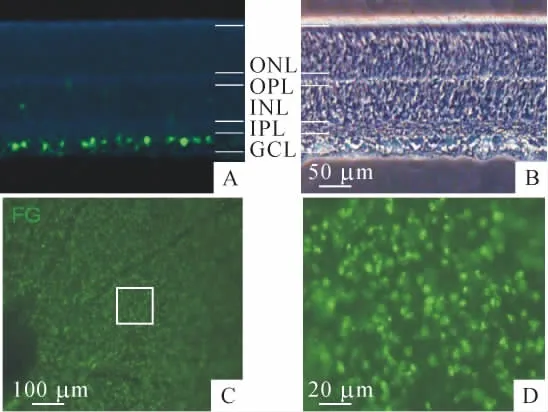
Figure 1.RGCs were retrogradely labeled by fluorogold injection in superior colliculi.A,B:labeled RGCs in the retinal slice under fluorescent(A)and bright field(B);C:labeled RGCs in the retinal whole mount;D:enlarged area showed labeled RGCs.GCL:ganglion cell layer;IPL:inner plexiform layer;OPL:outer plexiform layer;INL:inner nuclear layer;ONL:outer nuclear layer.图1 上丘注射荧光金标记视网膜的RGCs
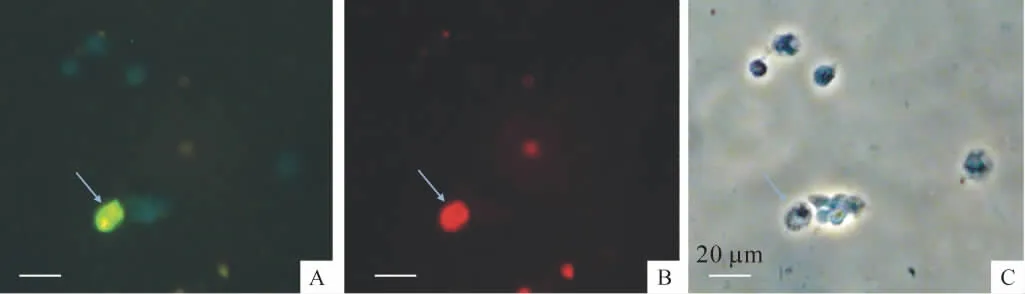
Figure 2.In vitro cultured RGCs(indicated by the arrows)were labeled by fluorogold(A)and β3-tubulin(B).C:the corresponding bright field view.图2 体外培养的RGCs
2 H2O2损伤RGCs模型建立
不同浓度H2O2损伤RGCs 30 min后RGCs活力见表1,H2O225、50、100 和200 μmol/L 各组RGCs活力与control组相比都下降,差异显著(P<0.05)。其中50 μmol/L H2O2损伤 RGCs 30 min 后,RGCs活力在60%~75%之间。因此选此浓度作为H2O2损伤RGCs 30 min的最适损伤浓度来建立损伤模型。
3 Sen对RGCs的影响
3.1 Sen对RGCs活力的影响 不同浓度Sen对RGCs活力的影响见表 1,Sen 10、20 和 40 μmol/L时,RGCs活力与control组相比无统计学意义(P>0.05)。而 Sen 80和 160 μmol/L时,RGCs活力与control组相比活力显著下降(P<0.01)。因此选用Sen 10、20和40 μmol/L 3个浓度进行后续实验。
3.2 Sen对氧化应激损伤RGCs活力的影响 H2O2损伤后,不同浓度Sen对RGCs的影响见图3,与control组比较,H2O2组RGCs活力显著下降 (P<0.01)。在H2O2损伤后应用10、20和40 μmol/L Sen处理,各组RGCs活力与H2O2组比较有显著升高(P<0.05),且Sen浓度在40 μmol/L时,保护作用最佳。
表1 不同浓度H2O2和Sen对RGCs活力的影响Table 1.The RGCs viability after treatment with different concentrations of H2O2or Sen(%.±sE)
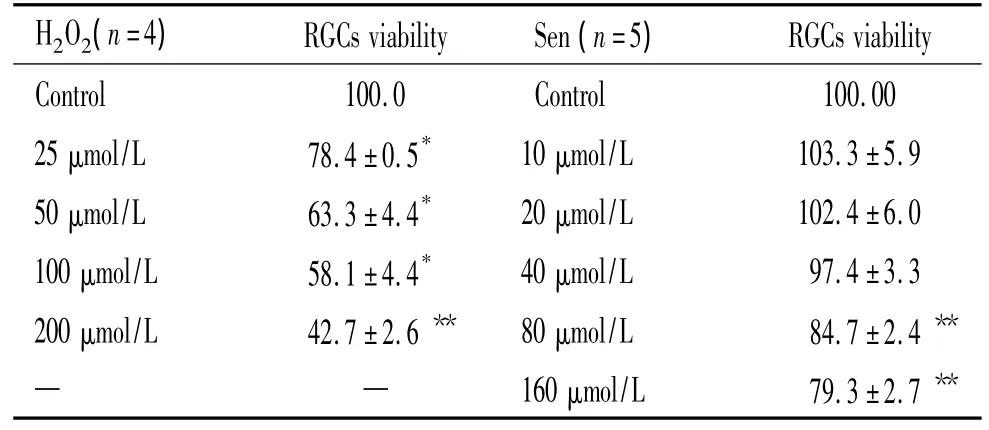
表1 不同浓度H2O2和Sen对RGCs活力的影响Table 1.The RGCs viability after treatment with different concentrations of H2O2or Sen(%.±sE)
*P <0.05,**P <0.01 vs control.
H2O2(n=4) RGCs viability Sen(n=5)RGCs viability Control 100.0 Control 100.00 25 μmol/L 78.4±0.5* 10 μmol/L 103.3 ±5.9 50 μmol/L 63.3±4.4* 20 μmol/L 102.4 ±6.0 100 μmol/L 58.1±4.4* 40 μmol/L 97.4 ±3.3 200 μmol/L 42.7±2.6 ** 80 μmol/L 84.7 ±2.4 **——160 μmol/L 79.3 ±2.7**
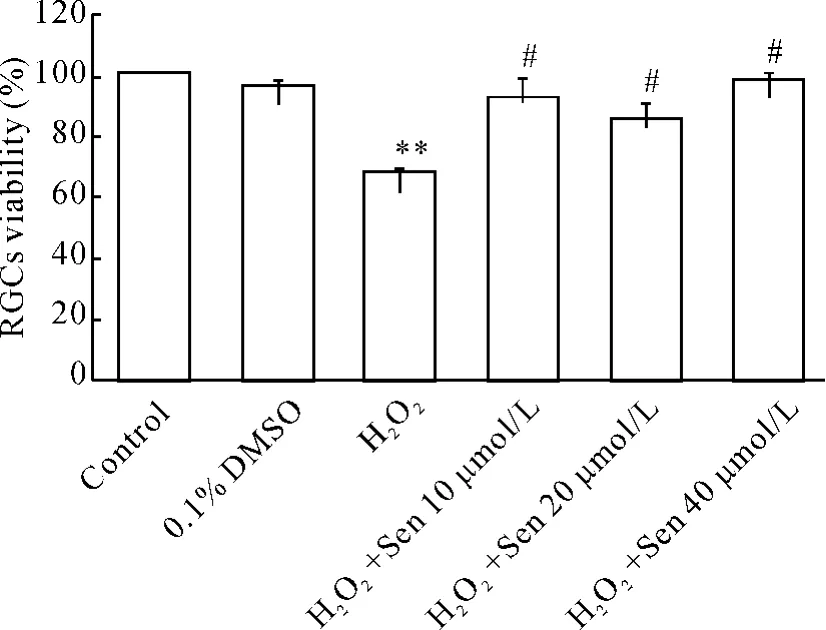
Figure 3.Effects of Sen on the viability of H2O2-treated RGCs.RGCs were treated with 50 μmol/L H2O2or/and Sen at doses of 10,20 and 40 μmol/L for 15 h.±sE.n=5.**P <0.01 vs control;#P <0.05 vs H2O2.图3 不同浓度Sen对H2O2损伤后RGCs活力的影响
4 凋亡相关的检测结果
4.1 Hoechst 33258染色细胞形态观察 Hoechst 33258染细胞核后发现,control组(图4A)细胞核呈均一低强度荧光,可见少量高亮度的凋亡形态细胞核;H2O2组(图4B)大量细胞核呈现高亮度浓染、核固缩状态,凋亡形态特征的细胞多于control组;H2O2+Sen组(图4C)高亮浓染、核固缩形态的细胞数少于H2O2组;而Sen组(图4D)凋亡特征形态的细胞数少,多数细胞核呈现均一低强度荧光。
4.2 Sen对凋亡相关蛋白的影响
4.2.1 Bcl-2 蛋白表达 Western blotting结果显示,与control组比较,H2O2组Bcl-2蛋白表达降低,差异显著(P<0.05);与H2O2组比较,H2O2+Sen 40 μmol/L组Bcl-2蛋白表达增高,差异显著(P<0.05);与 control组比较,Sen 40 μmol/L 组 Bcl-2蛋白表达增高,差异显著(P<0.05),见图5。
4.2.2 细胞色素 C表达 Western blotting结果显示,与control组比较,H2O2组细胞色素C表达升高,差异显著(P<0.01);与H2O2组比较,H2O2+Sen 40 μmol/L组细胞色素C表达降低,差异显著(P<0.01);与 control组比较,Sen 40 μmol/L 组细胞色素C表达无显著差异(P>0.05),见图5。
4.2.3 Cleaved caspase-3 蛋白表达 Western blotting结果显示,与 control组比较,H2O2组活化的caspase-3蛋白表达升高,差异显著(P<0.05);与H2O2组比较,H2O2+Sen 40 μmol/L 组活化的caspase-3蛋白表达降低,但无显著差异(P>0.05);与 control组比较,Sen 40 μmol/L 组活化的caspase3蛋白表达降低,差异显著(P<0.05),见图5。

Figure 4.Effects of Sen on the apoptosis of H2O2-treated RGCsdetected using Hoechst 33258 staining.A:control;B:H2O250 μmol/L;C:H2O2+Sen 40 μmol/L;D:Sen 40 μmol/L.Apoptotic cells were indicated by arrows.图4 Sen对氧化应激损伤的RGCs凋亡的影响
讨 论
活性氧簇(reactive oxygen species,ROS)存在于细胞正常代谢过程中[10-13],并且处于动态平衡状态。但在某些疾病或病理状态如线粒体电子传递链被中断后,ATP供应充足时,ROS大量产生。大量研究已证实在海马的神经元[14]、交感神经元[15]、小脑的颗粒细胞[16]及 RGCs 等[17]多种神经细胞中,ROS在细胞死亡信号通路中都起到一定的作用。视神经节细胞在轴突损伤后能发生氧化应激而引起凋亡[18-19],并且存在通过影响线粒体功能引起细胞凋亡[20]。及时阻断凋亡发生,保护视神经节细胞成为治疗的关键。针对氧化应激的发生,已证实某些中药皂苷单体有较好的效果。远志皂苷元能够有效保护体外培养的海马的神经元抵挡氧化应激产物乙二醛[21]和 H2O2[22]的毒性作用。本实验进一步证实选择远志皂苷元可以对抗氧化应激对RGCs的损伤,从而为RGCs的临床保护提供了实验依据。
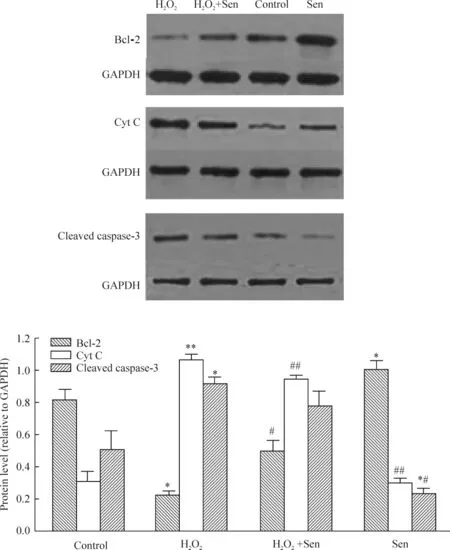
Figure 5.Effects of Sen(40 μmol/L)on the expression of Bcl-2,cytochrome C(Cyt C)and cleaved caspase-3 proteins in RGCs after H2O2(50 μmol/L)injury.±sE.n=4.*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs H2O2.图5 Sen对氧化应激损伤的RGCs Bcl-2、细胞色素C和cleaved caspase-3蛋白表达的影响
本实验采用H2O2诱导的RGCs损伤模型,观察远志皂苷元对损伤RGCs的作用及初步探讨作用机制。实验证实,50 μmol/L H2O2作用于培养3 h后贴壁的RGCs 30 min,即可造成对RGCs的氧化应激损伤,神经元的活力降低;而损伤后与Sen 40 μmol/L共培养15 h后,RGCs的活力显著升高,这与有文献报道的结果相似[21]。RGCs发生氧化应激损伤后,细胞凋亡与线粒体途径非常相关,其中Bcl-2家族、细胞色素C及caspase家族在其中又扮演非常关键的角色,我们的结果发现,与control组比较,H2O2组的细胞色素C和cleaved caspase-3蛋白表达明显增加,Bcl-2蛋白表达显著减少(P<0.05);而H2O2+Sen 40 μmol/L组与 H2O2组相比,Bcl-2蛋白表达明显增高,细胞色素C蛋白的表达量显著降低(P<0.05)。cleaved caspase-3蛋白表达量也有降低。说明Sen可能通过上调Bcl-2和下调促凋亡蛋白来实现抑制细胞凋亡发生。
由此可见,Sen具有一定的抗氧化作用。其作用机制可能与稳定细胞内线粒体膜,减少细胞色素C的释放,上调抑凋亡蛋白Bcl-2的表达有关。由于原代RGCs相对易损伤,其纯化过程复杂,原代视网膜细胞混合培养模型又最接近于视网膜的正常生理状态,因此是筛选有效药物的首选模型。但对于机制的初步研究,此结果是建立在混合视网膜细胞培养模型的基础上,其保护途径究竟是只通过影响RGCs本身,还是同时也通过影响其它视网膜细胞来实现调控,需要通过纯化RGCs模型的进一步验证,这也将成为下一步研究的重点。
[1]Tezel G.Oxidative stress in glaucomatous neurodegeneration:mechanisms and consequences[J].Prog Retin Eye Res,2006,25(5):490 -513.
[2]Dvoriantchikova G,Grant J,Santos AR,et al.Neuronal NAD(P)H oxidases contribute to ROS production and mediate RGC death after ischemia[J].Invest Ophthalmol Vis Sci,2012,53(6):2823 -2830.
[3]Lieven CJ,Hoegger MJ,Schlieve CR,et al.Retinal ganglion cell axotomy induces an increase in intracellular superoxide anion [J].Invest Ophthalmol Vis Sci,2006,47(4):1477-1485.
[4]Swanson KI,Schlieve CR,Lieven CJ,et al.Neuroprotective effect of sulfhydryl reduction in a rat optic nerve crush model[J].Invest Ophthalmol Vis Sci,2005,46(10):3737-3741.
[5]韦 佳,陆大祥,戚仁斌,等.抗衰益智方Ⅰ对小鼠学习记忆能力以及海马胆碱乙酰转移酶表达的影响[J].中国病理生理杂志,2010,26(10):2051.
[6]闫 明,李 萍.远志抗衰老作用的研究[J].实用药物与临床,2006,9(1):22-23.
[7]Liang Z,Shi F,Wang Y,et al.Neuroprotective effects of tenuigenin in a SH-SY5Y cell model with 6-OHDA-induced injury[J].Neurosci Lett,2011,497(2):104 -109.
[8]Zhang X,Zhang M,Laties AM,et al.Stimulation of P2X7 receptors elevates Ca2+and kills retinal ganglion cells[J].Invest Ophthalmol Vis Sci,2005,46(6):2183 -2191.
[9]Hu H,Lu W,Zhang M,et al.Stimulation of the P2X7receptor kills rat retinal ganglion cells in vivo[J].Exp Eye Res,2010,91(3):425 -432.
[10]Clark RA.Activation of the neutrophil respiratory burst oxidase[J].J Infect Dis,1999,179(Suppl 2):S309 -S317.
[11]Dalton TP,Shertzer HG,Puga A.Regulation of gene expression by reactive oxygen[J].Annu Rev Pharmacol Toxicol,1999,39:67 -101.
[12]Finkel T.Oxygen radicals and signaling[J].Curr Opin Cell Biol,1998,10(2):248 -253.
[13]Goldschmidt Clermont PJ,Moldovan L.Stress,superoxide,and signal transduction[J].Gene Expr,1999,7(4-6):255-260.
[14]Chan SL,Tammariello SP,Estus S,et al.Prostate apoptosis response-4 mediates trophic factor withdrawal-induced apoptosis of hippocampal neurons:actions prior to mitochondrial dysfunction and caspase activation[J].J Neurochem,1999,73(2):502-512.
[15]Greenlund LJ,Deckwerth TL,Johnson EM Jr.Superoxide dismutase delays neuronal apoptosis:a role for reactive oxygen species in programmed neuronal death[J].Neuron,1995,14(2):303-315.
[16]Schulz JB,Weller M,Klockgether T.Potassium deprivation-induced apoptosis of cerebellar granule neurons:asequential requirement for new mRNA and protein synthesis,ICE - like protease activity,and reactive oxygen species[J].J Neurosci,1996,16(15):4696 -4706.
[17]Geiger LK,Kortuem KR,Alexejun C,et al.Reduced redox state allows prolonged survival of axotomized neonatal retinal ganglion cells[J].Neuroscience,2002,109(3):635-642.
[18]Levkovitch-Verbin H,Harris-Cerruti C,Groner Y,et al.RGC death in mice after optic nerve crush injuryoxidative stress and neuroprotection[J].Invest Ophthalmol Vis Sci,2000,41(13):4169 -4174.
[19]Mackey AM,Sanvicens N,Groeger G,et al.Redox survival signalling in retina-derived 661W cells[J].Cell Death Differ,2008,15(8):1291 -1303.
[20]Lieven CJ,Vrabec JP,Levin LA.The effects of oxidative stress on mitochondrial transmembrane potential in retinal ganglion cells[J].Antioxid Redox Signal,2003,5(5):641-646.
[21]Chen YJ,Huang XB,Li ZX,et al.Tenuigenin protects cultured hippocampal neurons against methylglyoxal-induced neurotoxicity[J].Eur J Pharmacol,2010,645(1-3):1-8.
[22]张 晶,戚仁斌,汪志刚,等.远志皂苷元对H2O2诱导的大鼠海马神经元损伤的影响及其机制[J].中国病理生理杂志,2011,27(6):1059-1065.

