Fas相关因子1的研究进展*
董少男, 谢琪璇△, 秋山泰身, 高桥祐司, 秦俊文,2△
(暨南大学1生命科学技术学院生殖免疫研究所,2再生医学教育部重点实验室,广东 广州 510632;3东京大学医科学研究所分子发癌分野,日本 东京108-8639;4国立成育医疗研究中心生殖·细胞医疗研究部,日本 东京157-8535)
1000-4718(2012)03-0565-06
2011-09-02
2011-10-21
广东省自然科学基金资助项目(No.9451063201002016);教育部留学回国人员科研启动基金资助项目(No.23610022);暨南大学引进人才科研启动基金资助项目(No.51209004);中央高校基本科研业务费专项资金资助项目(No.21610406)
△通讯作者 Tel:020-85220235;E-mail:tjunwen@jnu.edu.cn;txqx@jnu.edu.cn
Fas相关因子1的研究进展*
董少男1, 谢琪璇1△, 秋山泰身3, 高桥祐司4, 秦俊文1,2△
(暨南大学1生命科学技术学院生殖免疫研究所,2再生医学教育部重点实验室,广东 广州 510632;3东京大学医科学研究所分子发癌分野,日本 东京108-8639;4国立成育医疗研究中心生殖·细胞医疗研究部,日本 东京157-8535)
Fas相关因子1(Fas-associated factor 1,FAF1)是一种细胞内蛋白质,在不同细胞中可存在于细胞核、核仁及核周细胞质中[1-3]。FAF1是一种进化上保守的蛋白质,约74 kD,由650个氨基酸组成,含有多个功能结构域,包括Fas作用结构域(Fas-interacting domain,FID)、死亡效应结构域作用结构域(death effecter domain-interacting domain,DEDID)、泛素样调节X结构域(ubiquitin-like regulatory X domain,UBX)等[4]。FAF1最初被认为是Fas死亡诱导信号复合体的一员,促进细胞凋亡[1]。随后的研究表明FAF1下调核转录因子κB(nuclear transcription factor κB,NF-κB)信号通路,在泛素-蛋白酶体信号途径中调节蛋白降解[5],并且可以抑制Wnt/β-连环蛋白(β-catenin)信号途径[6]。FAF1广泛表达于多种组织中[1,7-8],具有多重生理功能[7,9]。此外,FAF1在几种癌症中呈现出表达缺失或下调,其功能的缺失可以为某些肿瘤细胞提供促生存信号[10-12],所以FAF1也被认为是一种肿瘤抑制基因。本文拟从FAF1的结构、表达和生理功能、涉及的信号通路以及与疾病的关系等几个方面对其作一综述。
1 FAF1的结构
FAF1含多个功能结构域,包括氨基末端的FID结构域,氨基酸跨度为1~181;DEDID结构域,氨基酸跨度为181~381;羧基末端的UBX结构域,氨基酸跨度为571~650[4],见图1。
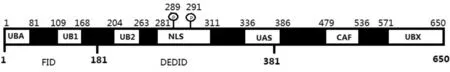
Figure 1. Schematic diagram of FAF1 structure.FAF1:Fas-associated factor 1;FID:Fas-interacting domain;DEDID:death effector domain-interacting domain;UBA:ubiquitin-associated domain;UB:ubiquitin homologous domain;NLS:nuclear localization signal;UAS:homologous withC.elegansopen reading frame C281.1;CAF:homology with human chromatin assembly factor p150 subunit;UBX:ubiquitin-like regulatory X domain.
图1FAF1的结构
FID是Fas结合结构域,包含1个泛素相关结构域(ubiquitin-associated domain,UBA)和1个泛素同源结构域1(ubiquitin homologous domain 1,UB1)。FID与Fas结合引发Fas诱导的细胞凋亡;与IκB激酶β(IκB kinase β,IKKβ)结合,阻断IκB激酶(IκB kinase,IKK)复合物的形成,抑制NF-κB信号通路的活性;同赖氨酸(lysine,Lys)48/Lys63偶联泛素化蛋白作用则抑制多泛素化蛋白的降解[2,5,13-14]。人FAF1可通过FID结构域直接与热休克蛋白70(heat shock protein 70,HSP70)结合[15],这种结合作用在三磷酸腺苷(adenosine triphosphate,ATP)和休克处理中均能保持稳定。HSP70和FAF1共存在于细胞质及细胞核中,在热休克情况下于核周集聚[15],FAF1抑制HSP70伴侣蛋白的活性,加速热休克诱导的应激活化的蛋白激酶(stress-activated protein kinases,SAPKs)/ c-Jun N端激酶(c-jun N-terminal kinases,JNK)的激活,以结合依赖模式促进热休克诱导的细胞死亡[15]。这些研究表明人FAF1通过结合HSP70从而抑制伴侣蛋白的活性,阻止细胞应激后的恢复。
DEDID结构域包含泛素同源结构域2(ubiquitin homologous domain 2,UB2)、核定位信号(nuclear localization signal,NLS)以及UAS(homologous withC.elegansopen reading frame C281.1)结构域,另外在289和291氨基酸残基上还存在2个丝氨酸磷酸化位点。磷酸化的FAF1与Aur-A激酶(aurora A kinase)的负反馈调节有关[14]。DEDID和Fas相关死亡域蛋白(Fas-associated protein with death domain,FADD)及半胱天冬酶8(caspase-8)作用可以直接启动细胞凋亡或者增强Fas诱导的细胞凋亡[3,8,16]。DEDID还可以介导死亡效应丝(death effector filament,DEF)形成,促进细胞凋亡[17]。DEDID与p65作用阻断p65的细胞核转位,从而抑制NF-κB信号通路的激活[18-19]。UBX结构域由80个氨基酸残基组成,UBX结构域在结构上和泛素结构域具有同源性。研究表明FAF1可以通过羧基末端的UBX结构域和含缬酪肽蛋白(valosin-containing protein,VCP)的N端结构域结合,从而抑制蛋白酶体降解途径[20]。
另外,鹌鹑FAF1在细胞核中的分布依赖一种特殊的α-螺旋结构域,这种α-螺旋结构域由35个氨基酸组成,位于鹌鹑FAF1的N端,对鹌鹑FAF1在细胞核定位是必需的也是足够的[1],但是具体的入核机制尚不清楚。鹌鹑FAF1是否可以像染色质组装因子(chromatin assembly factor,CAF)一样通过亲水性的α-螺旋结构域2结合到碱性核蛋白上仍有待确认。
此外,研究表明FAF1还是瞬时受体电位阳离子通道家族成员1(transient receptor potential cation channel,subfamily V,member 1,TRPV1)的调节因子,在感觉神经元细胞中与TRPV1共表达并与TRPV1结合[21]。异位表达FAF1可以减少TRPV1对辣根辣素、酸和热的药理学水平的反应强度,RNA干扰沉默FAF1基因可以增强神经元细胞中TRPV1对辣根辣素的敏感性[21]。
2 FAF1的表达及功能
FAF1表达于多种动物的多种组织细胞中。研究表明胚胎发育期间FAF1基因在斑马鱼的软骨中高表达[9]。对鹌鹑胚胎的研究表明,孵化1 d及孵化6 d的胚胎中广泛表达FAF1 mRNA,并且孵化6天胚胎的中枢神经系统中表达明显增强[1];孵化12 d的胚胎中FAF1 mRNA高表达于脑、心脏、肝脏、肺和肾中,而皮肤和脾脏中表达相对较低[1]。
小鼠FAF1基因定位于4号染色体4C6区[22]。RNA印迹技术(Northern blotting)分析表明小鼠FAF1 mRNA在肌肉、胸腺、肺、肝脏、肾脏、心脏、脑、卵巢及睾丸中均有表达,其中睾丸中的表达水平较高[7]。另外,FAF1基因在小鼠胚胎发育后期的脑中高表达[23]。蛋白质印迹技术分析表明,多种组织包括胰腺、胸腺、脾、肝脏、肾脏、卵巢、脑和睾丸均表达74 kD的FAF1蛋白[7]。然而,睾丸发育过程中除了稳定均一地表达74 kD型蛋白外,还高表达一种49 kD的特异型FAF1蛋白[7],这种蛋白亚型在雄鼠出生后30 d才开始检测到[7],它可能是精细胞中74kD FAF1蛋白降解的结果[7]。RT-PCR可检测到从4细胞阶段到囊胚阶段的胚胎表达FAF1 mRNA[7];免疫染色表明卵母细胞、合子、2细胞、4细胞以及8细胞胚胎表达FAF1[7],8细胞期之后的早期胚胎中是否表达FAF1以及FAF1的表达型有待进一步确认。利用基因芯片(gene chip)分析技术,我们发现着床后的胚胎中FAF1表达比着床前显著升高(结果待发表)。然而FAF1在着床过程胚胎中的时空表达情况及其对胚胎着床的影响仍不清楚。发育中的胚胎嗅觉系统高表达FAF1,出生后下调[24]。
人的FAF1基因定位于染色体1q32区[16]。FAF1 mRNA在睾丸、骨骼肌、心脏、卵巢、前列腺、胸腺、结肠、小肠、脾、胰腺、肾脏、肝脏、肺、脑等多种组织中表达[8],其中睾丸、骨骼肌、心脏的表达较高。此外,人FAF1蛋白还在多种细胞系中表达,包括人类黑色素瘤细胞系HM7、人类结肠癌细胞系HCT166、慢性粒细胞性白血病细胞系 K562、人类乳腺癌细胞系K10、绿猴肾细胞系COS7以及人T细胞肿瘤细胞系 Jurkat细胞等[8]。其中K10细胞中FAF1蛋白以40 kD的形式存在、COS7细胞中同时存在74 kD和40 kD两种形式、其余细胞中均以74 kD的形式存在[8]。40 kD的FAF1有可能是74 kD FAF1的蛋白水解产物,也可能是74 kD FAF1的同源蛋白,具体尚不清楚。
氨基酸序列比较发现,人FAF1与鼠、鹌鹑FAF1的同源性分别是96%、85%[8]。 研究FAF1的功能时发现,RNA干扰介导的Ubxn-3(漂亮新小干线虫的FAF1同源基因)基因抑制可导致早期胚胎死亡[25-26],但果蝇属种的caspar/FAF1基因突变型是半致死的[27];敲出斑马鱼的FAF1基因可导致咽软骨缺损以及下颚异常[9],FAF1基因的损伤使人易患腭裂疾病[9];FAF1基因敲出小鼠在2细胞胚胎期死亡[7]。
3 FAF1参与调节的信号通路
3.1FAF1与细胞凋亡途径 FAF1缺乏死亡结构域,在小鼠成纤维细胞系L细胞中过表达可以增强Fas介导的细胞凋亡,但是不能启动凋亡[28]。当FAF1过表达时,Fas抗体诱导的细胞凋亡的凋亡率可从30%增加到60%[28]。与小鼠FAF1不同的是,人FAF1在缺失外源死亡信号的情况下,可以在BOSC23细胞中启动细胞凋亡并且凋亡的发生不需要Fas结合结构域的参与,但需要FAF1的181~381肽段的参加[25]。这些结果表明FAF1可以增强Fas诱导的细胞凋亡或在某些情况下直接启动细胞凋亡。此外,FAF1还可以通过形成DEF介导细胞凋亡[17]。 因此,FAF1可通过两种机制,一种是形成Fas-死亡诱导信号复合体(death-inducing signal complex,DISC),即通过受体依赖型凋亡途径;另一种是形成DEF,即通过非受体依赖型凋亡途径促进细胞凋亡。
含有死亡效应结构域(death effecter domain,DED)的蛋白可能具有调节细胞凋亡的功能,如FADD、caspase-8以及casper等。虽然FAF1没有典型死亡结构域,但FID结构域可以和Fas的死亡结构域结合。此外,FAF1可以通过DEDID结构域与半胱天冬酶8及FADD的DED发生作用。研究证明FAF1和FADD及caspase-8一样,与Fas共定位于Jurkat细胞中[29]。另外,在半胱天冬酶8缺陷的Jurkat细胞中,FAF1引起的凋亡显著受到抑制[29]。FAF1和FADD具有相似的蛋白作用特性,但FAF1要比FADD大得多[30]。因此,FAF1有可能作为支架蛋白联系Fas、FADD和caspase-8。
缺乏DEDID结构域的FAF1突变型抑制Fas诱导的细胞凋亡,说明DEDID在Fas诱导的细胞凋亡中具有重要作用[31]。FAF1存在一种亚型,大小为57 kD,这种亚型中绝大多数DEDID结构域是缺失的。虽然还没有通过蛋白质印迹实验检测到57 kD FAF1蛋白,但在人类肝脏和HeLa细胞文库中均发现了这种亚型的cDNA[29]。57kD FAF1在体内的作用及存在的意义需进一步阐明。
3.2 FAF1与NF-κB信号途径研究表明在HEK293细胞中,过表达FAF1可抑制IKK复合体形成从而减弱IKKβ活性,相反,当FAF1受到抑制时可以增强IKK活性,说明FAF1可抑制IKK活性,进而抑制NF-κB信号通路的活性[18]。FAF1基因缺陷的恶性皮间瘤细胞(malignant mesothelioma,MM)中恢复FAF1的表达可减少细胞核中p65的水平并且减弱NF-κB活性,相反, FAF1阳性MM细胞中FAF1的表达抑制则会导致NF-κB信号通路活性上调[19]。FAF1可以和p65作用,阻止p65进入细胞核,从而抑制肿瘤坏死因子α(tumor necrosis factor,TNF-α)诱导的NF-κB信号通路激活[32]。FAF1与p65的作用是受到严格调控的[32]。
Caspase-8可以和NF-κB途径中的多种蛋白作用,如NF-κB诱导激酶(NF-κB-inducing kinase,NIK)、IKKα和IKKβ[33],从而激活NF-κB信号通路。FAF1的DEDID可以同caspase-8的DED作用[29],从而阻碍caspase-8再与NF-κB信号途径的成员结合。FAF1与caspase-8的结合同样也减弱了caspase-8对NF-κB激活的正向影响作用。因此,除了与p65结合外,FAF1和caspase-8的结合也可能对NF-κB的激活具有负向调节作用。
FAF1抑制NF-κB信号通路的活性,同时作为Fas-DISC的成员促进细胞凋亡,虽然这两种途径都促进凋亡发生,但这两种作用途径的关系以及它们是否作用于同样的凋亡效应分子仍然未知,但FAF1可能同时通过这两种途径增强其对细胞凋亡的作用效力[18]。
3.3FAF1与泛素-蛋白酶体信号途径 研究表明FAF1可能作为支架蛋白在泛素-蛋白酶体信号途径中调节蛋白降解。FAF1包含多个泛素相关结构域,如UBA、UB1、UB2、UAS、UBX等。UBX和UBA可分别与含缬酪肽蛋白及多泛素化的底物相互作用[5]。细胞分裂周期基因48(cell division cycle gene 48,CDC48)和TER94是VCP的同源基因,敲除酵母的CDC48基因以及敲除果蝇的TER97基因是致死性的[34-35],敲除小鼠VCP基因可导致胚胎在着床前死亡[36]。FAF1对于泛素化蛋白来说可能是一种募集VCP的附加因子,并且FAF1可以在泛素-蛋白酶体信号途径中调节蛋白质降解[5,11,37-38]。小鼠敲除FAF1和VCP基因均导致胚胎早期死亡表明,FAF1-VCP蛋白复合体在细胞生长和存活中具有重要的作用[36]。
3.4 FAF1与Wnt信号途径 最近的研究表明FAF1抑制Wnt/β-连环蛋白信号途径[6]。过表达FAF1显著抑制Wnt诱导的转录报告分子的活性,并且阻碍Wnt诱导的β-连环蛋白的集聚[6]。相反,抑制FAF1基因可增加β-连环蛋白水平,增强Wnt/β-连环蛋白信号诱导的转录活性。研究揭示了异位表达FAF1可以增强β-连环蛋白的多泛素化,促进β-连环蛋白的降解[6]。KS483成骨细胞前体细胞中FAF1缺失导致内源性Wnt诱导基因的活性增加,增强成骨细胞的分化,而过表达FAF1则相反[6]。FAF1的UBX结构域在FAF1诱导的β-连环蛋白多泛素化过程中是必须的,但具体作用机制仍不清楚。
4 FAF1与疾病的关联
帕金森病及阿尔茨海默病病人额皮质中FAF1的表达显著上调,暗示FAF1与帕金森病的发病有关[39]。此外,FAF1可能与某些肿瘤的发生有关。目前已在多种人类癌症中检测到FAF1的缺失或下调。例如,人胃癌中FAF1下调的病例占有很高的百分比[10]、子宫颈癌中有近30%的基因组缺失发生在FAF1基因座、恶性皮间瘤中FAF1频繁下调[19],等等。这些研究表明FAF1的丢失是人类癌症中的一个普遍现象,而FAF1可以作为肿瘤抑制因子,它的丢失与肿瘤的多样性起源有关。
5 结语
FAF1是一种重要的胞内蛋白,含有多个功能结构域,参与多种信号通路的调节。FAF1具有多种重要的生理功能,且与多种疾病的发生密切相关。然而与FAF1相关的诸多问题仍待阐明。
FAF1基因在不同的发育阶段和不同的细胞中可以产生几种不同的蛋白亚型,如睾丸中49 kD特异型蛋白、K10细胞中40 kD蛋白、人类肝脏和HeLa细胞文库中发现了 cDNA然而尚未检测到表达的57 kD蛋白,这些蛋白是如何产生以及其确切的功能均不清楚。这些问题的阐明有助于我们进一步认识和理解FAF1。
研究表明FAF1在多种组织中表达,但FAF1在这些组织中的确切功能仍待进一步解明。FAF1基因敲除的纯合子大多死于胚胎发育早期,从而限制了应用FAF1基因敲除的模式生物来探索FAF1的功能。因此,构建和利用FAF1条件性基因敲除(conditional knockout)的模式生物或许有利于阐明FAF1的生理功能。
FAF1在帕金森病和癌症等疾病中的表达及其对这些疾病的影响显示出FAF1或许是这些疾病治疗的一个靶标基因。然而,FAF1在这些疾病发生和发展过程中的确切作用及其机制仍待进一步阐明。
以上问题的阐明,将有助于我们深刻理解和认识FAF1在各种生理和病理条件下的确切作用,从而为疾病的治疗等提供理论依据和新的突破口,为人类健康做出贡献。
[1] Fröhlich T,Risau W,Flamme I. Characterization of novel nuclear targeting and apoptosis-inducing domains in FAS associated factor 1[J]. J Cell Sci,1998,111(Pt 16):2353 -2363.
[2] Jensen HH,Hjerrild M,Guerra B,et al. Phosphorylation of the Fas-associated factor FAF1 by protein kinase CK2 and identification of serines 289 and 291 as theinvitrophosphorylation sites[J]. Int J Biochem Cell Biol,2001,33(6):577-589.
[3] Ryu SW,Kim E. Apoptosis induced by human Fas-associated factor 1,hFAF1,requires its ubiquitin homologous domain,but not the Fas-binding domain[J]. Biochem Biophys,2001,286(5):1027-1032.
[4] Menges CW,Altomare DA,Testa JR. Fas-associated factor 1(FAF1):diverse functions and implications for oncogenesis[J]. Cell Cycle,2009,8(16):2528-2534.
[5] Song EJ,Yim SH,Kim E,et al. Human Fas-associated factor 1,interacting with ubiquitinated proteins and valosin-containing protein,is involved in the ubiquitin-proteasome pathway[J]. Mol Cell Biol,2005,25(6):2511-2524.
[6] Zhang L,Zhou F,van Laar T,et al. Fas-associated factor 1 antagonizes Wnt signaling by promoting β-catenin degradation[J]. Mol Biol Cell,2011,22(9):1617-1624.
[7] Adham IM,Khulan J,Held T,et al. Fas-associated factor(FAF1)is required for the early cleavage-stages of mouse embryo[J]. Mol Hum Reprod,2008,14(4):207-213.
[8] Ryu SW,Chae SK,Lee KJ,et al. Indentification and characterization of human Fas associated factor 1,hFAF1[J]. Biochem Biophys Res Commun,1999,262(2):388-394.
[9] Ghassibe-Sabbagh M,Desmyter L,Langenberg T,et al.FAF1,a gene that is disrupted in cleft palate and has conserved function in zebrafish[J]. Am J Hum Genet,2011,88(2):150-161.
[10]Bjørling-Poulsen M,Seitz G,Guerra B,et al. The pro-apoptotic Fas-associated factor 1 is specifically reduced in human gastric carcinomas[J]. Int J Oncol,2003,23(4):1015-1023.
[11]Hartmann-Petersen R,Wallace M,Hofmann K,et al. The Ubx2 and Ubx3 cofactors direct Cdc48 activity to proteolytic and nonproteolytic ubiquitin-dependent processes[J]. Curr Biol,2004,14(9):824-828.
[12]MacDonald BT,Tamai K,He X. Wnt/β-catenin signaling:components, mechanisms and diseases[J]. Dev Cell, 2009, 17(1):9-26.
[13]Guerra B,Boldyreff B,Issinger OG. FAS-associated factor 1 interacts with protein kinase CK2invivoupon apoptosis induction[J]. Int J Oncol,2001,19(6):1117-1126.
[14]Jang MS,Sul JW,Choi BJ,et al. Negative feedback regulation of Aurora-A via phosphorylation of Fas-associated factor-1[J]. J Biol Chem,2008,283(47):32344-32351.
[15]Kim HJ,Song EJ,Lee YS,et al. Human Fas-associated factor 1 interacts with heat shock protein 70 and negatively regulates chaperone activity[J]. J Biol Chem,2005,280(9):8125-8133.
[16]Ryu SW,Kim HS,Yoon SK,et al. Human Fas associated factor 1,hFAF1,gene maps to chromosome band 1p32[J]. Mol Cells,2000,10(5):598-600.
[17]Park MY,Ryu SW,Kim KD,et al. Fas-associated factor-1 mediates chemotherapeutic-induced apoptosis via death effector filament formation[J]. Int J Cancer,2005,115(3):412-418.
[18]Park MY,Moon JH,Lee KS,et al. FAF1 suppresses IκB kinase (IKK) activation by disrupting the IKK complex assembly[J]. J Biol Chem,2007,282(38):27572-27575.
[19]Altomare DA,Menges CW,Pei J,et al. Activated TNF-α/NF-κB signaling via down-regulation of Fas-associated factor 1 in asbestos-induced mesotheliomas fromArfknockout mice[J]. Proc Natl Acad Sci USA,2009,106(9):3420-3425.
[20]Kang W,Yang JK. Crystal structure of human FAF1 UBX domain reveals a novel FcisP touch-turn motif in p97/VCP-binding region[J]. Biochem Biophys Res Commun,2011,407(3):531-534.
[21]Kim SK,Kang C,Shin CY,et al. TRPV1 recapitulates native capsaicin receptor in sensory neurons in association with Fas-associated factor 1[J]. J Neurosci,2006,26(9):2403-2412.
[22]Kikyo N,Tada T,Tada M,et al. Mapping of the Fas-associated factor 1 gene,fafl,to mouse chromosome 4C6 by FISH[J]. Mamm Genome,1997,8(3):224-225.
[23]De Zio D,Ferraro E,D’Amelio M,et al. Faf1 is expressed during neurodevelopment and is involved in Apaf1-dependent caspase-3 activation in proneural cells[J]. Cell Mol Life Sci,2008,65(11):1780-1790.
[24]Cheng K,Bai L,Belluscio L. Fas-associated factor 1 as a regulator of olfactory axon guidance[J]. J Neurosci,2011,31(33):11905-11913.
[25]Kamath RS,Fraser AG,Dong Y,et al. Systematic functional analysis of theCaenorhabditiselegansgenome using RNAi[J]. Nature,2003,421(6920):231-237.
[26]Fernandez AG,Gunsalus KC,Huang J,et al. New genes with roles in theC.elegansembryo revealed using RNAi of ovary-enriched ORFeome clones[J]. Genome Res,2005,15(2):250-259.
[27]Kim M,Lee JH,Lee SY,et al. Caspar,a suppressor of antibacterial immunity inDrosophila[J]. Proc Natl Acad Sci USA,2006,103(4):16358-16363.
[28]Chu K,Niu X,Williams LT. A Fas-associated protein factor,FAF1,potentiates Fas-mediated apoptosis[J]. Proc Natl Acad Sci USA,1995,92(25):11894-11898.
[29]Ryu SW,Lee SJ,Park MY,et al. Fas-associated factor 1,FAF1,is a member of Fas death-inducing signaling complex[J]. J Biol Chem,2003,278(26):24003-24010.
[30]Imai Y,Kimura T,Murakami A,et al. The CED-4-homologous protein FLASH is involved in Fas-mediated activation of caspase-8 during apoptosis[J]. Nature,1999,398(6730):777-785.
[31]Scaffidi C,Schmitz I,Zha J,et al. Differential modulation of apoptosis sensitivity in CD95 type I and type II cells[J]. J Biol Chem,1999,274(32):22532-22538.
[32]Park MY,Jang HD,Lee SY,et al. Fas-associated factor-1 inhibits nuclear factor-κB(NF-κB)activity by interfering with nuclear translocation of the RelA (p65) subunit of NF-κB[J]. J Biol Chem,2004,279(4):2544-2549.
[33]Chaudhary PM,Jasmin A,Eby MT,et al. Modulation of the NF-κ B pathway by virally encoded death effector domains-containing proteins[J]. Oncogene,1999,18(42):5738-5746.
[34]Moir D,Stewart SE,Osmond BC,et al. Cold-sensitive cell-division-cycle mutants of yeast:isolation,properties, and pseudoreversion studies[J]. Genetics,1982,100(4):547-563.
[35]Leon A,McKearin D. Identification of TER94,an AAA ATPase protein,as a Bam-dependent component of theDrosophilafusome[J]. Mol Biol Cell,1999,10(11):3825-3834.
[36]Müller JM,Deinhardt K,Rosewell I,et al. Targeted deletion of p97(VCP/CDC48)in mouse results in early embryonic lethality[J]. Biochem Biophys Res Commun,2007,354(2):459-465.
[37]Schuberth C,Richly H,Rumpf S,et al. Shp1 and Ubx2 are adaptors of Cdc48 involved in ubiquitin-dependent protein degradation[J]. EMBO Rep,2004,5(8):818-824.
[38]Neuber O,Jaroschm E,Volkwein C,et al. Ubx2 links the Cdc48 complex to ER-associated protein degradation[J]. Nat Cell Biol,2005,7(10):993-998.
[39]Hicks AA,Pétursson H,Jónsson T,et al. A susceptibility gene for late-onset idiopathic Parkinson’s disease[J]. Ann Neurol,2002,52(5):549 -555.
ProgressesandinsightsofFas-associatedfactor1
DONG Shao-nan1, XIE Qi-xuan1, AKIYAMA Taishin3, TAKAHASHI Yuji4, QIN Jun-wen1,2
(1InstituteofReproductiveImmunology,CollegeofLifeScienceandTechnology,2KeyLaboratoryforRegenerativeMedicine,MinistryofEducation,JinanUniversity,Guangzhou510632,China;3DivisionofCellularandMolecularBiology,InstituteofMedicalScience,UniversityofTokyo,Minato-ku,Tokyo108-8639,Japan;4DepartmentofReproductiveBiology,NationalCenterforChildHealthandDevelopment,Setagaya-ku,Tokyo157-8535,Japan.
Fas-associated factor 1 (FAF1) is an evolutionarily conserved intracellular protein, which contains a couple of functional domains and interacts with several proteins including Fas, Fas-associated protein with death domain (FADD), caspase-8, IκB kinase β (IKKβ), p65 as well as casein kinase 2 (CK2). FAF1 involves in the regulation of different signaling pathways, such as Fas, nuclear transcription factor κB (NF-κB) and Wnt signaling pathway. FAF1 is widely expressed in the tissues and contributes to multiple physiological functions. In addition, FAF1 is also related to several pathological processes and may be a tumor inhibitor.
Fas相关因子1; 表达与功能; 信号通路; 肿瘤
Fas-associated factor 1; Expression and function; Signal pathway; Neoplasms
E-mail:tjunwen@jnu.edu.cn;txqx@jnu.edu.cn)
R363;Q74
A
10.3969/j.issn.1000-4718.2012.03.034

