槲皮素对毒胡萝卜素诱导的巨噬细胞内质网应激凋亡途径的抑制作用及机制
岳 雯, 姚树桐, 鲍 颖, 王家富, 杨娜娜, 商战平△
(泰山医学院1病理生理学教研室,2泰安市中心医院心血管内科,3动脉粥样硬化研究所,山东 泰安 271000)
1000-4718(2012)03-0518-06
2011-08-02
2012-01-05
△通讯作者 Tel:0538-6225010; E-mail: zhpshang@tsmc.edu.cn
槲皮素对毒胡萝卜素诱导的巨噬细胞内质网应激凋亡途径的抑制作用及机制
岳 雯1, 姚树桐1, 鲍 颖2, 王家富1, 杨娜娜3, 商战平1△
(泰山医学院1病理生理学教研室,2泰安市中心医院心血管内科,3动脉粥样硬化研究所,山东 泰安 271000)
目的研究槲皮素(quercetin, Que)对毒胡萝卜素(thapsigargin, TG)诱导的巨噬细胞RAW264.7内质网应激凋亡途径的抑制作用及机制。方法1 μmol/L TG作用RAW264.7细胞24 h诱导内质网应激,不同浓度Que(80、120或160 μmol/L)与TG共同作用后,MTT法检测细胞存活率,流式细胞术检测凋亡率及[Ca2+]i,激光共聚焦显微镜观察细胞形态变化,Western blotting法检测糖调节蛋白78 (glucose-regulated protein 78,GRP78)及C/EBP同源蛋白(C/EBP homologous protein, CHOP)的表达;Western blotting法检测Que(160 μmol/L)和(或)磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)抑制剂LY294002(15 nmol/L)与TG共同作用时GRP78和CHOP的表达。结果Que能够抑制TG诱导的RAW264.7细胞内质网应激损伤,与TG组相比,细胞存活率升高(P<0.05),凋亡率降低(P<0.05),[Ca2+]i降低(P<0.05),GRP78及CHOP表达减少(P<0.05);LY294002单独作用可抑制TG诱导的GRP78及CHOP表达上调(P<0.05),但与Que联合应用与二者单独使用时抑制作用无显著差异。结论Que可以抑制TG诱导的RAW264.7细胞内质网应激凋亡途径,该作用可能与其抑制PI3K信号通路从而降低CHOP蛋白的表达有关。
槲皮素; 内质网应激; 巨噬细胞; 细胞凋亡; 磷脂酰肌醇3-激酶
动脉粥样硬化(atherosclerosis, AS)斑块破裂后导致血栓形成,引发急性冠脉综合征,是当今人类健康的头号杀手。巨噬细胞凋亡与斑块的破裂密切相关,而持久剧烈的内质网应激(endoplasmic reticulum stress, ERS)是诱导巨噬细胞凋亡的重要途径之一[1]。槲皮素(quercetin, Que)是分布最广的黄酮类化合物之一,具有抗氧化、抗突变、抗血管形成、抑制蛋白激酶C(protein kinase C, PKC)、抑制脂氧合酶、抑制组胺释放和调节细胞周期等多种生物学作用[2]。但Que对巨噬细胞ERS的调控作用至今未能完全阐明。本文将以毒胡萝卜素(thapsigargin, TG)作用巨噬细胞RAW264.7诱导ERS模型,通过对凋亡、[Ca2+]i及相关蛋白水平的检测,探讨Que对巨噬细胞ERS凋亡途径的调节作用及可能机制。
材 料 和 方 法
1主要材料及仪器
槲皮素、毒胡萝卜素、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide, MTT]和磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)抑制剂(LY294002)购自Sigma;膜联蛋白V/碘化丙啶(Annexin V/PI)双染色试剂盒购自南京凯基生物有限公司;Fura-3/AM Ca2+浓度检测试剂盒购自Biotium;乙二醇-双-(2-氨基乙醚)四乙酸(glycol-bis-(2-aminoethylether)-N,N,N’,N’-tetraacetic acid, EGTA)购自索莱宝公司;兔抗鼠糖调节蛋白78(glucose-regulated protein 78, GRP78)、C/EBP同源蛋白(C/EBP homologous protein, CHOP)和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)Ⅰ抗购自Santa Cruz,其它试剂均为进口或国产分析纯。流式细胞仪(FACS Calibur, Bio-Rad);酶标仪(Tecan infinite F200, Tecan);电泳仪(Bio-Rad PAC3000, Bio-Rad);激光共聚焦显微镜(Radiance2100, Bio-Rad)。
2主要方法
2.1细胞培养 鼠源巨噬细胞RAW264.7细胞由本实验室保存。细胞用含有10%胎牛血清的高糖DMEM培养液,在37 ℃、5%CO2培养箱中静置培养。待细胞生长良好,调整密度为5×109/L接种于培养板,细胞处理前换入无血清的DMEM培养液培养24 h。
2.2MTT法检测细胞存活率 细胞培养于96孔培养板,每组5个复孔。细胞经处理后,每孔加MTT 20 μL,4 h后终止培养,弃去培养液,每孔加DMSO 200 μL,充分混匀,置于37 ℃温箱培养15 min,使结晶物充分溶解。酶标仪490 nm波长处测吸光度(A)值。细胞存活率%=(干预组A/对照组A)×100%。实验重复3次。
2.3流式细胞仪检测细胞凋亡率 采用Annexin V-FITC/PI双标记染色法检测细胞凋亡率。细胞经处理后弃去旧培养液,常规消化后制成单细胞悬液,4 ℃离心5 min,去上清后细胞沉淀用冷PBS洗2次,加500 μL结合缓冲液悬浮细胞,然后加入Annexin V-FITC和PI各5 μL,轻轻混匀,室温避光孵育10 min,1 h内上机检测。实验重复3次。
2.4激光共聚焦显微镜观察细胞形态 将细胞培养于放有无菌盖玻片的6孔培养板中。细胞经处理后,用PBS润洗3次,取500 μL结合缓冲液并加入Annexin V-FITC和PI各5 μL,混匀后滴加于玻片上,室温避光孵育10 min,封片后上机检测。实验重复3次。
2.5流式细胞仪检测[Ca2+]i处理后收集细胞,PBS洗3次,取细胞悬液加入2 μmol/L Fluo-3/AM,置培养箱中孵育30 min,其间轻微振荡3次,无钙缓冲液终止反应并调整细胞数目1×109/L,30 min内上机检测。参数设置为激发光波长488 nm,发射波长526 nm,按公式计算[Ca2+]i=Kd[(F-Fmin)/(Fmax-F)],Kd为Fluo-3的解离常数(400 nmol/L),F为荧光强度,Fmin是加入EGTA(终浓度5 mmol/L)后的最小值,Fmax是加入10% Triton X-100后的最大值。实验重复3次。
2.6Western blotting测定蛋白表达 收集细胞,加入裂解液冰浴30 min,15 000×g离心20 min,取上清BCA法蛋白定量,煮沸变性后取40 μg蛋白行SDS-PAGE并电转印至PVDF膜,膜封闭后,与兔抗鼠GRP78、CHOP或GAPDH的多克隆抗体孵育4℃过夜,漂洗后与相应辣根过氧化物酶耦联的Ⅱ抗孵育2 h, 抗原-抗体复合物用增强化学发光法(ECL)显影,暗室X光胶片曝光,Image-Pro Plus软件(Version 6.0, Media Cybernetics)分析蛋白条带累积吸光度(integrated absorbance,IA)值,以靶蛋白IA值/GAPDHIA值反映靶蛋白相对水平。实验重复3次。
3统计学处理
结 果
1Que对TG作用RAW264.7细胞存活率的影响
结果显示,TG组细胞存活率较对照组明显降低(P<0.05);而Que与TG共同作用后,细胞存活率较TG组升高(P<0.05),且呈剂量依赖性;Que(160 μmol/L)单独作用细胞存活率较对照组无明显改变(P>0.05),结果提示Que可抑制TG对RAW264.7细胞活性的损伤,见表1。
表1MTT法检测RAW264.7细胞存活率

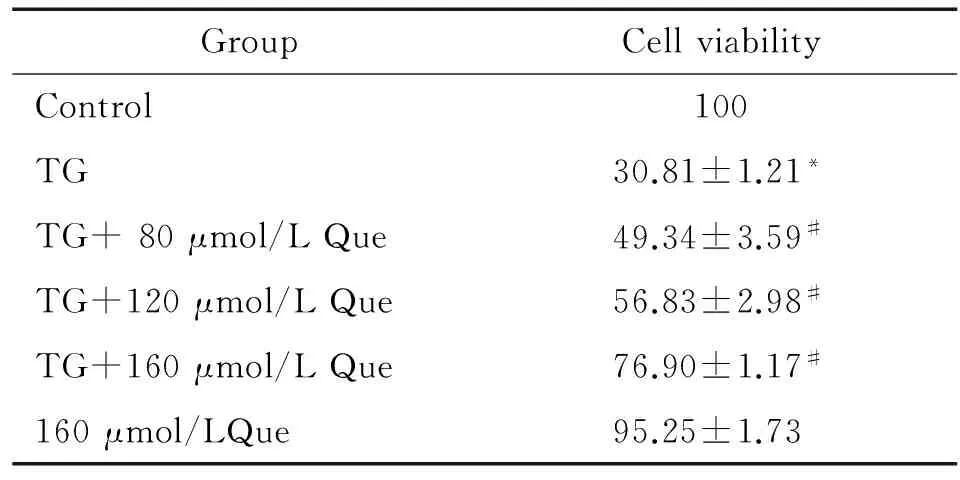
GroupCellviabilityControl100TG30.81±1.21*TG+80μmol/LQue49.34±3.59#TG+120μmol/LQue56.83±2.98#TG+160μmol/LQue76.90±1.17#160μmol/LQue95.25±1.73
*P<0.05vscontrol;#P<0.05vsTG group.
2Que对TG作用RAW264.7细胞凋亡的影响
Annexin V-FITC/PI对细胞行双标记染色,正常细胞分布于流式图的左下区,早期凋亡细胞分布于右下区,晚期凋亡或死亡细胞分布于右上区,早晚期凋亡细胞百分数总和称为总凋亡率。结果显示,对照组总凋亡率为(3.48±0.45)%;TG组总凋亡率为(70.91±2.02)%,较对照组明显增加(P<0.05);Que(80、120和160 μmol/L)与TG共同作用后,总凋亡率分别为(45.11±1.93)%、(36.02±1.42)%和(25.92±1.72)%,均较TG组减少(P<0.05),且呈剂量依赖性;Que(160 μmol/L)单独作用后细胞凋亡率为(8.11±0.77)%,较对照组升高(P<0.05),但与TG共同作用时存在交互作用。
激光共聚焦显微镜下观察可见,对照组和Que单独作用组仅可见少数单染成绿色胞膜的细胞,未见红染的胞核;TG组可见较多双染细胞,即红色胞核外围鲜绿色胞膜,还可见仅着红色的凋亡小体;而Que与TG共同作用后,红染胞核基本消失,单染成绿色胞膜的细胞也随Que浓度增加而逐渐减少。结果提示Que可抑制TG诱导的RAW264.7细胞凋亡,见图1。
3Que对TG作用RAW264.7细胞[Ca2+]i的影响
结果显示,TG作用后[Ca2+]i较对照组明显升高(P<0.05),加入Que(80、120和160 μmol/L)与TG共同作用后可使[Ca2+]i明显降低(P<0.05),呈剂量依赖性;虽Que(160 μmol/L)单独作用也可使[Ca2+]i较对照组升高(P<0.05),但与TG共孵育时存在交互作用,见表2。
4Que对TG作用RAW264.7细胞GRP78和CHOP蛋白表达的影响
结果显示,TG组细胞GRP78及CHOP蛋白表达明显增加,其相对蛋白含量分别为对照组的9.36和21.6倍(P<0.05);而Que(80、120和160 μmol/L)与TG共同作用使两种蛋白表达均较TG组降低(P<0.05),GRP78蛋白相对含量较TG组降低20%、61%和78%,CHOP蛋白相对含量较TG组降低56%、81%和79%,见图2A。
160 μmol/L Que单独作用RAW264.7细胞,不同时间点检测蛋白表达变化,结果发现,GRP78和CHOP的蛋白水平均较对照组升高(P<0.05),作用24 h时蛋白水平分别是对照组的3.55倍和1.75倍,但时间依赖性不明显,见图2B。
5Que通过PI3K通路抑制TG诱导的RAW264.7细胞ERS
结果显示,LY294002(15 nmol/L)或Que(160 μmol/L)单独作用,或是二者共同作用RAW264.7细胞时,都可以抑制TG诱导的GRP78和CHOP的表达上调(P<0.05),GRP78较TG组分别降低74%、76%和77%,CHOP较TG组分别降低74%、76%和76%,而三者对两种蛋白的抑制作用之间无统计学意义(P>0.05),见图2C。
讨 论
内质网是蛋白质合成、修饰加工、分选转运的主要场所,同时也参与调节细胞内Ca2+浓度变化。很多病理生理因素,如热性惊厥、糖基化的抑制、Ca2+稳态失衡、二硫键结合减少、病毒感染等,都能干扰蛋白质折叠,使未折叠或错误折叠的蛋白质在内质网腔内蓄积,引起ERS。随后细胞引发一系列试图恢复内质网稳态的反应,如降低翻译水平来阻止蛋白质的进一步聚集,诱导分子伴侣GRP78、葡萄糖调节蛋白质94(glucose-regulated protein 94,GRP94)等的表达以纠正蛋白质的折叠及促进泛素-蛋白酶体降解系统,加速未折叠或错误折叠蛋白质的降解。这一系列反应称之为未折叠蛋白反应(unfolded protein response, UPR),相关转录因子有:RNA依赖的蛋白激酶样内质网激酶(PKR-like ER kinase, PERK)、肌醇激酶l(inositol-requiring kinase 1, IRE1)和活化转录因子6(activating transcription factor 6, ATF6)[3]。当应激持续过强或过久时,UPR可激活转录因子CHOP、caspase-12和c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)等,诱导细
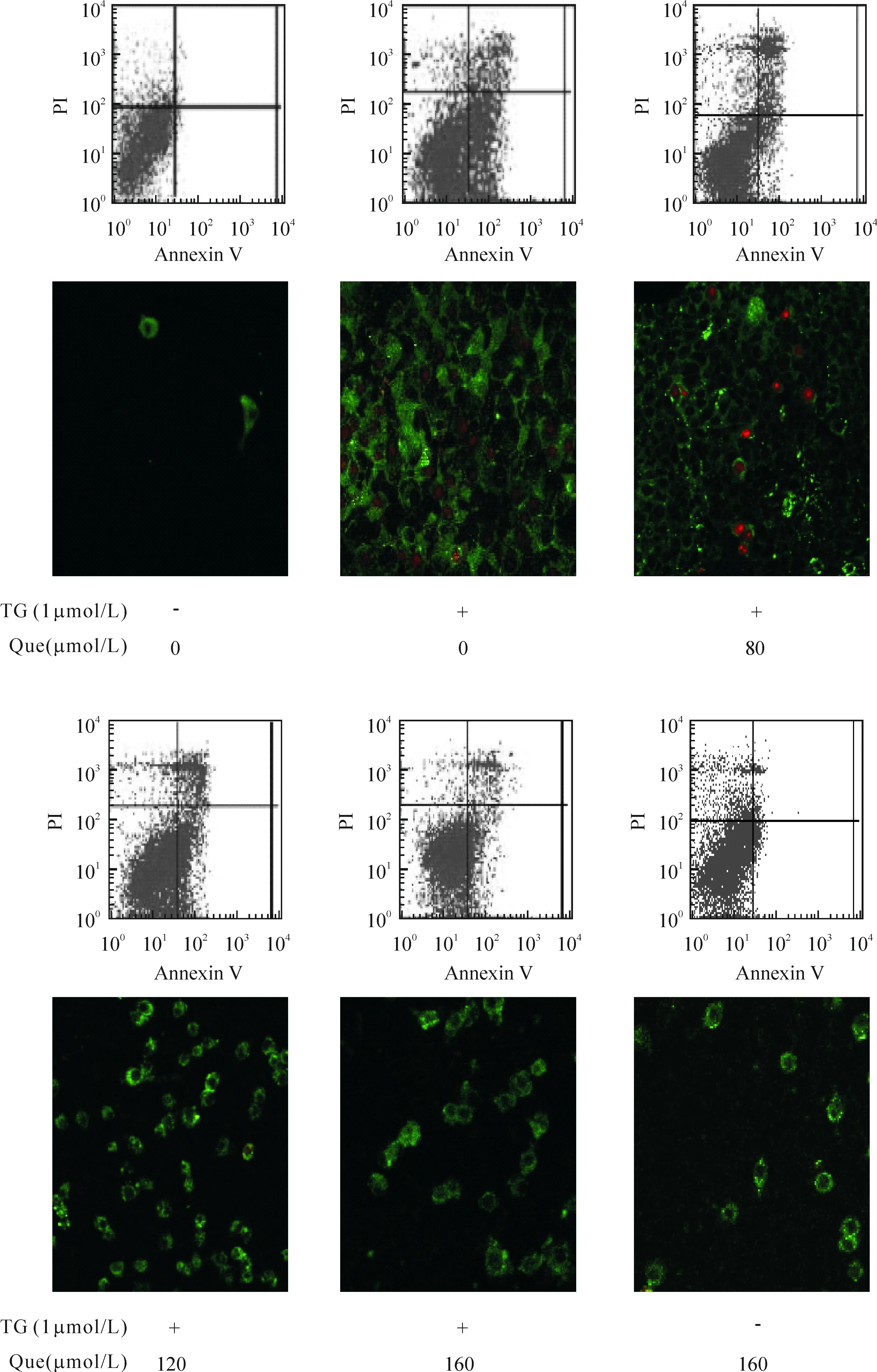
Figure 1. Effect of Que on apoptosis of RAW264.7 cells induced by TG. RAW264.7 cells were treated with various concentrations of Que and 1 μmol/L of TG for 24 h. The apoptotic rate was determinied by flow cytometry. The morphological changes of the cells was observed by laser scanning confocal microscopy (×200).
图1Que对TG诱导RAW264.7细胞凋亡的影响
表2Que对TG诱导的RAW264.7细胞[Ca2+]i浓度的影响

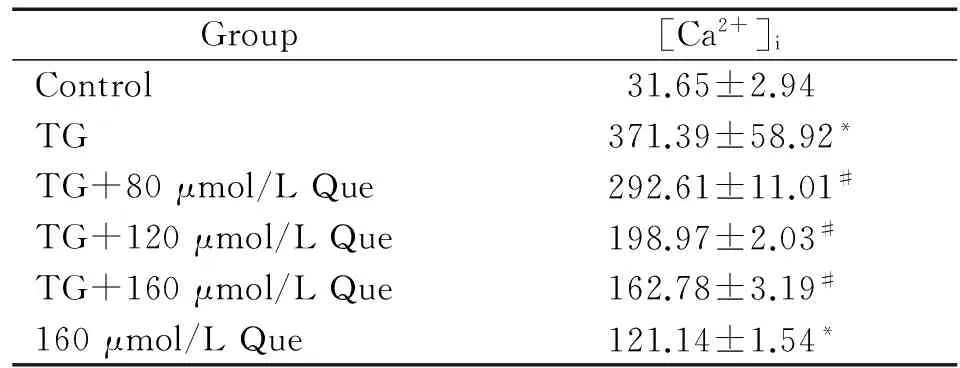
Group[Ca2+]iControl31.65±2.94TG371.39±58.92*TG+80μmol/LQue292.61±11.01#TG+120μmol/LQue198.97±2.03#TG+160μmol/LQue162.78±3.19#160μmol/LQue121.14±1.54*
*P<0.05vscontrol;#P<0.05vsTG.
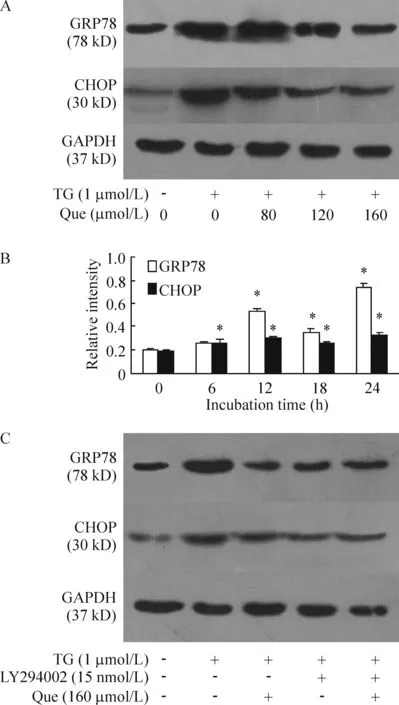

图2Que对TG诱导的RAW264.7细胞中GRP78和CHOP蛋白表达的影响
胞凋亡,导致不可逆的损伤[3]。研究发现,ERS伴随AS发生、发展的全过程,可诱导斑块中的巨噬细胞凋亡,是除死亡受体和线粒体途径外,触发巨噬细胞凋亡的另一重要机制[4]。
GRP78是ERS的标志蛋白之一。在未应激的细胞中,GRP78与IRE1、PERK、ATF6的胞内部分结合,使其失活;当ERS时其表达上调,激活感受器蛋白的同时,增加内质网对未折叠蛋白的处理能力[4]。CHOP是参与ERS凋亡途径的重要信号分子,可通过多种途径诱导细胞凋亡[5]。研究发现,在巨噬细胞中CHOP可通过活化内质网氧化酶1(ER oxidase 1, ERO1),激活1,4,5-三磷酸肌醇受体(inositol 1,4,5-trisphosphate receptor, IP3R)相关的内质网Ca2+释放,从而活化死亡受体FAS、线粒体等众多凋亡信号通路[6]。
TG可通过抑制肌浆/内质网Ca2+-ATP酶(sarco/endoplasmic reticulum Ca2+-ATPase, SERCA),使Ca2+稳态失衡诱导ERS。本实验结果显示,鼠源巨噬细胞RAW264.7经1 μmol/L TG处理24 h后,细胞存活率降低,凋亡率增加,可见凋亡形态变化及典型的凋亡小体,[Ca2+]i及GRP78、CHOP蛋白表达与对照组相比也有明显增加。结果表明,TG诱导RAW264.7细胞ERS模型制备成功。
Que及其衍生物是植物界分布最广的黄酮类化合物,也是人类饮食中最主要的生物类黄酮,其药理活性主要有抗氧化、抗炎、降血压、抗血小板聚集、 抗癌变、抗AS等作用[7-9]。本实验发现,Que可以减轻TG诱导的RAW264.7细胞ERS相关损伤,表现为细胞存活率上升,凋亡率下降,凋亡形态变化减轻,晚期凋亡及坏死细胞明显减少,凋亡小体缺失,[Ca2+]i降低,凋亡标志蛋白GRP78及CHOP表达减少,且该效应呈剂量依赖趋势。
Que单独作用也可上调GRP78及CHOP的表达,以上调GRP78表达更为显著,我们猜测,Que或许是通过上调GRP78表达,增强细胞对应激的防御能力。而且我们人体对黄酮类的日摄取量仅仅是20~35 mg/d[10],实验用的Que浓度已远远大于体内实际存在量。Takano等[11]研究发现,与Que具有相似生物学作用的甲基黄酮类代表-红橘素在抑制衣霉素诱导的ERS时,会上调GRP78和血红素氧合酶1(heme oxygenase 1, HO-1)的表达;而红橘素抑制小鼠胰岛素瘤细胞MIN6 ERS的同时,也可上调GRP78表达并诱导翻译起始因子2α(eukaryotic translation initiation factor 2α, eIF2α)的磷酸化。据此我们推测,Que表现出的是对ERS的抑制作用,而不是加剧ERS的毒性作用。
已知Que与PI3K抑制剂LY294002具有相似的结构,能抑制PI3K-Akt /PKB信号通路[12]。我们发现,LY294002或Que单独作用都可以抑制TG诱导的GRP78和CHOP的表达升高,而联合应用时对蛋白的抑制作用与二者单独作用时没有统计学差异,此结果提示二者抑制TG诱导的GRP78和CHOP蛋白表达升高的机制是相同的,即Que或许是通过抑制PI3K通路来调节RAW264.7细胞ERS的。
有报道称,PI3K能通过抑制糖原合酶激酶 3β(glycogen synthase kinase 3β, GSK-3β)影响糖代谢,诱发葡糖胺诱导的ERS[13]。TG抑制SERCA后可使内质网腔Ca2+耗竭和[Ca2+]i升高,而后者导致PI3K活化[14]。PI3K活化能进一步激活磷脂酶Cγ(phospholipase C gamma, PLCγ),产生IP3,通过与IP3R结合诱导内质网释放Ca2+[15],加重ERS。而且PI3K还能通过活化JNK、促进CHOP表达和失活 Bcl-2等诱导细胞凋亡[16]。因此,抑制PI3K信号通路或许能直接导致ERS的缓和。
综上所述,Que可以抑制TG诱导的巨噬细胞RAW264.7内质网应激凋亡途径,其机制可能与抑制PI3K信号通路和抑制CHOP蛋白的表达有关。
[1] Hertog MG, Hollman PC. Potential health effects of the dietary flavonol quercetin[J]. Eur J Clin Nutr, 1996, 50(2):63-71.
[2] Walker EH, Pacold ME, Perisic O, et al. Structural determinants of phosphoinositide 3-kinase inhibition by wortmannin, LY294002, quercetin, myricetin, and staurosporine[J]. Mol Cell, 2000, 6(4): 909-919.
[3] Rasheva VI, Domingos PM. Cellular responses to endoplasmic reticulum stress and apoptosis[J]. Apoptosis, 2009, 14(8):996-1007.
[4] Lai E, Teodoro T, Volchuk A. Endoplasmic reticulum stress:signaling the unfolded protein response[J]. Physiology (Bethesda), 2007,22:193-201.
[5] Rao RV, Peel A, Logvinova A, et al. Coupling endoplasmic reticulum stress to the cell death program:role of the ER chaperone GRP78[J]. FEBS Lett, 2002, 514(2-3):122-128.
[6] Yao PM, Tabas I. Free cholesterol loading of macrophages is associated with widespread mitochondrial dysfunction and activation of the mitochondrial apoptosis pathway[J]. Biol Chem, 2001, 276(45):42468-42476.
[7] 朱宇同,王艳芳, 王新华. 槲皮素药理学作用研究进展[J]. 天然产物研究与开发, 2003, 15(2):171-173.
[8] 毕 伟,朱丽红,王传明,等.槲皮素抑制鱼藤酮诱导的PC12细胞凋亡[J].中国病理生理杂志,2011,27(1):82-85.
[9] 周 晓,商战平,司艳红,等.槲皮素抑制内皮素-1诱导的人脐动脉平滑肌细胞T型钙通道的表达[J].中国病理生理杂志,2011,27(3):450-454.
[10]Manach C, Williamson G, Morand C, et al. Bioavailability and bioefficacy of polyphenols in humans. I. Review of 97 bioavailability studies[J]. Am J Clin Nutr, 2005, 81(1 Suppl):230S-242S.
[11]Takano K, Tabata Y, Kitao Y, et al. Methoxyflavones protect cells against endoplasmic reticulum stress and neurotoxin[J]. Am J Physiol Cell Physiol, 2007, 292(1): C353-C361.
[12] Gulati N, Laudet B, Zohrabian VM, et al. The antiproliferative effect of quercetin in cancer cells is mediated via inhibition of the PI3K-Akt/PKB pathway[J]. Anticancer Res, 2006, 26(2A):1177-1181.
[13]Sharma M, Chuang WW, Sun Z. Phosphatidylinositol 3-kinase/Akt stimulates androgen pathway through GSK3β inhibition and nuclear β-catenin accumulation[J]. J Biol Chem, 2002, 277(34): 30935-30941.
[14]Takuwa Y. Identification of PI3K-C2α as the mediator of Ca2+-induced Rho activation and MLC phosphatase inhibition[J]. Nippon Yakurigaku Zasshi, 2007, 129(4): 253-257.
[15]Fischer L, Gukovskaya AS, Penninger JM, et al. Phosphatidylinositol 3-kinase facilitates bile acid-induced Ca2+responses in pancreatic acinar cells[J]. Am J Physiol Gastrointest Liver Physiol, 2007, 292(3): G875-G886.
[16]Liang SH, Zhang W, McGrath BC, et al. PERK (eIF2α kinase) is required to activate the stress-activated MAPKs and induce the expression of immediate-early genes upon disruption of ER calcium homoeostasis[J]. Biochem J, 2006, 393(Pt 1): 201-209.
ProtectiveeffectofquercetinonERstress-relatedapoptosisinducedbythapsigargininmacrophages
YUE Wen1, YAO Shu-tong1, BAO Ying2,WANG Jia-fu1, YANG Na-na3, SHANG Zhan-ping1
(1DepartmentofPathophysiology,2DepartmentofCardiovascularMedicine,theCentralHospitalofTaian,3InstituteofAtherosclerosis,TaishanMedicalCollege,Taian271000,China.E-mail:zhpshang@tsmc.edu.cn)
AIM: To investigate the effects and possible mechanisms of quercetin (Que) on endoplasmic reti-culum stress (ERS)-related apoptosis induced by thapsigargin (TG) in RAW264.7 cells.METHODSER stress of RAW264.7 cells were induced by TG at concentration of 1 μmol/L for 24 h. After treated with different concentrations of Que (80, 120 and 160 μmol/L), the cell viability was determined by MTT assay.The apoptotic rate and the changes of intracellular Ca2+concentration ([Ca2+]i) were determined by flow cytometry, and the cell apoptotic morphology was observed under laser scanning confocal microscope.The protein levels of glucose-regulated protein 78 (GRP78) and C/EBP homologous protein (CHOP) were detected by Western blotting. The effect of Que on GRP78 and CHOP induced by TG with phosphatidylinositol 3-kinase (PI3K) inihibitor LY294002 at concentration of 15 nmol/L was measured by Western blotting.RESULTSQue suppressed ER stress-related injury induced by TG in RAW264.7 cells. Compared with TG group, the cell viability increased (P<0.05), apoptotic rate and [Ca2+]idecreased (P<0.05) and the changes of apoptotic morphology were alleviated. The increase in GRP78 and CHOP induced by TG as an ER stress marker was suppressed by Que (P<0.05). The suppressive effect of Que on GRP78 and CHOP was reproduced by LY294002 (P<0.05), but they failed to exhibit additive suppression.CONCLUSIONQue suppresses the ER stress induced by TG in RAW264.7 cells. The protective effect may be related to its suppression on PI3K signaling pathway.
Quercetin; Endoplasmic reticulum stress; Macrophages; Apoptosis; Phosphatidylinositol 3-kinase
R332
A
10.3969/j.issn.1000-4718.2012.03.023
——疾病防治的新靶标

