肠源性内毒素血症在大鼠代谢综合征相关疾病发生发展中的作用及其机制*
周 鑫, 韩德五△, 许瑞龄, 李素红, 吴惠文, 赵元昌
(1山西医科大学肝病研究所,山西 太原030001;2山西省肿瘤医院病理科,山西 太原030013;3山西医科大学汾阳学院,山西 汾阳 032200)
1000-4718(2012)03-0492-07
2011-10-17
2011-11-22
山西省自然科学基金资助项目(No.2008011073-1)
△通讯作者 Tel:0351-4135073;E-mail:xinxin6633@yeah.net
肠源性内毒素血症在大鼠代谢综合征相关疾病发生发展中的作用及其机制*
周 鑫1, 韩德五1△, 许瑞龄1, 李素红2, 吴惠文3, 赵元昌1
(1山西医科大学肝病研究所,山西 太原030001;2山西省肿瘤医院病理科,山西 太原030013;3山西医科大学汾阳学院,山西 汾阳 032200)
目的探讨肠源性内毒素血症(IETM)在代谢综合征(MS)相关疾病发生发展中的作用及可能的分子机制。方法将64只大鼠随机分为8组,分别是3月正常对照组(3C)、3月高糖高脂组(3H)、6月正常对照组(6C)、6月高糖高脂组(6H)、9月正常对照组(9C)、9月高糖高脂组(9H)、12月正常对照组(12C)和12月高糖高脂组(12H)。测定血浆脂多糖(LPS)、游离脂肪酸(FFA)、肿瘤坏死因子α(TNF-α)、C反应蛋白(CRP)、巨噬细胞趋化蛋白-1(MCP-1)、空腹血糖(FPG)和空腹胰岛素(FINS),并计算胰岛素抵抗指数(HOMA-IR)。免疫组化方法观察脂肪组织、肝组织和胰腺组织CD68表达水平;Western blotting测定肝组织、胰腺组织中JNK1、p-JNK1、NF-κB p65、IκB、GRP78蛋白表达水平。结果与正常对照组相比,各阶段高糖高脂组的大鼠血清LPS、TNF-α、CRP、MCP-1、FPG、FINS和HOMA-IR的水平都升高,其差异有统计学意义;免疫组化结果显示各阶段高糖高脂组大鼠的脂肪组织、肝组织和胰腺组织CD68表达水平明显升高,且随时间推移加重;各阶段高糖高脂组的大鼠肝组织p-JNK1、NF-κB p65表达显著高于正常组,而IκB表达显著低于正常组;高糖高脂组的大鼠胰腺组织p-JNK1和NF-κB p65的表达于第6个月开始升高,第9个月、第12个月达到高峰,而IκB的表达也于第6个月开始降低。结论IETM可能在MS相关的代谢性疾病中发挥着重要的作用,NF-κB、JNK和GRP78信号可能参与了上述过程。
肠源性内毒素血症; 代谢综合征; 非酒精性脂肪性肝病; 糖尿病,2型; 胰岛素抵抗
在前期实验中我们发现,大鼠经过高糖高脂饮食喂养1年,先后出现了非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)和Ⅱ型糖尿病(type 2 diabetes mellitus,T2DM)等代谢综合征(metabolic syndrome,MS)相关的代谢性疾病,并且结合实验数据判断认为是NAFLD诱发了T2DM[1],这可能是因为在脂肪肝和非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)阶段已出现肠源性内毒素血症(intestinal endotoxemia,IETM)和由此产生的胰岛素抵抗与炎症反应,为T2DM发生作了铺垫。近年来国外也有多篇文献报道LPS在NASH发病机制中具有重要作用[2-4],因此我们设想LPS在NAFLD、T2DM等MS相关代谢性疾病的发生发展中可能发挥着至关重要的作用。为此,我们设计了以下实验进一步探讨LPS在MS相关疾病发生发展中可能的作用及其分子机制。
材 料 和 方 法
1材料
1.1动物 Sprague-Dawley大鼠64只,雌雄各半,由山西医科大学实验动物中心提供。
1.2主要试剂及仪器 脂多糖(lipopolysaccharide,LPS)显色基质鲎试剂盒、肿瘤坏死因子α(tumour necrosis factor alpha,TNF-α)放免试剂盒、C反应蛋白(C-reactive protein,CRP)ELISA试剂盒、巨噬细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)ELISA试剂盒、胰岛素(fasting insulin,FINS)放免试剂盒、血糖(fasting blood glucose,FPG)试剂盒、兔抗CD68多克隆抗体及SABC免疫组化试剂盒购自北京中衫生物科技有限公司;c-Jun氨基末端激酶(c-Jun amino-terminal kinase,JNK)、磷酸化c-Jun氨基末端激酶(phosphorylated c-Jun amino-terminal kinase,p-JNK)、核因子κB(nuclear factor κB,NF-κB)、核因子κB抑制蛋白(inhibitory subunit of nuclear factor κB,IκB)和葡萄糖调节蛋白(glucose-regulated protein 78,GRP78)抗体均购自Cell Signaling Technology;721分光光度计购自上海第三分析仪器厂;SN-684型放免γ计数器购自上海核所日环光电仪器有限公司。
2方法
2.1动物分组及模型的建立 64只大鼠适应性饲养1周后,随机分为8组(n=8):3月正常对照组(normal control group of 3 months,3C)、6月正常对照组(normal control group of 6 months,6C)、9月正常对照组(normal control group of 9 months,9C)和12月正常对照组(normal control group of 12 months,12C)以正常饮食喂养;3月高糖高脂组(high-sucrose and high-fat diet group of 3 months,3H)、6月高糖高脂组(high-sucrose and high-fat diet group of 6 months,6H)、9月高糖高脂组(high-sucrose and high-fat diet group of 9 months,9H)和12月高糖高脂组(high-sucrose and high-fat diet group of 12 months,12H)采用高糖高脂膳食(70%正常饲料+20%猪油+10%蔗糖+1%胆固醇+0.25%胆酸)喂养。正常组总热量13.89 kJ/g,模型组总热量68.40 kJ/g。上述各组动物均在天黑前投食,自由饮水,每月称体重1次。分别于实验第3月末、第6月末、第9月末、第12月末处死相应阶段的正常组及高糖高脂组大鼠,采腹主动脉血,3 500 r/min离心备用。
2.2生化指标检测 测定血浆LPS、TNF-α、CRP、MCP-1、FPG、FINS,计算胰岛素抵抗指数(homeostasis model assessment-insulin resistance,HOMA-IR):HOMA-IR=(FPG×FINS)/22.5。
3免疫组化方法检测
检测内脏脂肪组织、肝组织和胰腺组织中CD68(巨噬细胞分子标记)的表达情况。CD68阳性表达胞浆呈黄色或棕黄色。在400倍光镜下,每组取5张,每张取5个视野,运用Image-Pro Plus 6.0软件分析,棕色阳性染色颗粒以(CD68+细胞数/总细胞数)×100%表示。
4Westernblotting检测
检测肝组织、胰腺组织中 JNK1、p-JNK1、NF-κB p65、IκB和GRP78的表达。
5统计学处理
结 果
1LPS及MS相关的炎症介质变化
表1显示,模型组大鼠血清LPS、TNF-α、CRP和MCP-1从实验第3个月开始持续增高至第12月末,但在各阶段之间未见明显差异。

表1 LPS、FFA及MS相关的炎性介质变化
*P<0.05vs3C group;△P<0.05vs3H group.3C,6C,9C and 12C represent control rats in 3,6,9 and 12 months, respectively; 3H,6H,9H and 12H represent high-sucrose and high-fat diet for 3,6,9 and 12 months,respectively.
2FINS、FPG和HOMA-IR的结果
表2显示,模型组各阶段大鼠与正常组相比,血浆FINS和FPG明显升高且有统计学意义(P<0.05),胰岛素抵抗指数与正常组相比均有显著差异(P<0.05)。
表2大鼠FBS、FINS和HOMA-IR的变化

*P<0.05vs3C group;△P<0.05vs3H group;#P<0.05vs6H group;▲P<0.05vs9H group.
3免疫组化结果观察
3.1脂肪组织 正常组大鼠脂肪组织无CD68阳性的单核细胞浸润,见图1A。高糖高脂组3月时可见脂肪组织内少许CD68阳性的巨噬细胞,见图1B;6月时较多巨噬细胞浸润至脂肪组织,见图1C;9月时脂肪组织中较多巨噬细胞浸润,且脂肪组织血管周围不断有单核细胞游出,见图1D、F;12月时脂肪组织内大量巨噬细胞浸润,且脂肪组织血管周围有成团单核细胞游出,见图1E、G;高糖高脂组各时段CD68阳性表达与同时段对照组相比差异均有统计学意义(P<0.05),见表3。
表3大鼠脂肪组织、肝脏和胰腺巨噬细胞浸润的情况


GroupAdiposetissueCD68+LivertissueCD68+PancreaticCD68+3C0.00±0.001.14±1.790.00±0.003H6.81±1.35*16.96±2.42*0.00±0.006C0.00±0.001.89±2.280.00±0.006H11.13±3.57*△28.43±10.13*△2.60±0.74*△9C0.00±0.003.02±2.490.00±0.009H17.52±3.54*△#29.67±3.98*△14.73±1.75*△#12C0.00±0.004.07±2.740.00±0.0012H17.07±3.56*△#30.67±3.22*△20.79±1.65*△#▲
*P<0.05vs3C group;△P<0.05vs3H group;#P<0.05vs6H group;▲P<0.05vs9H group.
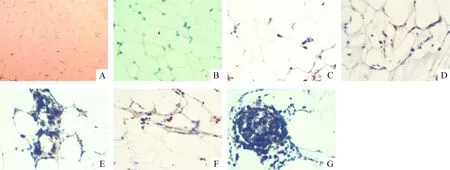
Figure 1. CD68 expression in adipose tissue of rats in each group(immunohistochemical staining,×400). A: normal control; B,C,D,E: high-sucrose and high-fat diet for 3, 6, 9 and 12 months, respectively;F, G: CD68 expression in perivascular area in adipose tissue of rats exposed to high-sucrose and high-fat diet for 9 and 12 months,respectively.
图1正常和高糖高脂组大鼠脂肪组织中CD68的表达
3.2肝组织 正常组大鼠肝组织仅有极少量CD68阳性的巨噬细胞浸润,见图2A。高糖高脂组3月时可见肝组织内少量CD68阳性的巨噬细胞,见图2B;6月时大量巨噬细胞弥漫性浸润肝组织,见图2C;9月、12月时肝组织中仍有大量巨噬细胞浸润,见图2D、E;高糖高脂组各时段CD68阳性表达与同时段对照组相比差异均有统计学意义(P<0.05),见表3。
3.3胰腺组织 正常组大鼠胰腺组织无CD68阳性的巨噬细胞浸润,见图3A。高糖高脂组3月时可见胰腺外分泌腺内少量CD68阳性的巨噬细胞,见图3B;6月时胰岛周围有少量巨噬细胞浸润,见图3C;9月、12月时胰岛内有大量巨噬细胞浸润,见图3D、E;高糖高脂组各时段CD68阳性表达与同时段对照组相比差异均有统计学意义(P<0.05),且高糖高脂组各时段间比较均有统计学意义(P<0.05),见表3。

Figure 2. CD68 expression in liver tissue of rats in each group(immunohistochemical staining,×200). A: normal control; B,C,D,E: high-sucrose and high-fat diet for 3, 6, 9 and 12 months, respectively.
图2正常和高糖高脂组大鼠肝组织中CD68的表达

Figure 3. CD68 expression in pancreas of rats in each group(immunohistochemical staining,×400). A: normal control; B,C,D,E: high-sucrose and high-fat diet for 3, 6, 9 and 12 months, respectively.
图3正常和高糖高脂组大鼠胰腺组织中CD68的表达
4Westernblotting结果
4.1肝脏
4.1.1JNK1磷酸化的激活 模型组与正常组相比,JNK1的表达无明显量的变化,而p-JNK1自3月开始活性升高,于6月升至最高值且持续到12月,与对照组差异明显(P<0.05),见图4、表4。
4.1.2NF-κB的活化与IκB的降解 在静息状态下NF-κB与IκB结合, 处于非活化状态。当细胞受到内毒素刺激时,IκB磷酸化并与NF-κB分离, 导致NF-κB持续活化,并转至胞核调控TNF-α等基因的表达。模型组NF-κB的表达自3月开始增强,于6月升至最高值且持续到12月,与对照组差异明显(P<0.05);而IκB的表达自3月开始减弱,于6月降至最低值且持续到12月,与对照组差异明显(P<0.05),见图4、表4。
4.1.3GRP78的表达 模型组GRP78的表达自3月开始增强,于6月升至最高,虽9-12月表达略有下降,但仍保持较高水平,与对照组差异明显(P<0.05),见图4、表4。
4.2胰腺
4.2.1JNK1磷酸化的激活 模型组与正常组相比,JNK1的表达无明显量的变化,而p-JNK1自6月开始活性升高,于9月升至最高值,12月表达虽略有下降,但仍保持较高水平,与对照组差异明显(P<0.05),见图5、表5。
4.2.2NF-κB的活化与IκB的降解 模型组NF-κB的表达自9月开始增强,于12月升至最高值,与对照组差异明显(P<0.05);而IκB的表达自9月开始减弱,于12月降至最低值,与对照组差异明显(P<0.05),见图5、表5。

Figure 4. The expression of p-JNK1/JNK1,GRP78,NF-κB and IκB in the liver.NC: normal control; 3H,6H,9H,12H: high-sucrose and high-fat diet for 3, 6, 9 and 12 months, respectively.
图4大鼠肝脏JNK1、p-JNK1、GRP78、NF-κB和IκB蛋白的表达

表4 大鼠肝脏p-JNK1 /JNK1、GRP78、NF-κB和IκB蛋白的表达
*P<0.05vsNC group;△P<0.05vs3H group;#P<0.05vs6H group;▲P<0.05vs9H group.
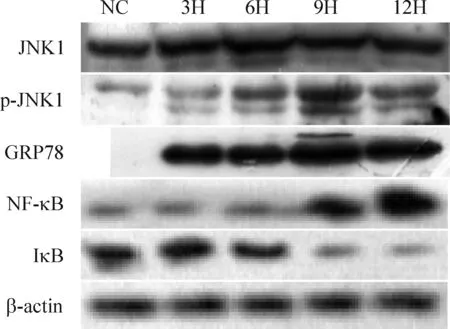
Figure 5. The expression of p-JNK1/JNK1,GRP78,NF-κB and IκB in the pancreas. NC: normal control; 3H,6H,9H,12H: high-sucrose and high-fat diet for 3, 6, 9 and 12 months, respectively.
图5大鼠胰腺JNK1、p-JNK1、GRP78、NF-κB和IκB蛋白的表达
4.2.3GRP78的表达 正常组未见表达,模型组GRP78的表达自3月开始增强,于9月升至最高且持续至12月保持较高水平,与对照组差异明显(P<0.05),见图5、表5。
5相关性分析
将每个阶段LPS与HOMA-IR作相关分析,结果显示LPS与HOMA-IR呈明显正相关(3月:r=0.782,P<0.05);(6月:r=0.953,P<0.01);(9月:r=0.848,P<0.05);(12月:r=0.867,P<0.05)。
讨 论
我们采用高糖高脂喂养大鼠1年,大鼠先后出现非酒精性脂肪性肝病、Ⅱ型糖尿病[4]、动脉粥样硬化及其相关的心血管疾病(待发表),证实这是贴近临床实际的代谢综合征的动物模型。非酒精性脂肪性肝病、Ⅱ型糖尿病、高血压病、动脉粥样硬化及其相关的心脑血管疾病等都与代谢综合征密切相关。这一组疾病是以慢性低度炎症为特征的代谢性疾病,其共同的基本发病机制是胰岛素抵抗。而肠源性内毒素血症在其中发挥重要的作用。

表5 大鼠胰腺p-JNK1 /JNK1、GRP78、NF-κB和IκB蛋白的表达
*P<0.05vsNC group;△P<0.05vs3H group;#P<0.05vs6H group;▲P<0.05vs9H group.
大量研究表明,在NAFLD发病过程中均伴有肠源性内毒素血症,其原因与高糖高脂饮食喂养下肠内细菌繁殖增多、肠粘膜通透性增加以及肝Kupffer细胞(KC)吞噬功能下降有关[5-7]。许多NAFLD动物模型中都观察到血浆LPS水平升高[3],我们实验也证实NAFLD大鼠在单纯脂肪肝阶段血中LPS水平就升高,且在NAFLD的发展过程中始终保持高水平。另外,体外采用小剂量皮下注射LPS也可直接引起大鼠发生NASH与胰岛素抵抗[8]。Harte等[9]通过对临床患者长达半年到1年的观察证实NAFLD患者循环血中LPS水平明显升高, LPS水平的升高不取决于是否伴有T2DM,并且NAFLD各个阶段LPS无明显差别,这与我们的动物实验结果相一致,提示LPS在脂肪肝阶段就已经存在,并且在NAFLD的进展中发挥作用,影响着T2DM和MS的发生发展。越来越多的证据显示,血中升高的LPS在MS中具有重要作用[10-11]。Omar等[12]观察了346名T2DM患者伴有IETM,并发现内毒素与TG、葡萄糖、胰岛素异常间有明显相关性,证明T2DM患者亚临床炎症反应是循环血内毒素所介导。
LPS作用的靶器官主要涉及单核巨噬细胞系统和脂肪组织。在肝脏,LPS作用于KC通过形成TLR4-CD14复合物,激活NF-κB途径导致炎症介质TNF-α、IL-6等的大量释放产生系统性的效果从而影响T2DM的发生[13]。目前认为脂肪组织不仅仅参与代谢调节还参与免疫调节。脂肪组织中除了脂肪细胞还有为数不多的巨噬细胞。由于脂肪细胞储存过多的甘油三酯,细胞胀大而毛细血管没有相应的增长,脂肪细胞缺氧而坏死释放大量的脂肪细胞因子。这些细胞因子连同LPS促进单核巨噬细胞生成的趋化蛋白(如MCP-1),后者把毛细血管内的单核细胞吸引到炎症部位形成新的巨噬细胞,我们免疫组化染色也观察到第9个月、第12个月脂肪组织血管周围有成团的新游出的巨噬细胞。脂肪组织中新移居的巨噬细胞以及脂肪细胞都能被LPS激活,分泌的TNF-α、IL-6、IL-1等炎症介质一方面加重IR,另一方面启动系统性的炎症反应,对肝脏、胰腺及其它系统器官造成损伤。CD68是巨噬细胞的标志物,能较好地反映巨噬细胞的浸润程度。我们实验结果显示在高糖高脂喂养早期大鼠即伴有IETM,且持续1年保持高水平,TNF-α、MCP-1、CRP水平同LPS变化趋势一致。对脂肪组织、肝脏、胰腺进行免疫组化染色,CD68呈阳性反应,表明这些组织都有不同程度的巨噬细胞浸润,因此提示LPS作用于这些新移居的巨噬细胞,使之释放大量的致炎性细胞因子和炎症介质,从而诱导MS相关疾病出现亚临床的慢性低度炎症。
本实验结果表明, 模型组大鼠出现了空腹高血糖和高胰岛素血症,并有明显的胰岛素抵抗 (IR)。相关分析显示, 各个阶段模型组大鼠的 LPS与 IR之间呈正相关。众所周知, IR是MS相关疾病发生和发展的基础。MS几乎所有的组份如中心性肥胖、高血糖、血脂异常、高血压等都是由IR所引起的。LPS可直接促进脂肪分解,或通过TNF-α间接促进脂肪分解,增加FFA的生成,使循环血浆FFA明显增多。增高的FFA能使IRS1/2丝氨酸磷酸化,抑制胰岛素受体酪氨酸激酶的活性,而导致IR的发生[14]。LPS作用于肝脏KC和脂肪组织中巨噬细胞形成TLR4-CD14复合物,激活NF-κB途径导致炎症介质TNF-α、IL-6等的大量释放而导致IR发生。此外,LPS可以促进活性氧(ROS)产生[15],诱发氧化应激,导致IR的发生。研究已经证实,内毒素是重要的内质网应激原,它可以通过未折叠蛋白和/或钙聚集等多种途径直接引起内质网应激[16],也可以通过氧化应激间接诱导内质网应激。
内质网应激目前被认为是代谢性疾病的炎症基础,是胰岛素抵抗发生的关键机制。在慢性代谢性疾病如肥胖、胰岛素抵抗和Ⅱ型糖尿病发生发展中至关重要。内质网应激主要被错误折叠蛋白反应(UPR)所启动。UPR主要通过3个跨膜蛋白所介导,分别是PERK、IRE1α和ATF6。在静息状态下,3个跨膜蛋白都与分子伴侣GRP78结合形成蛋白复合体而维持无活性状态。内质网应激时,这3个蛋白感受分子活化,同时内质网应激的标志物GRP78从跨膜蛋白脱落。UPR可激活多种通路,主要通过激活JNK和IKK-NF-κB信号通路相互作用,引起炎症因子的表达。过去人们普遍认为,肥胖是通过诱导炎症反应从而引起IR的。内质网应激所致的IR主要是通过IRE1α介导的JNK活化来实现的,说明内质网应激是IR的关键机制。又如,肝细胞内蓄积大量FFA,通过脂质中间的代谢产物(如甘油二酯、神经酰胺)即可引起内质网应激而发生炎症和凋亡,提示内质网应激是炎症和凋亡发生的重要机制。
我们的实验结果显示模型组大鼠血中LPS水平升高,免疫组化显示肝脏巨噬细胞浸润自第3个月开始增加且持续至12月;胰腺巨噬细胞浸润开始在外分泌腺然后6个月进展至胰岛周围,9、12月胰岛才明显出现巨噬细胞的浸润。分子生物学结果显示模型组肝脏p-JNK、NF-κB和GRP78的蛋白表达都是自第3个月开始增强,至第6个月升至最高且持续至第12个月;模型组胰腺p-JNK和NF-κB的蛋白表达分别自第6个月以后才开始逐渐增强,而胰腺的内质网应激标志物GRP78自第3个月表达就显著增加,6个月以后进一步增强。上述结果表明,血中LPS升高水平与肝脏、胰岛巨噬细胞浸润以及p-JNK、NF-κB和GRP78走向大体一致,而胰腺GRP78在第3个月就显著增加,这可能是由于IR致使胰岛素分泌代偿性增多超过内质网的处理能力从而活化UPR致使发生炎症、凋亡或坏死,最终导致β细胞损伤及凋亡发生,提示内质网应激是炎症与IR发生的关键机制。具体而言,LPS可能通过肝脏和胰岛浸润的单核巨噬细胞,诱发内质网应激,使GRP78从跨膜蛋白脱落入血,使JNK和NF-κB信号蛋白表达增加。这样,一方面诱发了胰岛素抵抗,使体内发生系统代谢障碍;另一方面引发肝脏、胰岛炎症反应使NAFLD、T2DM等与MS相关的代谢性疾病发生慢性低度炎症。
综上所述,非酒精性脂肪性肝病、T2DM等MS相关疾病大多伴有肠源性内毒素血症,LPS与相应的受体TLR4结合分别作用于脂肪细胞、天然免疫系统通过NF-κB、JNK和GRP78等信号转导通路使肝脏、胰岛引发慢性低度炎症与胰岛素抵抗。除LPS外,血中葡萄糖、FFA是TLR4的内源性配体,通过天然免疫系统发挥的作用也不容忽视。
[1] 周 鑫,韩德五,李素红,等.高糖高脂致大鼠非酒精性脂肪肝合并高血糖动物模型的研究[J].中国比较医学杂志,2011,21(7):1-7.
[2] Wigg AJ,Roberts-Thomson IC,Dymock RB,et al. The role of small intestinal bacterial overgrowth, intestinal permeability, endotoxaemia, and tumour necrosis factor α in the pathogenesis of non-alcoholic steatohepatitis[J].Gut,2001,48(2):206-211.
[3] Brun P,Castagliuolo I,Di Leo V,et al. Increased intestinal permeability in obese mice: new evidence in the pathogenesis of nonalcoholic steatohepatitis[J].Am J Physiol Gastrointest Liver Physiol,2007,292(2):G518-G525.
[4] Kudo H, Takahara T, Yata Y,et al. Lipopolysaccharide triggered TNF-α-induced hepatocyte apoptosis in a murine non-alcoholic steatohepatitis model[J].J Hepatol,2009,51(1):168-175.
[5] Erridge C,Attina T,Spickett CM,et al.A high-fat meal induces low-grade endotoxemia:evidence of a novel mechanism of postprandial inflammation[J].Am J Clin Nutr,2007,86(5):1286-1292.
[6] Farhadi A,Gundlapalli S,Shaikh M,et al.Susceptibility to gut leakiness:a possible mechanism for endotoxaemia in non-alcoholic steatohepatitis[J].Liver Int,2008,28(7):1026-1033.
[7] 吴惠文.枯否细胞在非酒精性脂肪肝炎发生中的作用[M].∥韩德五.肠源性内毒素血症与肝病.第1版.北京:中国科技出版社,2004.493-504.
[8] 郭江红,韩德五,郭建红. 内毒素诱发大鼠非酒精性脂肪性肝炎和胰岛素抵抗[J]. 中国病理生理杂志, 2010,26(5):1009-1011.
[9] Harte AL,da Silva NF,Creely SJ,et al. Elevated endotoxin levels in non-alcoholic fatty liver disease[J]. J Inflamm(Lond), 2010,7:15.
[10]Creely S, McTernan P, Kusminski C,et al. Lipopolysaccharide activates an innate immune system response in human adipose tissue in obesity and type 2 diabetes[J]. Endocrinol Metab,2007,292(3):740-747.
[11]Cani PD, Amar J, Iglesias MA,et al. Metabolic endotoxemia initiates obesity and insulin resistance[J]. Diabetes, 2007, 56(7): 1761-1772.
[12]Omar S, Nasser M, Daghri K,et al.Changes in endotoxin levels in T2DM objects on anti-diabetic therapies[J].Cardiovasc Diabetol,2009,8:20.
[13]Pickup JC,Crook MA. Is type Ⅱ diabetes mellitus a disease of the innate immune system[J]. Diabetologia,1998,41(10): 1241-1248.
[14]Feldstein AE,Werneburg NW,Canbay A,et al. Free fatty acids promote hepatic lipotoxicity by stimulating TNF-α expression via a lysosomal pathway[J].Hepatology,2004,40(1):185-194.
[15]Gungör N, Pennings JL, Knaapen AM, et al.Transcriptional profiling of the acute pulmonary inflammatory response induced by LPS: role of neutrophils[J].Respir Res,2010,11:24.
[16]贾建桃,张慧英,田小霞,等.葡萄糖调节蛋白78在复合2因素诱导的大鼠肝肺综合征中的作用[J].中国病理生理杂志,2011,27(8):1580-1585.
Roleofintestinalendotoxemiaindevelopmentofmetabolicsyndrome-relateddiseasesinrats
ZHOU Xin1, HAN De-wu1, XU Rui-ling1, LI Su-hong2, WU Hui-wen3, ZHAO Yuan-chang1
(1InstituteofHepatology,ShanxiMedicalUniversity,Taiyuan030001,China;2DepartmentofPathology,TumorHospitalofShanxiProvince,Taiyuan030013,China;3ShanxiMedicalUniversityofFenyangCollege,Fenyang032200,China.E-mail:xinxin6633@yeah.net)
AIM: To investigate the effect of intestinal endotoxemia (IETM) on the development of metabolic syndrome (MS)-related diseases and its molecular mechanisms.METHODSSixty-four rats were randomly divided into 8 groups, which were normal groups of 3 months (3C), 6 months (6C), 9 months (9C) and 12 months (12C),and high-sucrose and high-fat groups of 3 months (3H), 6 months (6H), 9 months (9H) and 12 months (12H). The levels of lipopolysaccharide (LPS), tumor necrosis factor α (TNF-α), C-reactive protein (CRP), monocyte chemotactic protein-1 (MCP-1), fasting plasma glucose (FPG) and fasting plasma insulin (FINS) in the serum were measured. The insulin resistance index (HOMA-IR) was also calculated. The protein expression of CD68 in the tissues of fat, liver and pancreas was detected by the method of immunohistochemistry. The expression of JNK1, p-JNK1, NF-κB p65, IκB and GRP78 in the liver and pancreas was analyzed by Western blotting.RESULTSThe levels of LPS, FFA, TNF-α, CRP, MCP-1, FPG, FINS and HOMA-IR in high-sucrose and high-fat groups of every phase were higher than those in normal groups. The results of immunohistochemistry showed that the expression of CD68 (representing the infiltration of mononuclear cells) in the tissues of fat, liver and pancreas in high-sucrose and high-fat groups gradually increased from the 3rd month to the 12th month. Compared with normal groups, the expression of p-JNK1, NF-κB p65 and GRP78 in the liver were increased from the 3rd month to the 12th month, but the expression of IκB in the liver was reduced. The expression of p-JNK1 and NF-κB p65 in the pancreatic tissues was increased from the 6th month to the 12th month, but the expression of IκB reduced. However, the expression of GRP78 in pancreatic tissues was increased from the 3rd month to the 12th month.CONCLUSIONIntestinal endotoxemia may play an important role in the development of MS-related diseases. LPS-mediated JNK1, NF-κB and GRP78 expression may be involved in the signal transduction pathways of MS development induced by intestinal endotoxemia.
Intestinal endotoxemia; Metabolic syndrome; Non-alcoholic fatty liver disease; Diabetes mellitus,type 2; Insulin resistance
R363
A
10.3969/j.issn.1000-4718.2012.03.019

