人受体活性修饰蛋白1基因修饰的骨髓间充质干细胞移植对兔血管成形术后新生内膜的影响*
龙仙萍, 赵然尊, 石 蓓, 许官学
(遵义医学院第一附属医院心血管内科,贵州 遵义 563003)
1000-4718(2012)04-0675-08
2011-11-26
2012-02-21
国家自然科学基金资助项目(No. 30860100);贵州省国际合作项目(No. 黔科合外G字[2010] 0732)
△通讯作者 Tel:0852-8608406 ;E-mail: shibei2147@163.com
人受体活性修饰蛋白1基因修饰的骨髓间充质干细胞移植对兔血管成形术后新生内膜的影响*
龙仙萍, 赵然尊, 石 蓓△, 许官学
(遵义医学院第一附属医院心血管内科,贵州 遵义 563003)
目的探讨人受体活性修饰蛋白1(hRAMP1)基因修饰的骨髓间充质干细胞(MSCs)移植对动脉粥样硬化模型兔颈动脉球囊成形术后新生内膜增殖的影响。方法密度梯度离心法加贴壁培养法获得MSCs,并以携带hRAMP1的腺病毒转染MSCs获得hRAMP1基因修饰的MSCs(hRAMP1-MSCs)。建立动脉粥样硬化狭窄并球囊损伤血管成形术的兔模型,随机分为hRAMP1-MSCs组、MSCs组和对照组,模型建立成功后经耳缘静脉分别注射携带pAd2-EGFP-hRAMP1或pAd2-EGFP的MSCs和PBS,于细胞移植后7 d、14 d和28 d分别处死动物取材, 观察MSCs归巢、血管内皮化程度及内膜增生程度,同时检测血清血管内皮生长因子(VEGF)水平和血管局部内皮型一氧化氮合成酶(eNOS)表达。结果细胞移植后不同时点hRAMP1-MSCs组和MSCs组损伤血管增生内膜均有CD31和增强型绿色荧光蛋白(EGFP)分布,但以 hRAMP1-MSCs组内皮化程度明显,MSCs组次之,两者与对照组比较均有显著差异(P<0.05);细胞移植后不同时点hRAMP1-MSCs组和MSCs组内膜增生面积及再狭窄率均低于对照组(P<0.05),尤以hRAMP1-MSCs组降低明显;细胞移植后不同时点hRAMP1-MSCs组和MSCs组血清VEGF水平和血管eNOS表达较对照组增加(P<0.05),而 hRAMP1-MSCs组又明显高于MSCs组(P<0.05);损伤血管新生内膜增殖细胞核抗原(PCNA)阳性表达在hRAMP1-MSCs组最少,对照组最多。结论hRAMP1基因修饰的MSCs能更有效促进损伤内膜快速内皮化,重组hRAMP1腺病毒载体不影响MSCs向内皮细胞分化潜能。基因联合干细胞治疗能更好地促进损伤动脉快速内皮化,降低血管成形术后再狭窄。
受体活性修饰蛋白1; 间充质干细胞; 新生内膜; 再内皮化; 血管成形术
骨髓间充质干细胞(mesenchymal stem cells, MSCs)因其具有多项分化潜能,因此在动脉粥样硬化和心肌梗死的基础领域得以广泛研究。MSCs治疗心肌梗死作用在动物实验和小规模临床研究中得到证实,但较少研究关注MSCs对引起心肌梗死的罪犯血管及其它粥样硬化动脉的影响。我们先前的研究也显示,MSCs移植治疗可在一定程度上促进损伤颈动脉的快速再内皮化,一定程度上降低新生内膜增生[1]。然而MSCs具有分化为血管平滑肌细胞(vascular smooth muscle cells,VSMCs)潜能,可能成为血管损伤后局部VSMCs增殖的的来源,加重血管成形术后再狭窄。基因修饰MSCs可能有利于解决这一问题。降钙素基因相关肽(calcitonin gene-related peptide,CGRP)是目前已知最强的血管活性肽,对心血管系统具有保护作用。研究发现CGRP可通过cAMP-PKA途径激活一氧化氮合酶促进内皮细胞增生[2-3], CGRP与受体结合抑制体外培养的VSMCs增殖[4]。受体活性修饰蛋白1(receptor activity-modifying protein 1,RAMP1)是调节CGRP受体活性的关键亚单位,外源RAMP1基因可增加内源性CGRP活性。因此本研究拟通过腺病毒载体介导人RAMP1(humanRAMP1,hRAMP1)转染MSCs后移植动脉粥样硬化模型兔颈动脉球囊成形术模型,观察高表达hRAMP1的MSCs移植对血管成形术后 内皮化和新生内膜的影响,以期为防治血管成形术后再狭窄提供实验依据。
材 料 和 方 法
1材料
1.1动物与分组 54只新西兰大白兔,雌雄不限,体重(2.0±0.2) kg,兔龄 4~5月,购自第三军医大学实验动物中心。实验分为hRAMP1转染MSCs移植组(hRAMP1-MSCs,n=18)、空病毒转染MSCs移植组(MSCs组,n=18)和PBS移植对照组(C组,n=18)组,3组动物均构建动脉粥样硬化狭窄模型并接受球囊成形术。
1.2试剂与仪器 含有hRAMP1基因或增强型绿色荧光蛋白基因的腺病毒载体(pAd2-EGFP-hRAMP1和pAd2-EGFP)由本室构建,经PCR、Western blotting和测序鉴定成功。胰酶、低糖DMEM及高糖DMEM (Gibco),胎牛血清(HyClone),二甲基亚砜(北京拜尔迪生物公司), Percoll液和噻唑蓝(MTT)(Promega),小鼠抗兔CD31单克隆抗体、山羊抗小鼠IgG-TRITC(红光)、羊抗绿色荧光蛋白 (green fluorescence protein,GFP)多克隆抗体和驴抗山羊IgG-FITC(绿光)购于Abcam;鼠抗兔内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)多克隆抗体、驴抗小鼠IgG购自Santa Cruz;增殖细胞核抗原(proliferating cell nuclear antigen,PCNA) 单克隆抗体和小鼠SABC免疫组化试剂盒购自武汉博士德公司;鼠抗兔CD29、CD45和CD90抗体购自US Biological。血管内皮生长因子(vascular endothelial growth factor,VEGF) ELISA试剂盒购于上海西塘生物公司。裂解液和其它试剂采用国产或进口分析纯试剂。2F PTCA 球囊导管为Cordis产品。图像处理系统为Leica Qwin Plus产品,FACS Calibur流式细胞仪为BD产品。
2方法
2.1MSCs分离、培养和鉴定 取同批次兔通过密度梯度离心并贴壁培养法获得MSCs用于细胞移植。简述如下:以苯巴比妥钠(30 mg/kg)麻醉动物,无菌操作抽取股骨骨髓,1 000 r/min离心10 min,弃上清,无血清DMEM重悬细胞,加入1.073 kg/L的Percoll液2 000 r/min离心20 min,吸取液面交界处细胞悬液,加入无血清DMEM混匀后1 000 r/min离心5 min,弃上清,加入含10%FBS、1×105U/L青霉素和8×104U/L链霉素的DMEM,于37 ℃、5%CO2培养箱中孵育。每2~3 d更换培养液,MSCs增殖达80%融合时细胞传代,取第3~5代细胞用于病毒转染和细胞移植。同时流式细胞仪检测细胞表面抗原CD29、CD45和CD90的表达。
2.2重组腺病毒载体转染MSCs MSCs融合到80%时弃培养基,PBS洗2次,培养瓶中各加入1 mL无血清DMEM,以pAd2-EGFP-hRAMP1或pAd2-EGFP病毒液按最佳感染复数(multiplicity of infection,MOI)为800进行细胞转染,37 ℃、5 %CO2孵箱孵育4 h,最初2 h每隔15 min摇动培养板1次,4 h吸出DMEM液,PBS冲洗培养瓶2次后加入含10%胎牛血清DMEM继续培养,72 h后行细胞移植。
2.3建立动脉粥样硬化并球囊损伤血管兔模型及细胞移植 按课题组已成功构建的方法和标准[5]建立兔动脉粥样硬化模型;然后在无菌操作下行右侧颈动脉球囊成形术,用3%戊巴比妥钠(30 mg/kg)耳缘静脉麻醉动物,脱毛备皮消毒皮肤,取颈部正中切口,游离充分暴露颈总和颈内、外动脉,肝素钠100 U/kg充分抗凝,在距离颈总动脉分叉处约0.4 cm处结扎颈外动脉,血管夹阻断近心端和远心端颈总动脉,于颈外动脉近心侧进行穿刺,送入直径2.0F 球囊至颈总动脉,6个大气压充盈球囊后缓慢拖动持续1 min,间歇1 min后重复,总共3次以剥脱内膜,球囊损伤后,结扎颈外动脉近心端,去除血管夹,恢复血流,庆大霉素局部冲洗,逐层缝合颈部切口,大腿内侧注射青霉素8×105U/kg连续3 d预防感染;球囊损伤后24 h经耳缘静脉注射pAd2-EGFP-hRAMP1-MSCs及pAd2- EGFP-MSCs细胞悬液0.5 mL(计数约3×107),对照组移植等量PBS液作为对照。
2.4损伤处MSCs归巢及MSCs功能鉴定 分别于不同时点处死动物,部分血管取冰冻组织,经OCT包埋后连续切成6 μm超薄切片,进行免疫荧光双标记检测。将Ⅰ抗抗体即羊抗GFP多克隆抗体和大鼠 抗兔CD31 单克隆抗体混合后滴加(两种抗体终浓度为1∶100)玻片上,再将Ⅱ抗抗体FITC标记驴抗山羊IgG和TRITC标记的山羊抗鼠IgG(两种抗体终浓度为1∶200)混合后滴加于玻片,于荧光显微镜下分别用绿光和蓝光激发后观察结果并拍照。阴性对照组用PBS 代替Ⅰ抗, 其余步骤与以上相同。GFP阳性细胞为归巢的腺病毒转染的MSCs:阳性指数=荧光吸光度值×阳性面积/总面积,以3个不同横截断面的平均数来表示该组织的免疫荧光定量的最后数值;GFP及CD31双阳性的细胞定义为来源于MSCs的内皮细胞:计算阳性细胞核占同类总细胞核的百分比,以3个不同横截断面的平均值表示该组织的阳性率。
2.5Western blotting检测eNOS蛋白表达 在不同组中取相同长度和重量均匀的血管组织加裂解液,略碾磨匀浆,离心取上清,参照BCA蛋白定量试剂盒使用说明操作测定蛋白浓度,以50 μL上样, 10%SDS聚丙酰胺凝胶电泳后将蛋白转移至硝酸纤维素膜上,用TBST配制5%脱脂奶粉,将膜封闭1 h后,将膜与eNOS多克隆抗体一起孵育,4℃过夜,再与Ⅱ抗共同孵育2~3 h,显色,曝光,实验重复3次。以β-actin作为内参照,利用伯乐凝胶成像系统分析各Western blotting条带吸光度值,再计算各条带与内参照β-actin条带的吸光度比值做蛋白含量半定量分析。
2.6免疫组织化学检测α-SMA、CD31和PCNA表达及组织形态学分析 10%甲醇固定组织,石蜡包埋切片,脱蜡至水,蒸馏水冲洗,PBS冲洗3次,行抗原热修复15 min,随后冷却20 min,3%H2O2室温孵育10 min,以消除内源性过氧化物酶的活性,PBS冲洗3次,滴加正常山羊封闭血清,室温孵育30 min,倾去,勿洗,滴加小鼠抗兔CD31和PCNA (1∶100倍稀释),阴性对照滴加PBS缓冲液,4℃孵育过夜,PBS冲洗 3次后滴加抗小鼠Ⅱ抗37 ℃孵育30 min,PBS冲洗,再加SABC后37 ℃孵育20~30 min,PBS冲洗, 加DAB室温显色,苏木素复染,脱水透明,封片。光学显微镜下观察各组血管内膜CD31和PCNA表达情况并拍照。内皮化程度通过测定增生内膜CD31阳性表达的积分吸光度值(IA)表示,以3个不同横截断面的平均值统计。石蜡切片经梯度乙醇脱水,进行HE染色。利用光学显微镜及Leica Qwin Plus图像分析系统分析各组损伤血管再 内皮化情况。
2.7血清VEGF的检测 术前和细胞移植后7 d、14 d、28 d时采集外周血用ELISA法检测VEGF的水平。严格参照试剂说明书进行实验。
3统计学处理

结 果
1动物情况
实验期间3组实验动物组均无死亡,无手术切口感染或不愈合等情况;所有实验动物管腔均无血栓及闭塞。
2MSCs的分离、鉴定及转染
MSCs贴壁培养24 h开始贴壁,早期呈多角形或长梭形,传代后细胞逐渐呈均一的长梭样,呈现成纤维细胞样外观,见图1A、B;P3细胞用于实验。流式细胞术检测培养细胞显示CD29阳性率95.79%,CD45阳性率12.49%,CD90阳性率98.59%,见图2;经EGFP标记的重组腺病毒荧光显微镜下发出绿色荧光, pAd2-EGFP-RAMP1和pAd2-EGFP转染的MSCs,72 h后荧光显微镜下可见80%以上细胞可见绿色荧光,见图1C、D,说明重组腺病毒转染细胞成功。光镜观察细胞生长状态良好,无形态改变。
3损伤血管再内皮化程度测定
CD31是内皮细胞特征性标记抗原,检测血管损伤处CD31表达可间接反映血管内皮化程度。细胞移植后7 d、14 d和28 d新生血管内膜附近有EGFP阳性细胞分布,EGFP阳性表达同时CD31阳性表达,尤以hRAMP1-MSCs组明显,MSCs组次之,而对照组血管则无EGFP和CD31阳性表达,见图3、4。血管增生内膜EGFP表达同时有CD31阳性,表明重组腺病毒转染至MSCs成功,且MSCs归巢至损伤血管并分化为血管内皮细胞,促进损伤动脉快速内皮化。提示外源RAMP1能调节局部环境促进MSCs向内皮细胞分化或者外源RAMP1能调节CGRP促进损伤内皮快速内皮化作用。
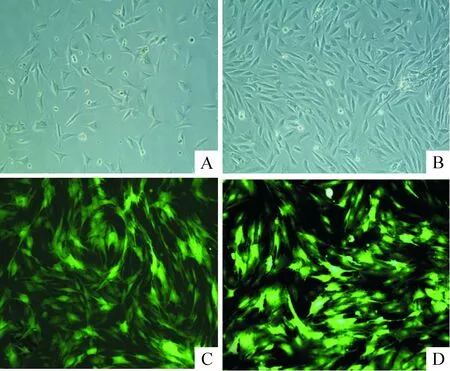
Figure 1. Culture and transfection of mesenchymal stem cells (MSCs)(×100). A:primary cells cultured for 7 d;B:passaged cells(passage 3); C:MSCs transfected with pAd2-EGFP-RAMP1 for 72 h; D:MSCs transfected with pAd2-EGFP for 72 h.
图1细胞培养及转染图片
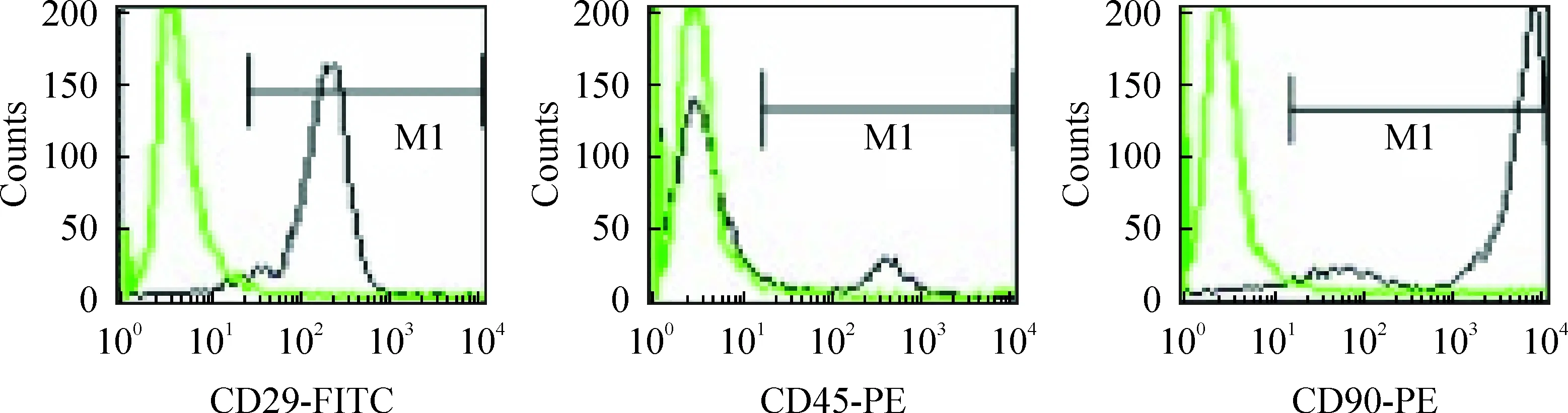
Figure 2. Passage 3 of MSCs were analyzed by flow cytometry.The results showed that most of the cells expressed CD29 and CD90, while very few cells expressed CD45.
图2P3MSCs表达CD29和CD90,极少量细胞表达CD45
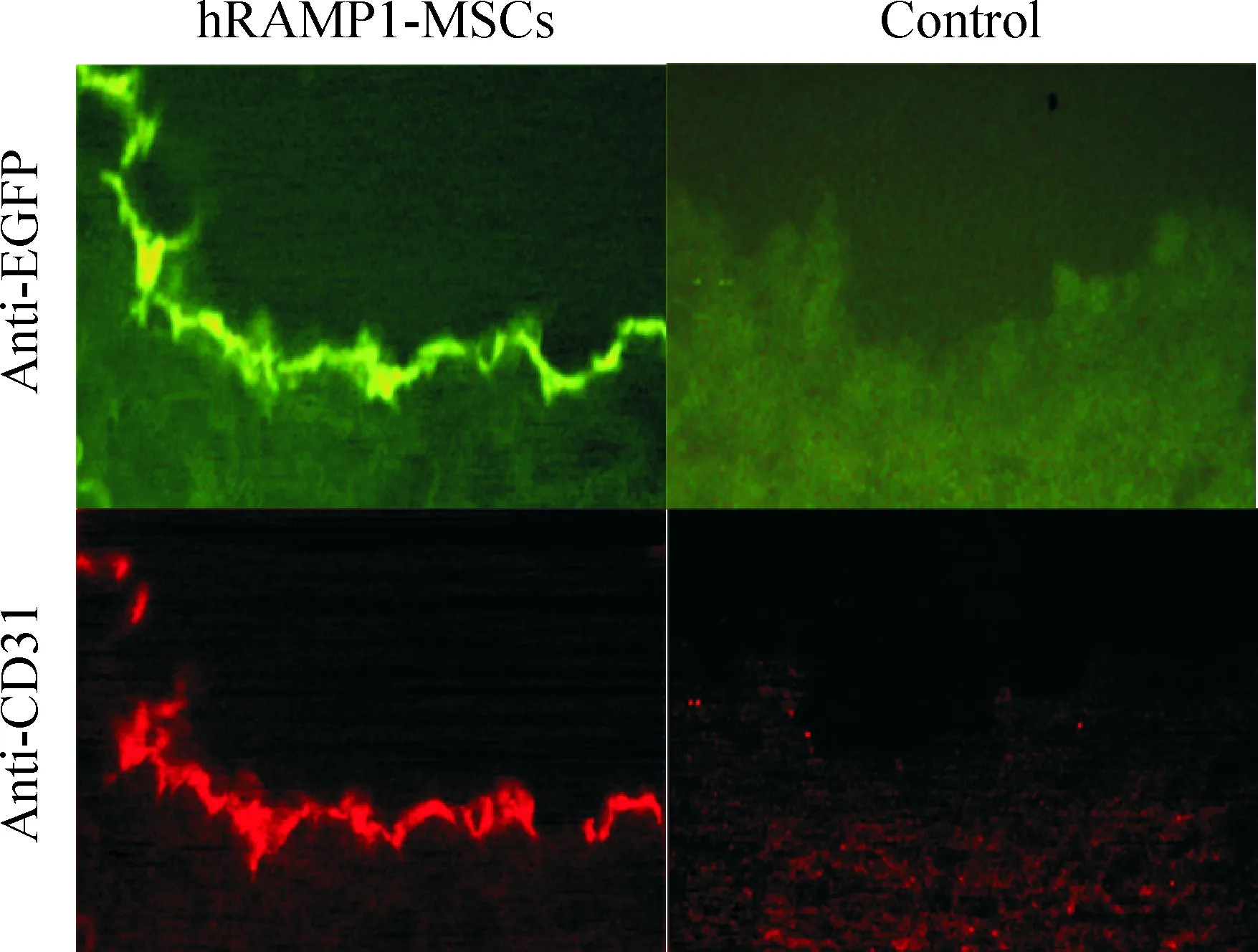
Figure 3. The expression of CD31 and EGFP in the injuried blood vessel 28 d after MSCs transplantation(×400).
图3细胞移植后28d损伤血管CD31和EGFP的表达
4组织形态学结果分析
血管成形术并细胞移植后7~28 d取材,各组均可见新生内膜增生;细胞移植后7 d、14 d和28 d,hRAMP1-MSCs组和MSCs组的内膜增生面积和内膜增殖率均低于对照组(P<0.05),hRAMP1-MSCs组又低于MSCs组(P<0.05),血管正常颈动脉内弹力板完整,内膜为单层柱状上皮,见图5、6。
5血管损伤局部eNOS测定
应用Western blotting检测细胞移植后28 d eNOS蛋白表达,结果显示:hRAMP1-MSCs组和MSCs组eNOS蛋白表达较对照组明显增多(P<0.05),尤以hRAMP1-MSCs组明显(P<0.05),见图7A、B。
6免疫组织化学分析
免疫组织化学方法检测显示:血管增生内膜见内皮细胞特征性标记物CD31表达,且沿着管腔内膜分布,见图8,内皮化程度分析显示细胞移植后7 d、14 d和28 d, hRAMP1-MSCs和MSCs组内皮化程度均优于对照组(P<0.05),尤以hRAMP1-MSCs组明显(P<0.05),见图9。PCNA 是一种参与增殖的核蛋白,反映细胞增殖状态的指标,PCNA表达减少意味着细胞增殖活性下降,细胞移植后7 d 、14 d和28 d,损伤血管免疫组织化学方法检测显示: hRAMP1-MSCs和MSCs组增生内膜细胞PCNA表达阳性率均低于对照组,见图8。由此可见促进损伤血管快速内皮化可抑制细胞增殖活性。
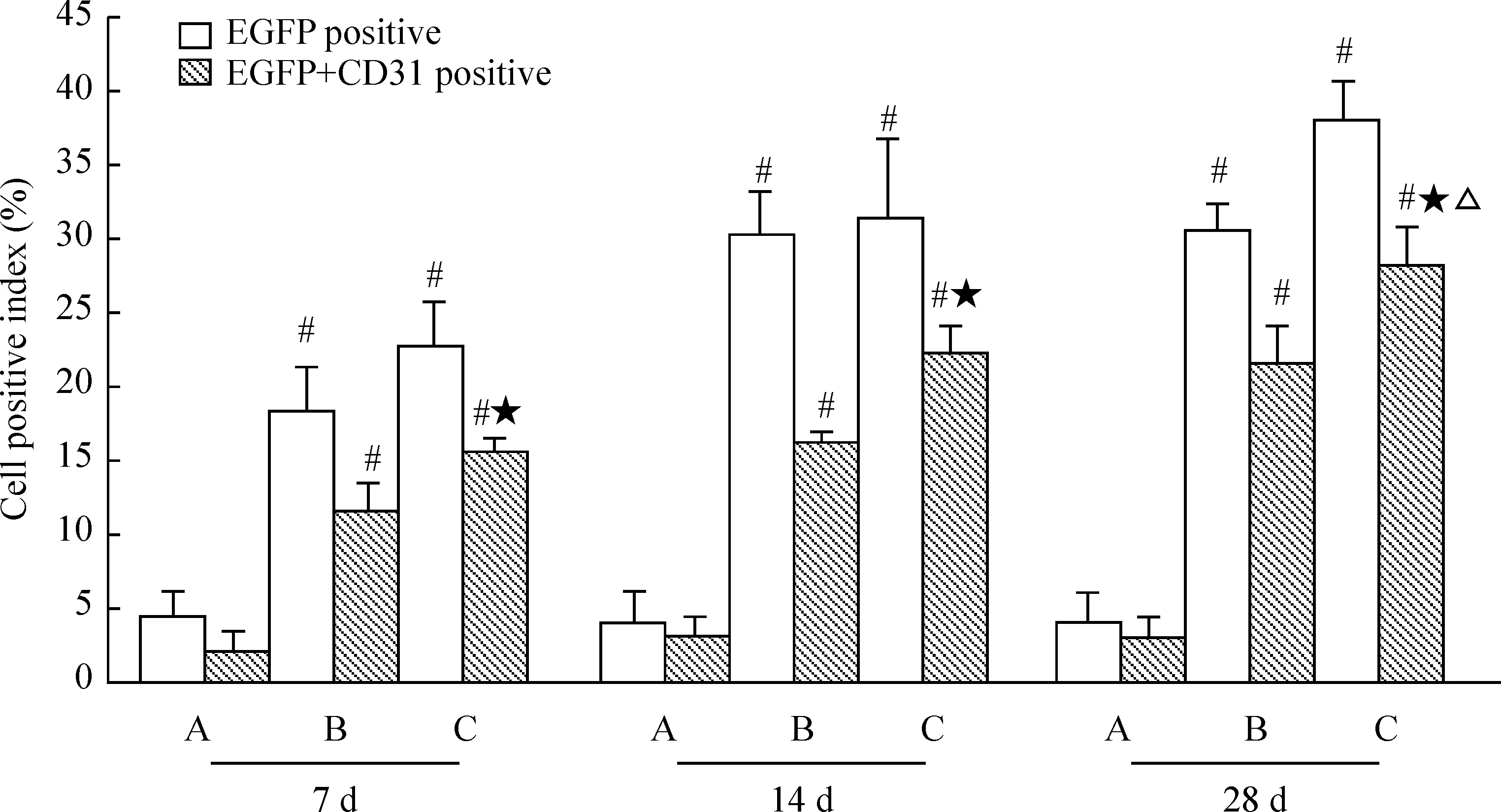
图4细胞移植后7d、14d和28d,MSCs归巢及CD31阳性表达率
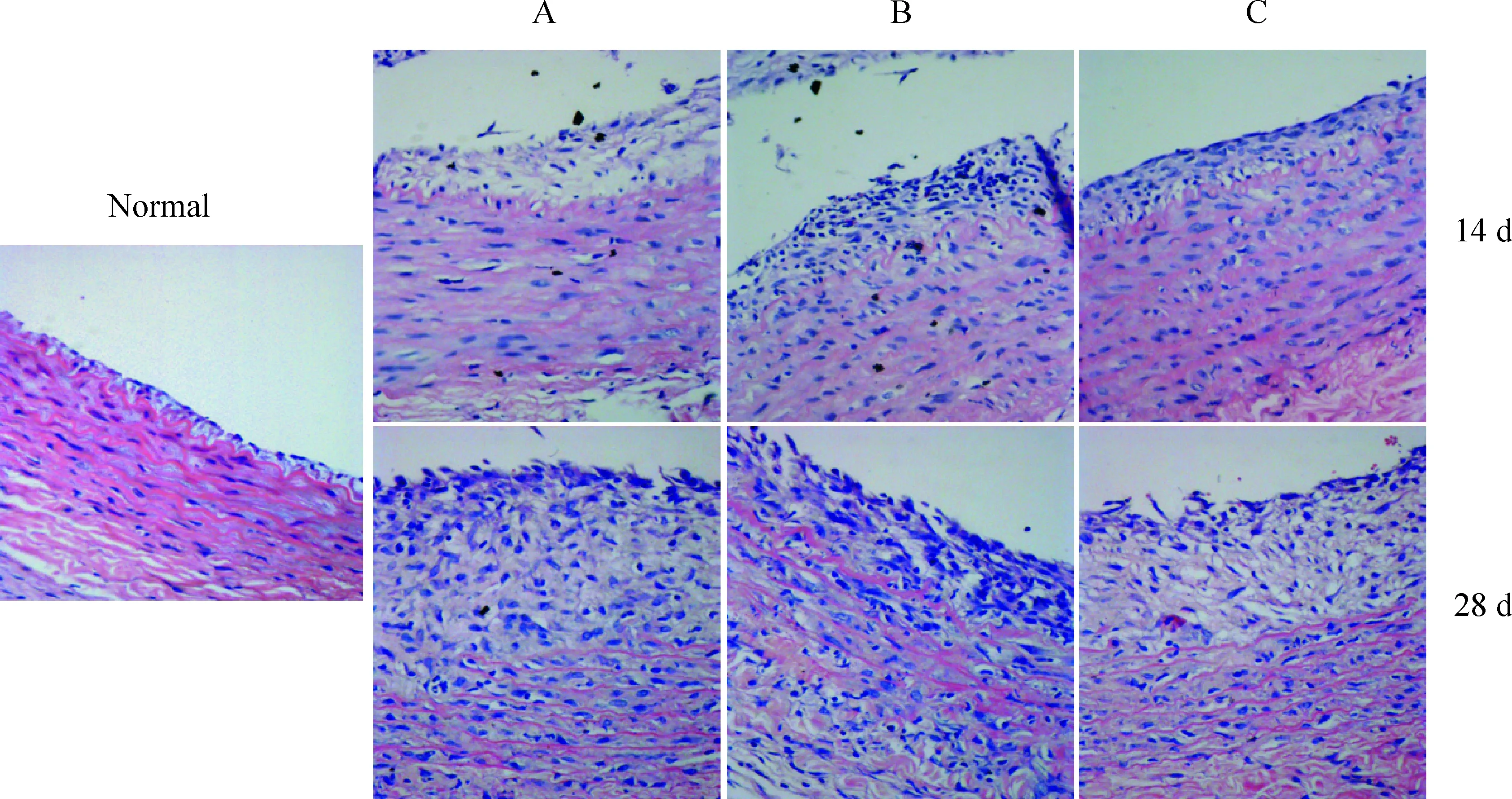
Figure 5. Neointima thickeness of the injuried blood vessel 14 d and 28 d after MSCs transplantation (×400).A:control group; B:MSCs group; C:hRAMP1-MSCs group.
图5细胞移植后14d和28d损伤血管内膜增殖
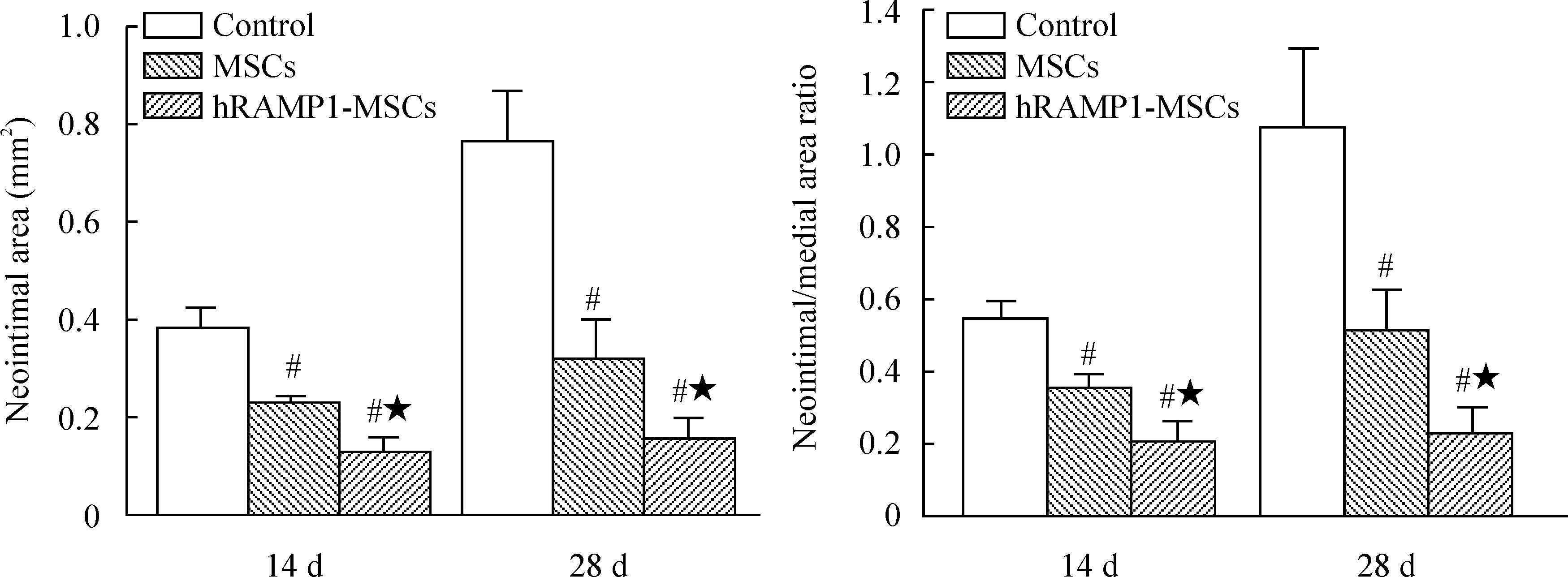
图6细胞移植后14d和28d损伤血管内膜增殖情况
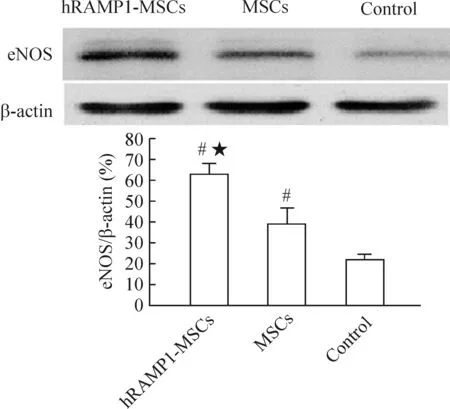
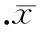
图7细胞移植后28d损伤血管eNOS蛋白的表达
7血清VEGF水平的检测
细胞移植后7 d、14 d和28 d,hRAMP1-MSCs组和MSCs组血清VEGF水平均显著高于对照组,尤以hRAMP1-MSCs 组更为显著(P<0.05),见表1。
讨 论
目前,经皮冠状动脉介入治疗(percutaneous interventional therapy, PCI) 是治疗心肌梗死的主要手段。但是,PCI术后再狭窄却成为阻碍其远期疗效的关键。基础研究认为,再狭窄主要与PCI手术过程中对病变血管的机械损伤,导致损伤动脉内皮修复减弱或者内皮功能丧失,因而引起中膜平滑肌细胞向内膜下迁移和增殖并形成新生内膜有关。所以行PCI同时促进损伤血管早期快速再内皮化是防止再狭窄的关键。本课题组先前的研究[6]及其它研究[7]均显示,单纯的MSCs移植可以通过自身分化为内皮细胞或旁分泌机制促进损伤动脉的内皮化修复,改善内皮功能,降低再狭窄的风险,但作用有限。近年来许多研究显示通过基因修饰MSCs可以增强MSCs的功能,这些基因包括血管生成素[8]、血管内皮生长因子[9]、CCX4[10]、前列腺素Ⅰ合酶[11]等,总体结果显示其可以增强MSCs的生存能力、迁移能力,显著改善心肌梗死后心肌重构和心功能。但这些研究鲜有关注基因修饰的MSCs对心肌梗死罪犯血管和粥样硬化动脉的内皮修复和内皮功能的影响。
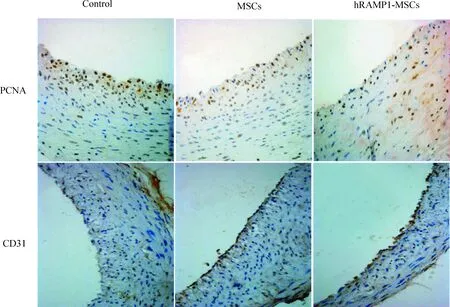
Figure 8. The expression of PCNA and CD31 in the injuried blood vessel 28 d after MSCs transplantation (×200).
图8细胞移植后28d损伤血管PCNA和CD31的表达
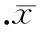
图9细胞移植后7d、14d和28d损伤血管内膜的内皮化程度
表1细胞移植后不同时点各组血清VEGF水平

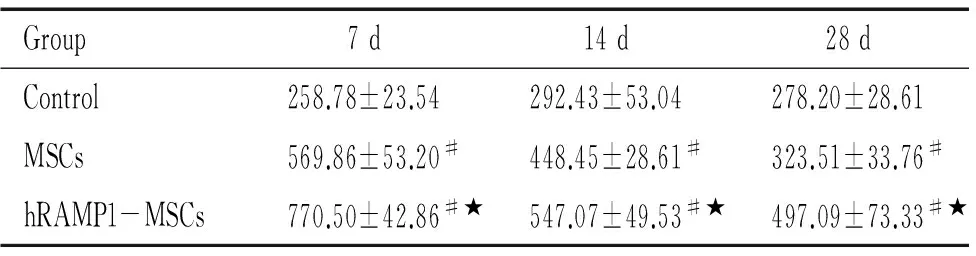
Group7d14d28dControl258.78±23.54292.43±53.04278.20±28.61MSCs569.86±53.20#448.45±28.61#323.51±33.76#hRAMP1-MSCs770.50±42.86#★547.07±49.53#★497.09±73.33#★
#P<0.05vscontrol group;★P<0.05vsMSCs group.
RAMP1是CGRP的受体活性亚单位之一,决定着该受体活性水平。CGRP通过RAMP1激活受体后,发挥血管舒张和调节内皮功能的作用。Mishima等[12]研究显示:增加CGRP效应性能促进大鼠缺血后肢体CD31和VEGF表达,改善缺血后肢血流灌注。Toda等[13]研究也显示:CGRP能调节VEGF生成,血管生成增加,促进肿瘤在动物体内快速生长。研究显示外源RAMP1转染增加CGRP效应性。因此本研究观察hRAMP1基因修饰的MSCs移植是否促进粥样硬化颈动脉球囊扩张术后内皮修复,以及其对内膜增殖的影响。结果发现,在颈动脉粥样硬化狭窄并球囊成形术的兔模型中,与单纯MSCs相比,hRAMP1基因修饰的MSCs移植治疗可以显著增加损伤颈动脉的CD31表达,这表明hRAMP1基因修饰的MSCs较单纯MSCs能进一步促进损伤动脉的再内 皮化修复;同时,血管形态学分析亦显示hRAMP1-MSCs移植后新生内膜形成显著降低,这对于降低血管成形术后再狭窄发生是至关重要的。进一步的组织免疫荧光检测发现,细胞移植后hRAMP1-MSCs组和MSCs组损伤动脉内膜中均有EGFP表达,但hRAMP1-MSCs组血管内皮细胞标志蛋白CD31表达率较MSCs组明显。这提示hRAMP1基因修饰的MSCs同样能迁移至损伤的血管内膜部位并更能促进损伤血管内皮的修复。最近的Chrissobolis等[14]研究结果显示,高表达RAMP1能增加CGRP诱导的脑血管舒张,对抗血管紧张素Ⅱ诱导的内皮功能失调,这提示hRAMP1本身的激活可能对内皮功能有益。因此,hRAMP1基因修饰的MSCs移植中,MSCs和hRAMP1两者均对损伤动脉内皮修复和/或内皮功能有益,不排除MSCs及RAMP1的直接或间接协同作用。
损伤动脉早期内皮化和恢复内皮功能对于抑制新生内膜形成具有重要的意义。动脉球囊成形术导致内皮剥脱,并使局部内皮功能丧失;早期快速内皮化和内皮功能恢复,可以阻断或抑制血管中膜平滑肌细胞的激活,使平滑肌细胞增殖和迁移水平降低,进而抑制新生内膜形成。本实验结果显示,MSCs组和hRAMP1-MSCs组的内皮型一氧化氮合成酶表达较对照组显著增加,提示移植细胞在促进损伤动脉修复过程中伴随内皮功能的恢复。同时,血浆VEGF水平增加,这可能与动脉损伤后血管内皮功能激活、移植MSCs旁分泌作用等有关,但VEGF水平增加可以有利于内皮细胞增殖和再生,进而促进损伤动脉内皮化。此外,本研究还观察到在hRAMP1-MSCs组中,血管新生内膜厚度显著降低,且伴随着CD31高表达以及代表细胞增殖水平的PCNA阳性率亦显著降低,这可能是移植hRAMP1-MSCs通过促进损伤动脉的快速内皮化和内皮功能恢复,显著抑制了与动脉损伤相关的VSMCs增殖的结果,最终导致新生内膜生成减少。
总之,本研究在颈动脉粥样硬化狭窄并球囊血管成形术后,移植hRAMP1基因修饰的MSCs通过促进损伤动脉内皮化,进而抑制新生内膜形成,这对临床再狭窄的防治提供有益的借鉴和指导作用。
[1] 郭 艳, 石 蓓, 王正龙, 等. 外周血间充质干细胞移植对球囊损伤兔血管平滑肌细胞凋亡的影响[J]. 中国生物医学工程学报,2010,29(2): 288-294.
[2] Brain SD, Grant AD. Vascular actions of calcitonin gene-related peptide and adrenomedullin[J]. Physiol Rev,2004,84(3): 903-934.
[3] Haegerstrand A, Dalsgaard CJ, Jonzon B, et al. Calcitonin gene-related peptide stimulates proliferation of human endothelial cells[J]. Proc Natl Acad Sci U S A,1990,87(9): 3299-3303.
[4] Zhang Z, Dickerson IM, Russo AF. Calcitonin gene-related peptide receptor activation by receptor activity-modifying protein-1 gene transfer to vascular smooth muscle cells[J]. Endocrinology,2006,147(4): 1932-1940.
[5] 沈长银, 石 蓓, 赵然尊, 等. 兔颈动脉粥样硬化狭窄动物模型的制备[J]. 四川大学学报(医学版),2009,40(5): 923-926.
[6] 许官学, 赵然尊, 石 蓓, 等. 间充质干细胞移植对兔颈动脉损伤后的内皮修复作用研究[J]. 重庆医科大学学报,2010,35(4): 530-534.
[7] Forte A, Finicelli M, Mattia M, et al. Mesenchymal stem cells effectively reduce surgically induced stenosis in rat carotids[J]. J Cell Physiol,2008,217(3):789-799.
[8] Ryu JK, Cho CH, Shin HY, et al. Combined angiopoietin-1 and vascular endothelial growth factor gene transfer restores cavernous angiogenesis and erectile function in a rat model of hypercholesterolemia[J]. Mol Ther,2006,13(4): 705-715.
[9] Samuel SM, Akita Y, Paul D, et al. Coadministration of adenoviral vascular endothelial growth factor and angiopoietin-1 enhances vascularization and reduces ventricular remodeling in the infarcted myocardium of type 1 diabetic rats[J]. Diabetes,2010,59(1): 51-60.
[10]Cheng Z, Ou L, Zhou X, et al. Targeted migration of mesenchymal stem cells modified with CXCR4 gene to infarcted myocardium improves cardiac performance[J]. Mol Ther,2008,16(3): 571-579.
[11]Lian WS, Cheng WT, Cheng CC, et al.Invivotherapy of myocardial infarction with mesenchymal stem cells modified with prostaglandin I synthase gene improves cardiac performance in mice[J]. Life Sci, 2011, 88(9-10):455-464.
[12]Mishima T, Ito Y, Hosono K, et al. Calcitonin gene-related peptide facilitates revascularization during hindlimb ischemia in mice[J]. Am J Physiol Heart Circ Physiol,2011,300(2):H431-H439.
[13]Toda M, Suzuki T, Hosono K, et al. Neuronal system-dependent facilitation of tumor angiogenesis and tumor growth by calcitonin gene-related peptide[J]. Proc Natl Acad Sci U S A,2008,105(36): 13550-13555.
[14]Chrissobolis S, Zhang Z, Kinzenbaw DA, et al. Receptor activity-modifying protein-1 augments cerebrovascular responses to calcitonin gene-related peptide and inhibits angiotensin II-induced vascular dysfunction[J]. Stroke,2010,41(10): 2329-2334.
EffectoftransplantationofhRAMP1gene-modifiedbonemarrowMSCsonpostangioplastyneointimaformationinrabbits
LONG Xian-ping, ZHAO Ran-zun, SHI Bei, XU Guan-xue
(DepartmentofCardiology,TheFirstAffiliatedHospital,ZunyiMedicalCollege,Zunyi563003,China.E-mail:shibei2147@163.com)
AIM: To explore the effect of transplantation of human receptor activity-modifying protein 1 (hRAMP1) gene-modified bone marrow mesenchymal stem cells (MSCs) on neointima formation after carotid balloon angioplasty in carotid atherosclerosis rabbits.METHODSMSCs were collected through density gradient centrifugation and adherent culture. MSCs were transfected with adenovirus vector carryinghRAMP1 gene to generatehRAMP1 gene-modified MSCs (hRAMP1-MSCs). All animals with carotid atherosclerosis and balloon angioplasty were randomly divided into hRAMP-MSCs group, MSCs group and control group. After the model was established, MSCs transfected with pAd2-EGFP-hRAMP1 or pAd2-EGFP and PBS were injected to the ear vein,respectively. The injured carotid arteries were harvested to detect the homing of MSCs,reendothelialization and neointima thickness 7 d, 14 d and 28 d after cell transplantation. The plasma samples were collected for detecting vascular endothelial growth factor (VEGF) by ELISA. The expression of endothelial nitric oxide synthase (eNOS) in injured carotid arteries was measured by Western blotting.RESULTSThe expression of CD31 and EGFP was observed in the neointima at different time points in hRAMP1-MSCs group and MSCs group. Compared to control group, the reendothelialization of carotid significantly increased in both hRAMP1-MSCs group and MSCs group at different time points (P<0.05), and that in hRAMP1-MSCs group showed better than that in MSCs group (P<0.05). The area of neointima and the rate of restenosis were lower in hRAMP1-MSCs group and MSCs group than those in control group, and those in hRAMP1-MSCs group were significantly lower than those in MSCs group. The plasma level of VEGF and the expression of eNOS in the injured carotid arteries were significantly higher in both hRAMP1-MSCs group and MSCs group than those in control group at different time points (P<0.05), and those in hRAMP1-MSCs group were better than those in MSCs group (P<0.05). In the injured carotid arteries, the expression level of proliferating cell nuclear antigen (PCNA) in hRAMP1-MSCs group was the lowest,with the middle level in MSCs group and the highest level in control group.CONCLUSIONThehRAMP1 gene-modified MSCs are better in promoting reendothelialization and attenuating neointima than natural MSCs. The recombinanthRAMP1 adenovirus vectors don’t affect the differentiation potential of MSCs into endothelial cells.These findings indicate that the modified stem cells have the potency of more effective reendothelialization to decrease restenosis after angioplasty.
Receptor activity-modifying protein 1; Mesenchymal stem cells; Neointima; Reendothelialization; Angioplasty
R543.5
A
10.3969/j.issn.1000-4718.2012.04.017

