CGRP通过抑制TNF-α介导单磷酰脂A对大鼠小肠的预适应延迟保护作用*
杨彩红, 张轩萍, 梁月琴, 李 焰, 郝一彬
(山西医科大学1药理教研室,2机能实验室,山西 太原 030001)
1000-4718(2012)04-0669-06
2011-10-21
2012-02-13
山西医科大学博士启动基金资助项目(No.03201102)
△通讯作者 Tel: 0351-4135079; E-mail: tyyangxiaoluo@163.com
CGRP通过抑制TNF-α介导单磷酰脂A对大鼠小肠的预适应延迟保护作用*
杨彩红1△, 张轩萍1, 梁月琴2, 李 焰2, 郝一彬1
(山西医科大学1药理教研室,2机能实验室,山西 太原 030001)
目的探讨降钙素基因相关肽(CGRP)介导的单磷酰脂A(MLA)对大鼠小肠的预适应延迟保护作用是否通过抑制肿瘤坏死因子α(TNF-α)而产生。方法通过给予MLA(500 μg·kg-1,ip)药物预适应,利用在体缺血再灌注(I/R)和原位灌流模型,检测外周血、灌流液和组织中乳酸脱氢酶(LDH)活性、丙二醛(MDA)含量和组织形态学改变以显示缺血再灌注损伤和药物的作用;通过放射免疫法测定血浆中CGRP和TNF-α含量探讨MLA预适应对大鼠小肠保护作用的机制。结果与I/R组相比,给予MLA后可使I/R组LDH活性和MDA含量明显降低(P<0.05);同时MLA使I/R损伤大鼠CGRP含量显著升高,TNF-α含量下降(P<0.01)。使用CGRP拮抗剂CGRP8-37及辣椒素(capsaicin)耗竭CGRP后,均可消除MLA的这一作用。结论MLA对在体、原位灌流大鼠小肠均诱导产生预适应的延迟保护作用;CGRP可能通过抑制TNF-α的产生而介导MLA诱导的预适应延迟保护作用。
单磷酰脂A; 降钙素基因相关肽; 肿瘤坏死因子
预适应是对抗缺血再灌注(ischemia/reperfusion,I/R)损伤的一种最有效手段,有早期保护和延迟保护2个不同时相的作用。延迟预适应(delayed preconditioning)的保护作用需经过10多个小时才明显形成,并能维持几天甚至更长时间。预适应的保护作用不仅发生在心脏,也出现在心外组织[1],本课题组早期的研究工作均表明小肠也存在预适应保护作用,而且表明其保护机制与KATP通道开放及内源性阿片肽的释放有关[2-3]。
单磷酰脂A(monophosphoryl lipid A, MLA)是从细菌脂多糖中提取纯化的一种内毒素的无毒衍生物。MLA预处理对动物在体心脏与离体心脏均能诱导产生延迟保护作用,显著缩小心肌梗塞面积和改善心功能,其效果明确,毒副作用小,具有广泛的临床应用前景[4]。但其产生预适应保护作用的机制还不清楚,有研究结果表明,其预适应保护作用可能是通过刺激降钙素基因相关肽(calcitonin gene-related peptide, CGRP)的释放诱导产生的[5-6]。
肿瘤坏死因子α(tumor necrosis factor α, TNF-α)、白细胞介素-6等细胞因子已确认参与介导缺血再灌注中的组织损伤。其中,TNF-α是缺血再灌注损伤中细胞因子连续反应中的一个关键性介质[7]。已有研究证明TNF-α在心脏、小肠缺血再灌注时均明显升高,使用TNF-α单克隆抗体后能明显减轻再灌注引起的器官损伤,改善组织器官功能,减轻机体的全身性损害,而CGRP含量升高则可明显减轻再灌注损伤,CGRP抗体使用后可逆转这一保护作用[8-9]。但TNF-α与CGRP在预适应中的地位和作用尚不十分清楚,本实验采用MLA预适应给药,利用大鼠小肠缺血再灌注模型,初步探讨TNF-α与CGRP在MLA预适应中的作用及意义。
材 料 和 方 法
1试剂
MLA购自Sigma;乳酸脱氢酶(lactate dehydrogenase,LDH)和丙二醛(malondialdehyde,MDA)试剂盒均购自南京建成生物工程研究所;CGRP和TNF-α放免试剂盒由解放军总医院科技开发放免所提供;其余试剂均为国产分析纯。
2方法
2.1动物模型制备 健康Wistar雄性大鼠,体重(260±30) g,由山西医科大学动物实验中心提供。
2.1.1在体动物缺血再灌注模型制备 大鼠术前24 h禁食,自由饮水。以20%乌拉坦1 g·kg-1腹腔注射麻醉,舌静脉注射肝素600 U·kg-1抗凝血。分离颈总动脉连接动脉血压计,记录动脉血压以监测动物在实验中的状态。在动物腹部实行中线切口,分离肠系膜上动脉(superior mesenteric artery,SMA)。术后稳定20 min,用无创伤动脉夹夹闭SMA 30 min,再灌注60 min,制成缺血再灌注模型。
2.1.2原位灌流模型制备 参照文献[10]方法在动物腹部实行中线切口,分离SMA及肠系膜上静脉,由SMA主干插管,连蠕动泵持续恒流(6 mL·min-1)灌注。灌注液为37 ℃,经95% O2和5% CO2平衡的K-H改良液,肠系膜上静脉插管导出液体。灌流开始后,腹主动脉放血处死动物。所有暴露的组织均置于塑料泡沫板上,并用盐水浸泡的纱布敷盖。用热照法使整个灌流过程的温度维持在(37.0±0.5) ℃,预灌注30 min后,开始实验。
2.2实验分组
2.2.1在体实验动物分组 实验动物随机分为4组,每组8只:(1)对照组(control):仅分离SMA,不夹闭,观察90 min;(2)缺血再灌注组(I/R):分离SMA,夹闭30 min,再灌注60 min,结束实验;(3)MLA预适应组(MLA):实验前24 h给予MLA (500 μg·kg-1, ip),其后操作同I/R组;(4)MLA溶剂组(MLA vehicle):实验前24 h给予同体积MLA溶剂(40%丙二醇、10%乙醇及50%生理盐水,ip),其后操作同I/R组。
2.2.2原位灌流实验动物分组 实验动物随机分为6组,每组6~8只:(1)对照组(control):持续灌流75 min,结束实验;(2)缺血再灌注组(I/R):停灌1 h后再灌注15 min,结束实验;(3)MLA预适应组(MLA):实验前24 h给予MLA (500 μg·kg-1,ip),余同I/R组;(4)MLA溶剂组(MLA vehicle):实验前24 h给予同体积MLA溶剂,余同I/R组;(5)辣椒素(capsaicin)+MLA组:戊巴比妥钠麻醉后,连续4 d注射capsaicin(50 mg·kg-1·d-1, sc)耗竭CGRP,余同MLA组;(6)CGRP8-37+MLA组:实验前24 h给予MLA (500 μg·kg-1, ip),实验时用浓度为10-7mol·L-1的CGRP8-37灌流5 min,随后操作同I/R组。
2.3标本采集及处理
2.3.1血清LDH活性的测定 实验结束时,腹主动脉取血4 ℃ 3 000 r/min离心10 min,取上清,按试剂盒方法测定。
2.3.2血浆CGRP测定 同上取血3 mL,加入备有10%乙二胺四乙酸钠30 μL和400 U·L-1抑肽酶的试管中,4 000 r/min离心20 min(4 ℃),取上清,-20 ℃保存备用。按试剂盒方法测定。
2.3.3血浆TNF-α的测定 同上取血,加入备有10%乙二胺四乙酸钠的试管中,3 000 r/min离心10 min(4 ℃),取上清,-20 ℃保存备用。按试剂盒方法测定。
2.3.4在体组织形态学分析 取回盲部以上10 cm的小肠组织,迅速置于中性甲醛液中固定,石蜡包埋,HE染色光镜下观察形态学改变。按文献分级方法[10]观察小肠黏膜出血的病理损伤:0°:无出血;Ⅰ°:散在点状出血;Ⅱ°:大段出血占1/4肠段(从十二指肠到回肠);Ⅲ°:50%以上肠段出血;Ⅳ°:几乎全部小肠段出血。
2.3.5小肠组织MDA含量测定 取回盲部以上10 cm处小肠组织,加其9倍体积生理盐水,用电动匀浆器制成10%组织匀浆,3 000 r/min离心10 min,取上清,按试剂盒方法测定。
2.3.6灌流液LDH活性、TNF-α和CGRP含量测定 收集再灌后5 min的灌流液,分别4 ℃和-20 ℃密封保存,按试剂盒方法测定。
2.3.7原位灌流组织形态学分析 同上取小肠组织,迅速置于中性甲醛液中固定,石蜡包埋,HE染色光镜下观察形态学改变。参照文献分级方法[10],根据小肠组织损伤的程度,将其分为0~Ⅷ级:0级为正常的小肠黏膜;Ⅰ级病理损伤为绒毛端上皮下空间的增大;Ⅱ级为这种空间的进一步扩大;Ⅲ级则有大量的上皮在绒毛边缘起伏;Ⅳ级有绒毛上皮的剥落;Ⅴ级有绒毛自身的脱落;Ⅵ级发展到小肠隐窝层的损伤;Ⅶ级为整个小肠黏膜的坏死;Ⅷ级则有穿透性的梗死。
3统计学处理
结 果
1在体实验结果
结果显示,I/R可使小肠黏膜明显损伤,LDH和MDA水平显著升高,与对照组比较差异显著(P<0.01);MLA则可明显改善小肠黏膜的I/R损伤,同时使LDH和MDA水平显著降低(P<0.05),见图1及表1、2。
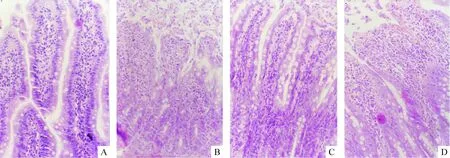
Figure 1. Representative example of small intestine mucosal hemorrhage frominvivoexperiment(HE staining,×200).A:control;B:I/R;C:MLA;D:MLA vehicle.
图1MLA预处理对在体大鼠小肠病理改变的作用
表1单磷酰脂A预处理对缺血再灌注损伤大鼠小肠病理改变的保护作用


GroupHemorrhagicdegreeofmucosa0ⅠⅡⅢⅣMeangradeControl620000.25I/R002333.13**MLA043101.63#MLAvehicle001243.43**
**P<0.01vscontrol;#P<0.05vsI/R.
I/R使大鼠血浆中TNF-α水平显著升高,与对照组比较差异显著(P<0.01);MLA预适应则使血浆中TNF-α含量降低,与I/R组相比有显著差异(P<0.01)。血浆CGRP结果显示,I/R使血浆CGRP水平显著降低,MLA预适应则使I/R损伤大鼠血浆CGRP显著回升,与I/R组相比差异显著(P<0.01),见表2。
2原位灌流实验结果
2.1灌注液中LDH活性和组织中MDA含量的变化 I/R使灌流液中LDH和组织中MDA与对照组相比显著增加(P<0.01);而MLA预适应可显著降低I/R引起的LDH、MDA增加,使灌流液中LDH和组织中MDA下降(P<0.01)。但给予CGRP8-37及capsaicin后,则逆转MLA的上述作用,使LDH和MDA水平又重新回升,与I/R组比较无显著差异(P>0.05),见表3。
表2单磷酰脂A预处理对缺血再灌注大鼠血清LDH活性、血浆CGRP和TNF-α含量及小肠MDA含量的影响


GroupnLDH(U·L-1)MDA(μmol·g-1protein)TNF-α(μg·L-1)CGRP(ng·L-1)Control8300.80±20.521.04±0.270.94±0.1656.60±5.44I/R81014.82±141.19**2.69±0.52**1.54±0.44**43.55±2.70*MLA8472.17±36.71##1.34±0.45##1.01±0.20##85.49±11.26**##MLAvehi-cle7862.35±30.61**3.15±0.86**1.47±0.37**40.29±6.30**
*P<0.05,**P<0.01vscontrol;##P<0.01vsI/R.
表3单磷酰脂A预处理对原位灌流大鼠小肠灌流液中LDH活性、CGRP和TNF-α含量及小肠组织中MDA含量的影响


GroupnLDH(U·L-1)MDA(μmol·g-1protein)TNF-α(μg·L-1)CGRP(ng·L-1)Control8435.86±91.181.60±0.870.36±0.12135.32±45.37I/R8871.71±187.12**4.28±1.35**1.12±0.12**73.68±27.50MLA8512.59±136.15##2.22±1.19#0.54±0.14#341.20±103.22*##CGRP8-37+MLA8729.41±283.84**4.20±2.58**1.17±0.20**175.73±44.51Capsaicin+MLA7866.11±214.99**4.15±1.20**1.12±0.21**44.67±10.14MLAvehicle8831.40±173.49**4.83±2.52**1.16±0.23**111.13±28.85
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsI/R.
2.2小肠组织形态变化 I/R可以引起小肠黏膜的严重损伤,平均分级由对照组的0.25升至7.00(P<0.01);MLA可显著降低损伤程度,与I/R组比较差异显著(P<0.05);给予CGRP8-37及capsaicin则可逆转MLA对大鼠小肠的保护作用,使损伤程度加重,与对照组比较差异显著(P<0.05),见图2、表4。
2.3灌流液中的CGRP和TNF-α含量的改变 MLA可显著刺激CGRP的释放,与I/R组比较有显著差异(P<0.01)。I/R使灌流液中TNF-α水平显著升高(P<0.01vs对照组),而MLA可使I/R损伤后灌流液中TNF-α降低,与I/R组相比差异显著(P<0.05)。但给予CGRP8-37及capsaicin后,则逆转MLA这一作用,灌流液中TNF-α水平又重新升高至I/R组水平,与对照组相比差异显著(P<0.01),见表3。
讨 论
近年发现CGRP对缺血心肌具有保护作用,但其机制目前还不清楚。在离体大鼠心脏和心脏外器官的缺血预适应发现,CGRP是一种内源性保护物质,可能是预适应保护作用中的共同介质[11-12], 研究表明,MLA介导的心脏预适应延迟保护作用与CGRP的大量产生有关,而capsaicin可消除MLA的预适应保护作用[13],说明CGRP参与介导MLA的心肌预适应延迟保护作用。本实验结果证实,实验前24 h给予大鼠MLA(500 μg·kg-1, ip)后,与I/R组比较,发现MLA可以明显地降低LDH、MDA的释放,显著抑制I/R引起的小肠黏膜损伤,减轻小肠水肿。给予10-7mol·L-1CGRP受体阻断剂CGRP8-37,及CGRP耗竭剂capsaicin(50 mg·kg-1, sc)后,则可显著扭转MLA的保护作用。证明MLA可诱导大鼠小肠产生预适应延迟保护作用,CGRP参与并介导了这一过程。
TNF是一种具有广泛生物活性的多功能细胞因子,主要由被激活的巨噬细胞或单核细胞产生,具有防御和致损伤的双重作用。在体内适量产生TNF,对机体具有重要的免疫调节和保护作用;随着TNF在体内浓度的持续增加,则参与机体的多种病理改变,甚至造成多器官损伤[14]。缺血再灌注导致TNF-α含量的大量增加,且对抗缺血再灌损伤的缺血预适应与抑制或阻断TNF-α产生有关[8],提示TNF-α可能是缺血预适应信号转导通路中的一个刺激因子。研究表明缺血预适应和CGRP预适应均可抑制TNF-α的产生,而CGRP8-37和capsaicin可以消除缺血预适应或CGRP预适应对TNF-α的抑制作用[8],表明CGRP介导的预适应保护作用可能同抑制TNF-α的产生有关。本实验结果同样证实,MLA预适应可以抑制伴随缺血再灌损伤产生的TNF-α的增加;CGRP8-37或capsaicin可消除MLA预适应对TNF-α的抑制作用。有研究证明TNF-α在缺血再灌注损伤中还可诱导激活一氧化氮合酶(nitric oxide synthase,NOS),使NO合成增加[15],而NO已经被证明为心肌早期缺血预适应保护作用的诱发物质之一。MLA可通过增加NO的释放和合成刺激CGRP的释放从而产生预适应的延迟保护作用,而给予CGRP8-37或用capsaicin耗竭CGRP后,其保护作用消失[5]。CGRP促进内皮细胞分泌NO的作用与其增加内皮细胞内游离Ca2+水平可能有密切关系。NOS为钙依赖性激酶,CGRP升高细胞内游离Ca2+,在钙调素的辅助作用下激活细胞内NOS,促使大量L-精氨酸转变为NO,从而发挥生物学效应[16]。由此,我们或可推测MLA对大鼠小肠预适应保护作用的产生原因可能是:(1)MLA诱导CGRP生成增加,同时TNF-α作为缺血再灌注损伤的诱导因子,使NO合成增加,进而刺激CGRP的产生,并伴同CGRP介导预适应保护作用;(2)CGRP产生后一方面抑制TNF-α的继续增加,阻止其对机体组织器官的致损伤作用,另一方面进一步促进CGRP的增加,而产生对大鼠小肠的预适应保护作用。有关CGRP通过抑制TNF-α产生预适应保护作用的机理目前还不清楚,上述假设还需进一步验证才可证实。
Figure 2. Repersentative examples of small intestine mucosal injury frominvitroexperiment(HE staining,×100).A:control;B:I/R;C:MLA;D:MLA vehicle;E:capsaicin+MLA;F:CGRP8-37+MLA.
图2MLA预处理对大鼠原位灌流小肠病理改变的作用

表4 单磷酰脂A预处理对原位灌流大鼠小肠病理改变的保护作用
**P<0.01vscontrol;##P<0.01vsI/R.
[1] 徐夏莲, 蒋素华, 许迅辉, 等. 晚期缺血预适应促进低氧诱导因子的表达,减轻肾脏缺血再灌注损伤[J]. 中国病理生理杂志, 2011, 27(2):320-325.
[2] Yang SP, Hao YB, Wu YX, et al. Ischemic preconditioning mediated by activation of KATPchannels in rat small intestine[J]. Acta Pharmacol Sin, 1999, 20(4):341-344.
[3] Zhang Y, Wu YX, Hao YB, et al. Role of endogenous opioid peptides in protection of ischemic preconditioning in rat small intestine[J]. Life Sci, 2001, 68(9):1013-1019.
[4] Xi L. Nitric oxide-dependent mechanism of anti-ischemic myocardial protection induced by monophosphoryl lipid A[J]. Acta Pharmacol Sin, 1999, 20(10):865-871.
[5] He SY, Deng HW, Li YJ. Monophosphoryl lipid A-induced delayed preconditioning is mediated by calcitonin gene-related peptide[J]. Eur J Pharmacol, 2001, 420(2-3):143-149.
[6] Yang CH, Zhang MS, Li J, et al. Monophosphoryl lipid A-induced delayed preconditioning in rat small intestine is mediated by calcitonin gene-related peptide[J]. Dig Dis Sci, 2011, 56(5):1333-1341.
[7] Meldrum DR, Dinarello CA, Shames BD, et al. Ischemic preconditioning decreases postischemic myocardial tumor necrosis factor-alpha production. Potential ultimate effector mechanism of preconditioning[J]. Circulation, 1998, 98(19 Suppl):Ⅱ214-Ⅱ218; discussion Ⅱ218-Ⅱ219.
[8] Peng J, Xiao J, Ye F, et al. Inhibition of cardiac tumor necrosis factor-alpha production by calcitonin gene-related peptide-mediated ischemic preconditioning in isolated rat hearts [J]. Eur J Pharmacol, 2000, 407(3):303-308.
[9] Meng X, Ao L, Meldrum DR, et al. TNF-α and myocardial depression in endotoxemic rats: temporal discordance of an obligatory relationship[J]. Am J Physiol, 1998, 275(2 Pt 2):R502-R508.
[10]Dun Y, Hao YB, Wu YX, et al. Protective effects of nitroglycerin-induced preconditioning mediated by calcitonin gene-related peptide in rat small intestine[J]. Eur J Pharmacol,2001,430(2-3):317-324.
[11]Xiao ZS, Li YJ, Deng HW. Ischemic preconditioning mediated by calcitonin gene-related peptide in isolated rat hearts[J]. Acta Pharmacol Sin,1996,17(5):445-448.
[12]Zhou FW, Li YJ, Deng HW. Mediation of calcitonin gene-related peptide in protection of ischemic preconditioning in rat hindlimbs[J]. Acta Pharmacol Sin,1998,19(5):477-480.
[13]Peng J, Lu R, Deng HW, et al. Involvement of alpha-calcitonin gene-related peptide in monophosphoryl lipid A-induced delayed preconditioning in rat hearts[J]. Eur J Pharmacol,2002,436(1-2):89-96.
[14]徐西振, 李 耕, 冯文静, 等. 银杏叶提取物对TNF-α诱导的牛主动脉内皮细胞血凝素样氧化低密度脂蛋白受体表达的影响及其机制[J]. 中国病理生理杂志, 2010, 26(12): 2316-2320.
[15]刘安民, 刘 军, 蔡望青, 等. 雌激素对自发性高血压大鼠颅内动脉血管壁TNF-α和MMP-9表达的影响[J]. 中国病理生理杂志, 2011, 27(9):1731-1735.
[16]Struthers AD, Brown M J, Macdonald DW, et al. Human calcitonin gene related peptide: a potent endogenous vasodilator in man[J]. Clin Sci (Lond), 1986, 70(4):389-393.
Calcitoningene-relatedpeptidemediatesdelayedpreconditioningofmonophosphoryllipidAbydecreasingtumornecrosisfactorαinratsmallintestine
YANG Cai-hong1, ZHANG Xuan-ping1, LIANG Yue-qin2, LI Yan2, HAO Yi-bin1
(1DepartmentofPharmacology,2FunctionalLaboratory,ShanxiMedicalUniversity,Taiyuan030001,China.E-mail:tyyangxiaoluo@163.com)
AIM: To explore whether monophosphoryl lipid A participates in the protective process of the delayed ischemic preconditioning in the small intestine of rats, and whether endogenous calcitonin gene-related peptide and tumor necrosis factor α are mediators in this process.METHODSIntestinal ischemia was induced by occlusion of super mesenteric artery for 30 min, followed by reperfusion for 60 min. The ischemia/reperfusion(I/R) injury was made by 1 h ischemia and 15 min reperfusioninsituperfusion in rat small intestine. The intestine lesions were evaluated by the measurement of serum lactate dehydrogenase and malondialdehyde in the small intestinal tissues. In addition, calcitonin gene-related peptide and tumor necrosis factor α in plasma and superior mesenteric vein effluent were also examined.RESULTSPretreatment with monophosphoryl lipid A (500 μg/kg, ip) 24 h prior to I/R significantly alleviated the histolo-gical lesions of intestinal tissues, decreased serum level of lactate dehydrogenase and reduced the tissue content of malondialdehyde. Moreover, monophosphoryl lipid A markedly increased plasma concentrations of calcitonin gene-related peptide and decreased plasma concentrations of tumor necrosis factor α. Pretreatment with capasicin, which specifically depletes the neurotransmitter content of sensory nerves, or calcitonin gene-related peptide (8-37), a selective calcitonin gene-related peptide receptor antagonist, inhibited the increase in calcitonin gene-related peptide release and subsequently abrogated the protective effect of monophosphoryl lipid A.CONCLUSIONMonophosphoryl lipid A pharmacologically mimics delayed preconditioning, which may be related to the stimulation of calcitonin gene-related peptide release and inhibition of tumor necrosis factor α production in rat small intestine.
Monophosphoryl lipid A; Calcitonin gene-related peptide; Tumor necrosis factor
R363
A
10.3969/j.issn.1000-4718.2012.04.016

