小檗碱和育亨宾对内毒素血症小鼠脾脏TLR4信号通路中相关基因表达的影响*
李 辉, 王一阳, 李红梅, 王发强, 吕秀秀, 戚仁斌, 陆大祥, 王彦平, 王华东△
(暨南大学 1附属第一医院耳鼻咽喉科,2医学院病理生理学系,国家中医药管理局病理生理三级科研实验室, 广东 广州 510632)
1000-4718(2012)04-0655-09
2011-12-12
2012-02-24
国家自然科学基金资助项目(No.30670826;No.30971191);教育部科学技术研究重点项目(No.207140);广东省科技计划项目(No.2008B030301352, 粤科计字[2008]144 号)
△通讯作者 Tel:020-85220253;E-mail:owanghd@jnu.edu.cn
小檗碱和育亨宾对内毒素血症小鼠脾脏TLR4信号通路中相关基因表达的影响*
李 辉1, 王一阳2, 李红梅2, 王发强2, 吕秀秀2, 戚仁斌2, 陆大祥2, 王彦平2, 王华东2△
(暨南大学1附属第一医院耳鼻咽喉科,2医学院病理生理学系,国家中医药管理局病理生理三级科研实验室, 广东 广州 510632)
目的观察小檗碱和α2肾上腺素能受体拮抗剂育亨宾对内毒素血症小鼠脾脏Toll样受体4(TLR4)信号通路84种基因表达的影响,并初步探讨其作用机制。方法雄性BALB/c小鼠随机分为对照组、脂多糖(LPS)组、小檗碱+LPS组、小檗碱+育亨宾+LPS组、育亨宾+LPS组、小檗碱组、小檗碱+育亨宾组和育亨宾组。分别用蒸馏水、小檗碱(50 mg/kg)、小檗碱+育亨宾(50 mg/kg+2 mg/kg) 和育亨宾(2 mg/kg)灌胃,每天1次,连续3 d,第3 d灌胃1 h后,腹腔注射LPS(20 mg/kg)或生理盐水。腹腔注射1 h后,用RT2ProfilerTMPCR Array分析技术检测小鼠脾脏TLR4信号通路84种基因mRNA的表达;用Western blotting分析小鼠脾脏TLR4信号通路的抑制分子细胞因子信号抑制物(SOCS)1、SOCS3和白细胞介素-1受体相关激酶(IRAK)-M蛋白的表达。结果LPS可上调小鼠脾脏TLR4信号转导通路中相关炎症因子的mRNA表达,包括CXCL10、TNF-α、IL-1α、IL-1β、IL-6、IFN-γ和IFN-β。小檗碱能显著下调下调髓样分化因子(MyD88)依赖信号通路下游TNF-α、IL-1α、IL-1β和IL-6 mRNA的表达,也能MyD88非依赖信号通路下游基因IFN-β和CXCL10 mRNA的表达(P<0.05)。育亨宾能显著下调内毒素血症小鼠脾脏IL-1α、IL-1β 和IFN-β mRNA的表达(P<0.05),但对TNF-α、IL-6和CXCL10 mRNA表达的下调作用与LPS组相比没有显著差异(P>0.05)。小檗碱与育亨宾合剂能显著下调内毒素血症小鼠脾脏IFN-β和CXCL10 mRNA的表达,但不能显著下调内毒素血症小鼠脾脏IL-1α、IL-1β、TNF-α 和IL-6 mRNA的表达。LPS攻击后1 h,小檗碱和(或)育亨宾均不能增强内毒素血症小鼠脾脏SOCS1、SOCS3和IRAK-M蛋白的表达。结论小檗碱和育亨宾均能抑制LPS诱导的MyD88依赖和非依赖信号通路下游部分基因的表达,这种抑制作用的机制与SOCS1、SOCS3和IRAK-M蛋白无关。
小檗碱; 育亨宾; 内毒素血症; Toll样受体4; 小鼠
内毒素或脂多糖(lipopolysaccharide, LPS)是革兰氏阴性细菌感染患者并发脓毒症的重要致病因子,LPS诱发的全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)在脓毒症的发生机制中发挥重要作用[1]。研究表明,缺乏LPS的突变细菌刺激机体巨噬细胞产生炎症细胞因子的能力显著降低[2];严重脓毒症患者血中LPS水平升高与休克的发生和预后不良密切相关[3]。显然,深入研究LPS诱发炎症反应的分子机制及其干预措施对脓毒症的治疗具有重要临床价值。
业已证明,Toll样受体(Toll-like receptors, TLRs)是机体免疫系统中最重要的病原体相关分子模式(pathogen-associated molecular pattern,PAMP)识别受体,LPS作为一种PAMP进入机体后激活TLR4, 通过细胞内髓样分化因子88(myeloid differentiation factor 88, MyD88)依赖的信号转导途径和非MyD88依赖的信号转导途径,激活核因子κB (nuclear factor κB, NF-κB)、信号转导子与转录激活子(signal transducers and activators of transcription, STAT)等转录因子,引起一系列炎症介质的释放。如:肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素(interleukin, IL)-1、IL-6、IL-12 p40、趋化因子C-X-C模序配体10(chemokine C-X-C motif ligand 10,CXCL10)、单核细胞诱导蛋白等。另一方面,机体内还存在多种下调TLR4信号通路的调节途径,包括细胞因子信号抑制物(suppressors of cytokine signaling,SOCS)、白细胞介素-1受体相关激酶 (IL-1 receptor-associated kinase,IRAK)-M等[4]。我们前期的研究发现,小檗碱(berberine, Ber)能明显降低内毒素血症小鼠的死亡率,明显抑制LPS诱导的TNF-α及IL-1β的生成,而且α2肾上腺素能受体拮抗剂育亨宾 (yohimbine, Y)可以增强Ber的抗内毒素血症作用,Y与Ber联合应用能显著提高脓毒症小鼠的生存率[5-6]。然而,Ber和Y对LPS活化TLR4信号通路的调节作用尚缺乏全面研究;Ber抑制LPS诱导的TNF-α及IL-1β的生成是否与SOCS-1、SOCS-3和IRAK-M有关,尚不清楚。因此,本研究利用RT2ProfilerTMPCR Array观察Ber和Y对内毒素血症小鼠脾脏TLR4信号通路中84种相关基因表达的影响,以及SOCS-1、SOCS-3和IRAK-M在这一过程中的作用,旨在进一步探讨Ber和Y调节内毒素血症小鼠炎症反应的分子机制。
材 料 和 方 法
1动物和实验药品
无特殊病原菌(specific pathogen free, SPF)雄性BALB/c小鼠,购自广东省实验动物中心(许可证号为 SCXK粤2008-0002),周龄6~8周,体重23~25 g。分笼饲养,自由饮水进食,实验前放置于实验环境中适应3 d,实验环境温度控制在(23±2)℃,相对湿度为50%~70%。小鼠的处置符合暨南大学医学院实验动物伦理委员会的相关管理规定。
LPS(O55∶B5)购自Sigma,实验时用生理盐水配制成实验所需浓度。中性硫酸、Ber和Y均购自Sigma,实验时用蒸馏水配制成实验所需浓度。
2RT2ProfilerTMPCRArray分析
2.1主要试剂 Trizol试剂购自Invitrogen;RT2ProfilerTMPCR Array Mouse Toll-Like Receptor Signaling Pathway (PAMM-018A)购自SuperArray Bioscience Corporation;氯仿(上海化学试剂有限公司),异丙醇(上海化学试剂有限公司),100%乙醇 (上海化学试剂有限公司);RNeasy® MinEluteTM纯化试剂盒(Qiagen),TE(10 mmol/L)、Tris-HCl、EDTA、溴化乙啶(ethidium bromide,EB) 购自华美生物工程公司(中国洛阳);乙酸钠、甲醛(上海化学试剂有限公司);SuperScript® III Reverse Transcriptase购自Invitrogen。
2.2实验分组 将小鼠随机分为5组,每组3只:(1)对照组(control):蒸馏水(10 mL/kg)灌胃,连续3 d,每天1次,第3 d蒸馏水灌胃后1 h,于腹腔注射0.9%生理盐水(20 mL/kg);(2)LPS组:蒸馏水(10 mL/kg)灌胃,连续3 d,每天1次,第3 d灌胃后1 h,腹腔注射20 mg/kg LPS (20 mL/kg);(3)Ber+LPS组:Ber 50 mg/kg(10 mL/kg)灌胃,连续3 d,每天1次,第3 d Ber灌胃后1 h,腹腔注射20 mg/kg LPS (20 mL/kg);(4)Ber+ Y +LPS组:2 mg/kg Y+50 mg/kg Ber(10 mL/kg)灌胃,连续3 d,每天1次,第3 d Ber和Y混合制剂灌胃后1 h,于腹腔注射20 mg/kg LPS (20 mL/kg);(5)Y +LPS组:Y 2 mg/kg(10 mL/kg)灌胃,连续灌胃3 d,每天1次,第3 d Y灌胃后1 h,于腹腔注射20 mg/kg 的LPS (20 mL/kg)。
2.3脾脏RNA抽提与实时荧光定量多聚酶链反应(real-time polymerase chain reaction, real-time PCR)分析 LPS或生理盐水注射1 h后,处死小鼠,迅速打开腹腔,取出50 mg脾脏组织,用冷生理盐水浸洗,然后用滤纸吸干液体。将脾脏置于匀浆器中,以1mL Trizol在冰面上充分匀浆,-80 ℃保存。用小鼠Toll样受体信号转导通路RT2ProfilerTMPCR芯片测定Toll样受体信号通路84种基因mRNA的表达:首先进行RNA分离、纯化后样品于30 ℃孵育5 min,以便核酸蛋白复合体完全解离。利用紫外吸收测定法,使用NanoDrop® ND-1000测定RNA浓度和纯度,所获得的RNA溶液A260/A280比值范围在1.8~2.1之间, 随后进行变性琼脂糖凝胶电泳;第二步取总RNA 1.5 μg反转录合成cDNA;最后进行real-time PCR及数据分析:在5 mL管中加入2× SuperArray PCR Master Mix 1 275 μL, 稀释的cDNA 102 μL, H2O 1 173 μL,充分混合。将25 μL混合液加入PCR Array对应的每个孔中,随后将 PCR Array置于实时定量PCR仪进行PCR反应。设置的程序如下: 95 ℃ 10 min, 95 ℃ 15 s, 60 ℃ 1 min, 40个循环。采用ΔΔCt方法分析数据,计算每个处理组中的每个基因的ΔCt。ΔCt(group 1) = average Ct - average housekeeping gene Ct for group 1 array,ΔCt (group 2) = average Ct - average housekeeping gene Ct for group 2 array。计算两组PCR Array中每个基因的ΔΔCt。ΔΔCt = ΔCt (group 2) - ΔCt (group 1),group 1为对照,group 2为实验组。通过2-ΔΔCt计算实验组与对照组对应基因的表达差异。
3Westernblotting分析
3.1试剂 细胞裂解液(RIPA)购自北京百泰克生物科技有限公司;SOCS1、SOCS3和IRAK-M多克隆抗体购自Cell Signaling Technology,3-磷酸甘油醛脱氢酶(glyceraldehyde 3-phosphate dehydrogenase, GAPDH)单克隆抗体购自Cell Signaling Technology;辣根过氧化物酶标记的山羊抗兔IgG购自北京鼎国昌盛生物技术有限责任公司;BCA法蛋白定量试剂盒购自上海申能博彩生物公司;脱脂奶粉、甘氨酸、β-巯基乙醇、吐温20(Tween 20)、丙烯酰胺、过硫酸胺、十二烷基硫酸钠(sodium dodecyl sulfate, SDS)、四甲基乙二胺(tetramethylethylene-diamine, TEMED)以及考马斯亮蓝R-250均购自Sigma;ECL发光液购自Pierce;硝酸纤维素膜(millipore)购自广州鲁诚生物科技有限公司。
3.2实验分组 将小鼠随机分为8组,每组6只:(1)对照组(control):蒸馏水(10 mL/kg)灌胃,连续3 d,每天1次,第3 d蒸馏水灌胃后1 h,于腹腔注射0.9%生理盐水(20 mL/kg);(2)LPS组(LPS):蒸馏水(10 mL/kg)灌胃,连续3 d,每天1次,第3 d蒸馏水灌胃后1 h,于腹腔注射20 mg/kg LPS (20 mL/kg);(3)Ber+LPS组:Ber 50 mg/kg(10 mL/kg)灌胃,连续3 d,每天1次,第3 d Ber灌胃后1 h,于腹腔注射20 mg/kg LPS (20 mL/kg);(4)Ber+ Y +LPS组:2 mg/kg Y+5 0 mg/kg Ber(10 mL/kg)灌胃,连续3d,每天1次,第3d混合制剂灌胃后1 h,于腹腔注射20 mg/kg LPS (20 mL/kg);(5)Y +LPS组:2 mg/kg Y (10 mL/kg)灌胃,连续3 d,每天1次,第3 d Y灌胃后1 h,于腹腔注射20 mg/kg LPS (20 mL/kg);(6)Ber组:Ber 50 mg/kg(10 mL/kg)灌胃,连续3 d,每天1次,第3 d Ber灌胃后1 h,于腹腔注射生理盐水(20 mL/kg);(7)Ber+Y组:2 mg/kg Y+50 mg /kg Ber(10 mL/kg)灌胃,连续3 d,每天1次,第3 d混合制剂灌胃后1 h,于腹腔注射生理盐水20 mL/kg;(8)Y组:Y 2 mg/kg(10 mL/kg)灌胃,连续3 d,每天1次,第3 d Y灌胃后1 h,于腹腔注射20 mL/kg生理盐水。
3.3Western blotting分析脾脏SOCS1、SOCS3和IRAK-M蛋白的含量 LPS或生理盐水注射后1 h,处死小鼠,迅速打开腹腔,取出脾脏,用冷生理盐水浸洗,然后用滤纸吸干液体。将脾脏置于匀浆器中,以1 mL细胞裂解液(RIPA)在冰面上充分匀浆,所得匀浆液13 000 ×g离心5 min,收集上清分装,BCA法测定蛋白浓度。按每个泳道孔加入80 μg蛋白样品进行12%丙烯酰胺SDS-PAGE蛋白垂直电泳,Bio-Rad半干转印仪15 V恒压转印15 min至硝酸纤维素膜上。TBST配制的5%脱脂奶粉室温封闭1 h,TBST洗膜,加1∶1 000稀释的 Ⅰ 抗溶液,4 ℃过夜。TBST洗膜,加1∶4 000稀释的辣根过氧化物酶标记 Ⅱ 抗溶液,室温孵育1 h。以GAPDH为内参照,加ECL发光剂,暗室中曝光X光片。用扫描仪扫描Western blotting 图像,并用BI2000图像分析系统分析各蛋白条带的积分吸光度值,以3种蛋白与GAPDH积分吸光度的比值表示SOCS1、SOCS3和IRAK-M蛋白的相对水平。
4统计学处理

结 果
1小檗碱和育亨宾对内毒素血症小鼠脾脏TLR4信号通路84种基因mRNA表达的影响
变性琼脂糖凝胶电泳结果显示,28S和18S RNA带亮而浓,还有一条tRNA和5S核糖体RNA组成的条带,见图1。代表性扩增曲线见图2。
Figure 1. Representative images of total RNA agarose gel electrophoresis. A: control; B1, B2, B3: LPS group; C1, C2, C3: Ber+LPS group; D1, D2, D3: Y+Ber+LPS group; E1, E2, E3: Y+LPS group.
图1RNA变性琼脂糖凝胶电泳图

Figure 2. The representative amplication curves of real-time PCR. A: control; B: LPS.
图2代表性real-timePCR扩增曲线
通过数据分析证实LPS注射1 h可上调小鼠脾脏TLR4信号转导通路中相关炎症细胞因子mRNA的表达,包括CXCL10、TNF-α、IL-1α、IL-1β、IL-6、IFN-γ和IFN-β,见表1。Ber处理能显著下调MyD88依赖信号通路下游TNF-α、IL-1α、IL-1β和IL-6 mRNA的表达,也能下调MyD88非依赖信号通路下游基因IFN-β和CXCL10 mRNA的表达(P<0.05)。Y能显著下调内毒素血症小鼠脾脏IL-1α、IL-1β 和IFN-β mRNA的表达(P<0.05),但对TNF-α、IL-6和CXCL10 mRNA的表达的下调作用与LPS组相比没有显著差异(P>0.05)。Ber+Y能显著下调内毒素血症小鼠脾脏IFN-β和 CXCL10 mRNA的表达,但不能显著下调内毒素血症小鼠脾脏IL-1α、IL-1β、TNF-α 和IL-6 mRNA的表达,见图3 。
表1LPS注射1h后小鼠脾脏TLR信号通路相关基因mRNA的表达变化


GenBankAccessionSymbolDescriptionFoldchangeNM_011333Ccl2Chemokine(C-Cmotif)ligand2528.113±146.670*NM_009841Cd14CD14antigen18.857±4.533*NM_009855Cd80CD80antigen5.697±0.851*NM_019388Cd86CD86antigen2.300±0.366*NM_009883CebpbCCAAT/enhancerbindingprotein(C/EBP),beta9.840±1.329*NM_019948Clec4eC-typelectindomainfamily4,membere26.427±7.737*NM_009969Csf2Colonystimulatingfactor2(granulocyte-macrophage)25.690±1.773*NM_009971Csf3Colonystimulatingfactor3(granulocyte)229.033±40.745*NM_021274Cxcl10Chemokine(C-X-Cmotif)ligand1031.777±12.847*NM_010234FosFBJosteosarcomaoncogene45.807±7.771*NM_010479Hspa1aHeatshockprotein1A15.023±3.633*NM_010510Ifnb1Interferonbeta1,fibroblast1594.510±520.734*NM_008337IfngInterferongamma3.280±0.711*NM_010548Il10Interleukin1033.397±10.111*NM_010554Il1aInterleukin1α92.013±22.328*NM_008361Il1bInterleukin1β39.163±6.409*NM_008366Il2Interleukin24.163±1.285*NM_031168Il6Interleukin6514.013±112.025*NM_172161Irak2Interleukin-1receptor-associatedkinase22.157±0.267*NM_008390Irf1Interferonregulatoryfactor12.537±0.248*NM_010591JunJunoncogene10.123±1.507*NM_019408Nfkb2NuclearfactorofkappalightpolypeptidegeneenhancerinB-cells2,p49/p1003.507±0.497*NM_010907NfkbiaNuclearfactorofkappalightchaingeneenhancerinB-cellsinhibitor,alpha7.927±0.421*NM_010908NfkbibNuclearfactorofkappalightchaingeneenhancerinB-cellsinhibitor,beta7.063±0.818*NM_011198Ptgs2Prostaglandin-endoperoxidesynthase2837.193±189.594*NM_009044RelReticuloendotheliosisoncogene2.960±0.227*NM_009045RelaV-relreticuloendotheliosisviraloncogenehomologA(avian)2.117±0.087*NM_011905Tlr2Toll-likereceptor26.937±1.323*NM_021297Tlr4Toll-likereceptor41.423±0.636NM_013693TnfTumornecrosisfactor23.287±6.136*NM_009397Tnfaip3Tumornecrosisfactoralpha-inducedprotein311.787±1.835*
*P<0.05vscontrol (data not shown).
2Ber和Y对内毒素血症小鼠脾脏SOCS1蛋白含量的影响
腹腔注射LPS 1 h后,小鼠脾脏SOCS1蛋白含量LPS组与对照组比较无显著差异 (P>0.05),Ber组、Ber+Y组以及Y组与LPS组比较亦无显著差异(P>0.05);Ber+Y组与Ber组比较无显著差异;腹腔注射生理盐水1 h后,小鼠脾脏SOCS1蛋白含量Ber组、Ber+Y组以及Y组与对照组比较无显著差异(P>0.05),见图4。
3Ber和Y对内毒素血症小鼠脾脏SOCS3蛋白含量的影响
腹腔注射LPS 1 h后,小鼠脾脏SOCS3蛋白含量的变化见图5。LPS组与对照组比较无显著差异(P>0.05),Ber组、Ber+Y组以及Y组与LPS组比较无显著差异(P>0.05);Ber+Y组与Ber组和Y组比较无显著差异(P>0.05)。
4Ber和Y对内毒素血症小鼠脾脏IRAK-M蛋白含量的影响
腹腔注射LPS后1h,小鼠脾脏IRAK-M蛋白含量变化见图6。LPS组与对照组比较无显著差异(P>0.05),Ber组、Ber+Y组以及Y组与LPS组比较无显著差异(P>0.05)。
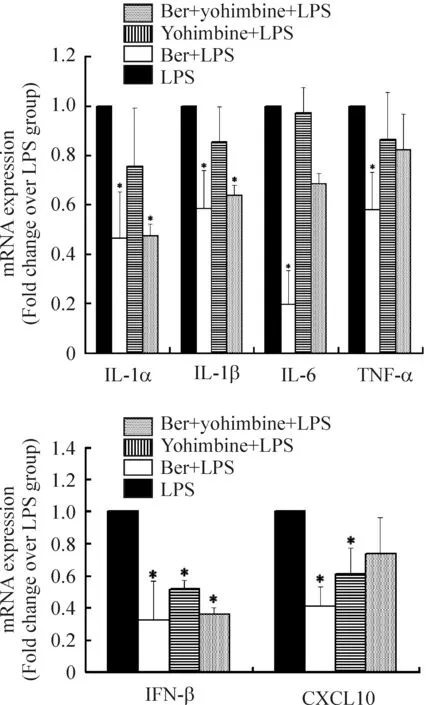

图3Ber和(或)Y对内毒素血症小鼠脾脏IL-1α、IL-1β、TNF-α、IL-6、IFN-β和CXCL10mRNA表达的影响
讨 论
RT2ProfilerTMPCR Array分析技术是96孔模式芯片,含有基因特异性引物,是一简单的、优化的实时定量PCR体系,可同时研究大量的基因表达。该技术的特点是灵敏度高、引物特异性强,均一性好,扩增效率强[7]。因此,在本研究中, 我们采用RT2ProfilerTMPCR Array分析技术,观察了腹腔注射内毒素1 h后,Ber和/或Y对小鼠脾脏TLR4信号通路中84种基因mRNA表达的影响。结果表明,Ber预处理能显著下调MyD88依赖信号通路下游TNF-α、IL-1α、IL-1β和IL-6 mRNA的表达,也能下调MyD88非依赖信号通路下游基因IFN-β和IP-10 mRNA的表达;Y能显著下调内毒素血症小鼠脾脏IL-1α、IL-1β 和IFN-β mRNA的表达。这些结果说明,Ber和Y对LPS激活的MyD88依赖和MyD88非依赖信号通路下游的某些基因表达均有抑制作用。
先前的研究表明,Ber能抑制LPS诱导的NF-κB的活化,从而抑制MyD88依赖信号通路相关基因的表达[8-11]。 Y阻断α2肾上腺素能受体能显著抑制内毒素血症小鼠血浆TNF-α水平的升高[12], 进一步研究发现,LPS攻击机体时血中去甲肾上腺素(norepinephrine, NE)水平升高,NE增强LPS诱导的Kupffer细胞p38 丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase, p38 MAPK)的活化和TNF-α表达, 阻断α2肾上腺素能受体能显著抑制LPS引起的p38 MAPK)活化和TNF-α表达[13]。因此,这些资料表明,Ber和Y可以通过抑制MyD88依赖信号途径抑制LPS诱导的TNF-α、IL-1β和IL-1β mRNA的表达。然而,本研究发现,Ber和Y预处理均能抑制LPS诱导的IFN-β mRNA的表达,显示Ber和Y对LPS激活的MyD88非依赖信号通路下游基因表达均有抑制作用,这一发现难以用目前所获得的研究资料解释。

图4Ber和Y对正常小鼠和内毒素血症小鼠脾脏SOCS1蛋白含量的影响

图5内毒素注射后1h,Ber和Y不影响内毒素血症小鼠脾脏SOCS3蛋白的表达
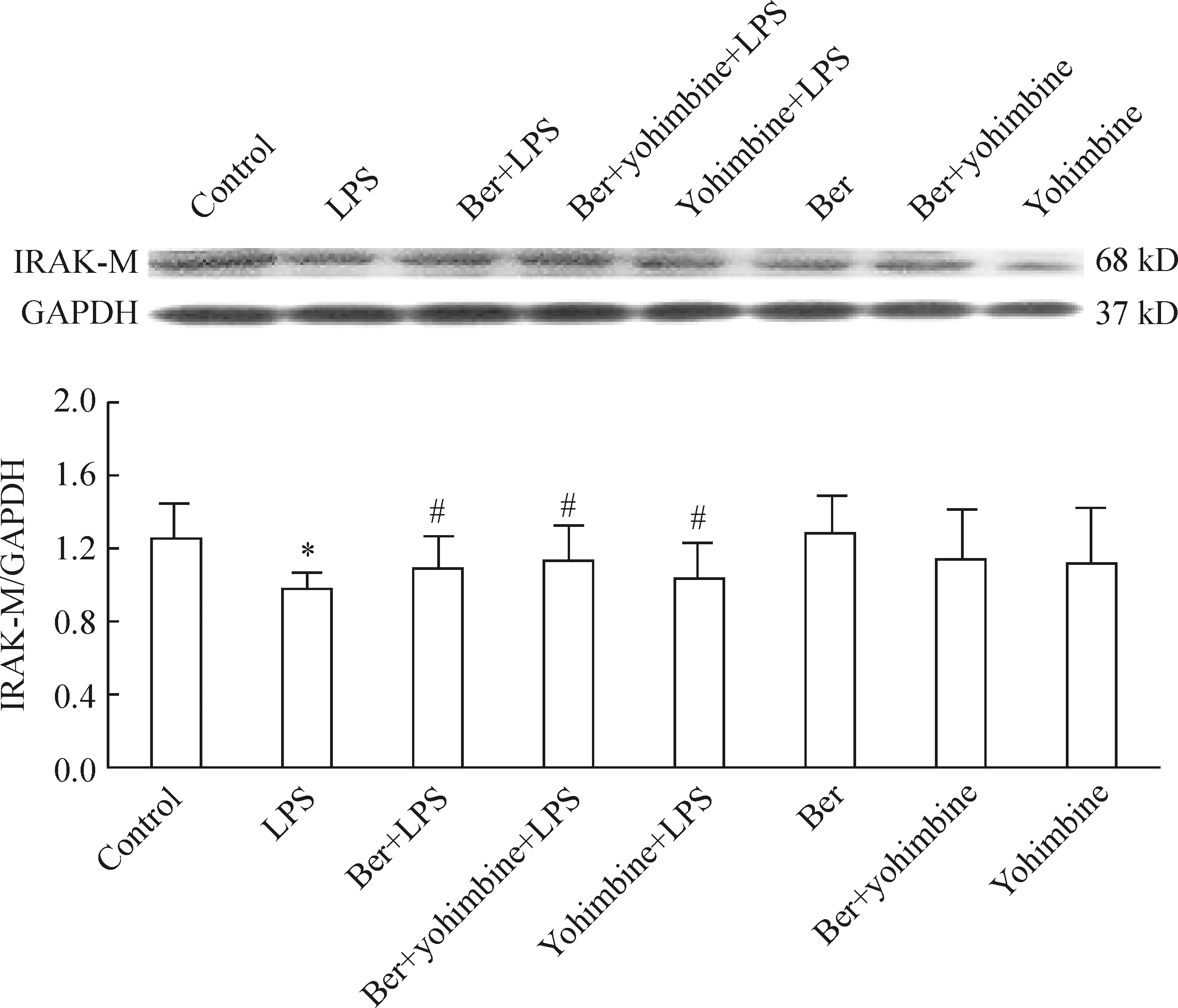

图6LPS注射后1h,Ber和Y对内毒素血症小鼠脾脏IRK-M蛋白含量的影响
业已证明, 一些抑制因子可以抑制LPS诱导的炎症细胞因子的基因表达,包括SOCS和IRAK-M等[14]。SOCS1是JAK-STAT通路的负反馈调控蛋白,LPS刺激可诱导MyD88非依赖的JAK-STAT通路活化,进而诱导SOCS1的表达。在LPS处理的巨噬细胞中,SOCS1的表达可抑制MyD88依赖信号通路中NF-κB 的活化和 MyD88非依赖信号通路中STAT1 的活化。SOCS1基因敲除小鼠不能对LPS产生耐受,对LPS的敏感性增加, LPS攻击后血浆中TNF-α、IL-12和NO的水平明显高于野生型小鼠,而且其死亡率也明显高于野生型小鼠[15]。 SOCS3抑制MyD88非依赖信号通路中STAT-3的活化,是IL-6信号通路的一个重要负性调节因子,LPS可诱导巨噬细胞表达SOCS-3, 同时SOCS-3也能抑制NF-κB 信号通路,给予人工合成的膜渗透性SOCS3可以有效抑制LPS诱导的炎症反应[16-17]。IRAK-M通过阻止IRAK信号转导从而抑制LPS诱导的NF-κB和MAPK的活化。缺乏IRAK-M小鼠对内毒素的敏感性明显增加,LPS诱导的细胞因子水平明显高于野生型小鼠[14]。本研究发现,Ber和Y对LPS激活的MyD88依赖和MyD88非依赖信号通路下游基因的表达均有抑制作用, 这种抑制作用是否与它们调节SOCS与IRAK-M的表达有关, 值得进一步研究。因此, 我们观察了腹腔注射LPS 1h后,Ber和Y对LPS攻击小鼠脾脏SOCS1、SOCS3、IRK-M蛋白表达的影响,结果发现Ber、Ber与Y合剂以及Y预处理并不能提高SOCS1、SOCS3以及IRK-M蛋白的表达,这些结果表明Ber和/或Y并不是通过增强SOCS1 、SOCS3、IRK-M蛋白的表达来发挥对LPS激活的MyD88依赖和MyD88非依赖信号通路下游基因表达的抑制作用。
本研究发现,Ber与Y合剂能显著下调内毒素血症小鼠脾脏IFN-β和 IP-10 mRNA的表达,但不能显著下调内毒素血症小鼠脾脏IL-1α、IL-1β、TNF-α 和IL-6 mRNA的表达,并没有显示2种药物对LPS诱导的细胞因子表达具有相加或协同作用。 这种现象的机制值得深入研究。研究表明Y不仅能阻断α2肾上腺素能受体, 还能增强内毒素血症小鼠血浆NE的水平, 升高的 NE可刺激α1肾上腺素能受体,增强TLR4活化诱导的炎症细胞因子的表达[18]。 因此, 联合用药对内毒素血症小鼠炎症细胞因子表达的调节效应是多种因素综合作用的结果。
总之,本研究发现Ber或Y对内毒素血症小鼠TLR4信号通路中MyD88依赖和非依赖通路中多种基因的表达均具有抑制作用,但它们均不能提高内毒素血症小鼠TLR4信号通路抑制因子SOCS1 、SOCS3和IRK-M的表达, 提示Ber和/或Y发挥抗内毒素血症效应的机制与SOCS1、SOCS3及IRAK-M蛋白无关。
[1] Opal SM. The host response to endotoxin, antilipopolysaccharide strategies, and the management of severe sepsis [J]. Int J Med Microbiol, 2007, 297(5):365-377.
[2] Pridmore AC, Wyllie DH, Abdillahi F, et al. A lipopolysaccharide-deficient mutant ofNeisseriameningitidiselicits attenuated cytokine release by human macrophages and signals via Toll-like receptor (TLR) 2 but not via TLR4/MD2[J]. J Infect Dis, 2001, 183(1):89-96.
[3] Marshall JC, Foster D, Vincent JL, et al. Diagnostic and prognostic implications of endotoxemia in critical illness: results of the MEDIC study[J]. J Infect Dis, 2004, 190(3):527-534.
[4] Lu YC, Yeh WC, Ohashi PS. LPS/TLR4 signal transduction pathway[J]. Cytokine, 2008, 42(2):145-151.
[5] Li F, Wang HD, Lu DX, et al. Neutral sulfate berberine modulates cytokine secretion and increases survival in endotoxemic mice[J]. Acta Pharmacol Sin, 2006, 27(9):1199-1205.
[6] Zhang HQ, Wang HD, Lu DX, et al. Berberine inhibits cytosolic phospholipase A2and protects against LPS-induced lung injury and lethality independent of the α2-adrenergic receptor in mice[J]. Shock, 2008, 29(5):617-622.
[7] Gaj S, Eijssen L, Mensink RP, et al. Validating nutrient-related gene expression changes from microarrays using RT2PCR-arrays [J]. Genes Nutr, 2008, 3(3-4):153-157.
[8] Li HM, Wang YY, Wang HD, et al. Berberine protects against lipopolysaccharide-induced intestinal injury in mice via α2adrenoceptor - independent mechanisms[J]. Acta Pharmacol Sin, 2011, 32(11):1364-1372.
[9] Gu L, Li N, Gong J, et al. Berberine ameliorates intestinal epithelial tight-junction damage and down-regulates myosin light chain kinase pathways in a mouse model of endotoxinemia[J]. J Infect Dis, 2011, 203(11):1602-1612.
[10]Wang YY, Li HM, Wang HD, et al. Pretreatment with berberine and yohimbine protects against LPS-induced myocardial dysfunction via inhibition of cardiac I-κBα phosphorylation and apoptosis in mice[J].Shock, 2011,35(3):322-328.
[11]Lee IA, Hyun YJ, Kim DH. Berberine ameliorates TNBS-induced colitis by inhibiting lipid peroxidation, enterobacterial growth and NF-κB activation[J]. Eur J Pharmacol, 2010, 648(1-3):162-170.
[12]Haskó G, Elenkov IJ, Kvetan V, et al. Differential effect of selective block of α2-adrenoreceptors on plasma levels of tumour necrosis factor-α, interleukin -6 and corticosterone induced by bacterial lipopolysaccharide in mice[J]. J Endocrinol, 1995, 144(3): 457-462.
[13]Miksa M, Das P, Zhou M, et al. Pivotal role of the alpha(2A)-adrenoceptor in producing inflammation and organ injury in a rat model of sepsis[J]. PLoS One, 2009, 4(5):e5504.
[14]Kobayashi K, Hernandez LD, Galán JE, et al. IRAK-M is a negative regulator of Toll-like receptor signaling[J]. Cell, 2002, 110(2):191-202.
[15]Nakagawa R, Naka T, Tsutsui H, et al. SOCS-1 participates in negative regulation of LPS responses[J]. Immunity, 2002, 17(5):677-687.
[16]Qin H, Roberts KL, Niyongere SA, et al. Molecular mechanism of lipopolysaccharide-induced SOCS-3 gene expression in macrophages and microglia[J]. J Immunol, 2007,179(9):5966-5976.
[17]Jo D, Liu D, Yao S, et al. Intracellular protein therapy with SOCS3 inhibits inflammation and apoptosis [J]. Nat Med, 2005,11(8):892-898.
[18]Grisanti LA, Woster AP, Dahlman J, et al. α1-Adrenergic receptors positively regulate Toll-like receptor cytokine production from human monocytes and macrophages[J]. J Pharmacol Exp Ther, 2011, 338(2):648-657.
EffectofberberineandyohimbineonTLR4-dependentgeneexpressioninspleenofendotoxemicmice
LI Hui1, WANG Yi-yang2, LI Hong-mei2, WANG Fa-qiang2, LÜ Xiu-xiu2, QI Ren-bin2, LU Da-xiang2, WANG Yan-ping2, WANG Hua-dong2
(1DepartmentofOtolaryngology,TheFirstAffiliatedHospital,2DepartmentofPathophysiology,KeyLaboratoryofStateAdministrationofTraditionalChineseMedicine,SchoolofMedicine,JinanUniversity,Guangzhou510632,China.E-mail:owanghd@jnu.edu.cn)
AIM: To investigate the effects of berberine (Ber) and yohimbine (Y) on gene expression in Toll-like receptor 4 (TLR4) signaling pathways in the spleen of endotoxemic mice.METHODSThe male BALB/c mice were randomly divided into the following groups: control,lipopolysaccharides (LPS), Ber+LPS, Y+Ber+LPS, Y+LPS, Ber, Y+Ber and Y alone. The mice were treated with water, Y (2 mg/kg) or/and Ber (50 mg/kg) intragastrically once a day for 3 days, and then injected intraperitoneally with normal saline or LPS (20 mg/kg) 1 h after intragastrical treatment on day 3. One hour after LPS challenge, the expression changes of 84 genes in TLR4 signaling pathways in the spleen of the mice were examined using RT2ProfilerTMPCR Array. Moreover, the protein expression of suppressor of cytokine signaling (SOCS)1, SOCS3 and IL-1 receptor-associated kinase (IRAK)-M in the spleen was examined using Western blotting.RESULTSLPS induced the expression of multiple downstream inflammatory mediators in myeloid differentiation factor 88 (MyD88)-dependent and independent signaling pathways, such as TNF-α, IL-1α, IL-1β, IL-6,IFN-γ, IFN-β and CXCL10. Ber not only down-regulated LPS-induced mRNA expression of TNF-α, IL-1β, L-1β and IL-6, which were in the downstream of MyD88-dependent signaling pathway, but also reduced LPS-stimulated mRNA expression of IFN-β and CXCL10, which were in the downstream of MyD88-independent signaling pathway (P<0.05). Y markedly inhibited the mRNA expression of IL-1α,IL-1β and IFN-β in the spleen of endotoxemic mice (P<0.05), but did not affect the mRNA expression of TNF-α, IL-6 and CXCL10 (P>0.05). Combination of Ber with Y significantly reduced the mRNA expression of IFN-β and CXCL10 in the spleen of the mice challenged with LPS. One hour after LPS challenge, Ber or/and Y did not increase the protein expression of SOCS1, SOCS3 and IRAK-M in the spleen of the mice.CONCLUSIONPretreatment with Ber and Y down-regulates the expression of some genes in the downstream of MyD88-dependent and MyD88-independent signal pathways in the spleen of endotoxemic mice. The mechanism of these actions is not related with SOCS1, SOCS3 and IRAK-M at protein level.
Berberine; Yohimbine; Endotoxemia; Toll-like receptor 4; Mice
R363
A
10.3969/j.issn.1000-4718.2012.04.014

