清胰汤对急性胰腺炎大鼠胰腺NF-κB p65表达的影响
王念林 张铁英 欧阳玉霞 杨元生 陈垦
·短篇论著·
清胰汤对急性胰腺炎大鼠胰腺NF-κB p65表达的影响
王念林 张铁英 欧阳玉霞 杨元生 陈垦
急性胰腺炎(AP)为临床常见病,病情凶险,常引起全身炎症反应综合征(SIRS),并最终导致多器官功能衰竭(MODS)。目前具体发病机制尚不明确,治疗仍以对症支持为主。因而探求AP发病机制对寻找有效的治疗方法意义重大。本研究观察清胰汤对AP大鼠胰腺NF-κB p65表达的影响。
一、材料与方法
1.实验动物分组:54只SD大鼠由广东省实验动物中心提供,许可证号:SCXK(粤)2008-0002,雌雄不限,体重(200±10)g。按完全随机法分成对照组、AP组、清胰汤组。采用逆行胰胆管注射3%牛磺胆酸钠的方法[1]建立AP模型。清胰汤组于建模后立刻予清胰汤1 ml/100 g体重灌胃,每12 h给药一次;对照组仅开腹翻动胰腺数次即关腹,以生理盐水替代灌胃。
2.血清淀粉酶、IL-1和TNF-α测定:血清淀粉酶测定采用人工碘比色法;血清IL-1和TNF-α检测采用ELISA方法。
3.胰腺病理学检查及NF-κB p65检测:胰腺组织常规病理检查,盲法阅片,并根据Ozhan等[2]标准评分。胞质和(或)胞核呈黄色或棕黄色为阳性。高倍镜下随机取5个视野,计阳性细胞数百分比及染色强度。阳性细胞数:<5% 0分,6%~25% 1分,26%~50% 2分,51%~75% 3分,>75% 4分;无染色0分,浅黄色1分,黄色2分,棕黄色3分。两评分乘积0~1分为(-),2~3分(+),4~5分(++),>6分(+++)。
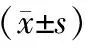
二、结果
1.血清淀粉酶、IL-1和TNF-α水平: AP组和清胰汤组血清淀粉酶、IL-1和TNF-α水平均高于对照组;AP组血清淀粉酶水平于24 h达到峰值,随后逐渐下降,予清胰汤治疗后,24 h和48 h血清淀粉酶明显降低,72 h后3组比较差异无统计学意义;清胰汤组血清IL-1和TNF-α较AP组明显降低,呈时效依赖性,以72 h下降最明显(表1)。

表1 各组血清淀粉酶、IL-1和TNF-α变化
注:与对照组比较,aP<0.05;与AP组比较,bP<0.05
2.胰腺病理组织学变化:对照组胰腺组织未见病理改变(图1a);AP组大鼠胰腺可见出血、坏死,大量炎细胞浸润,腺泡结构模糊,部分腺泡胞核溶解或消失,残余腺泡肿胀,间质水肿(图1b);而清胰汤组胰腺组织病理改变较AP组减轻(图1c)。各组胰腺病理评分见表2。

图1对照组(a)、AP组(b)和清胰汤组(c)大鼠胰腺组织病理改变(HE ×200)

表2 各组胰腺病理评分
注:与对照组比较,aP<0.05;与AP组比较,bP<0.05
3.胰腺NF-κB p65蛋白表达:对照组胰腺组织NF-κB p65微量表达,主要见于细胞质,呈浅黄色(图2a);AP组各时间点NF-κB p65表达增强,呈棕黄色,部分细胞核也有表达(图2b);清胰汤组胰腺腺泡染色较AP变浅,胰腺NF-κB p65免疫组化积分较AP明显降低(图2c,表3)。

图2 对照组(a)、AP组(b)和清胰汤组(c)胰腺NF-κB表达(×200)

表3 各组胰腺NF-κB p65免疫组化积分
注:与AP组比较,aP<0.05
讨论AP病程中氧自由基、白介素、TNF等细胞因子大量产生,并易导致SIRS和MODS。清胰汤为传统组方,具有通里攻下,减少肠源性感染与内毒素血症;活血化瘀,改善微循环,减轻各器官的缺血、缺氧,减少氧自由基的产生;清除氧自由基;抑制体内各种炎症因子的产生;诱导器官细胞凋亡,从而减轻器官坏死程度等作用[3]。本研究结果显示,应用清胰汤治疗后AP大鼠各种氧化应激因子、炎症因子明显降低,器官损伤程度改善。
研究发现[4],TNF-α、IL-1等多种细胞因子及黏附分子在基因多肽水平上受到NF-κB p65调节。活化的NF-κB p65可单独或与其他转录因子协同参与上述炎症因子基因的诱导表达,在细胞因子瀑布样级联反应中起中心作用。在AP发生早期,多个器官可检测到NF-κB p65高表达,并参与多器官的病理损伤[5]。应用NF-κB p65活化选择性抑制剂NBD,可选择性靶向抑制NF-κB,明显减轻AP大鼠胰腺、肺等器官损伤[6]。近年研究发现[7-8],活性氧ROS是激活NF-κB的重要中介分子,因此抗氧化剂作为NF-κB抑制剂被深入研究。
本实验再次验证了清胰汤在AP模型大鼠中显示出良好的治疗效果。与AP组比较,清胰汤24 h和48 h血清淀粉酶明显降低,72 h接近正常水平,提示清胰汤能有效降低血清淀粉酶。炎症介质TNF-α、IL-1在AP发生、发展过程中发挥着重要作用,本研究发现二者升高明显。应用清胰汤治疗后大鼠血清TNF-α、IL-1水平于48 h和72 h较AP组下降明显,提示清胰汤可抑制炎症反应,减少炎症介质的产生和释放。本结果显示,AP大鼠胰腺NF-κB p65表达在建模后有不同程度升高,与血清中TNF-α、IL-1升高及胰腺病理损伤相平行,应用清胰汤灌胃治疗,降低了血清TNF-α、IL-1水平,并下调胰腺NF-κB p65的表达,改善其病理损伤。
综上所述,中药清胰汤对AP的治疗是通过多靶点作用实现的 ,其可能机制是通过抑制炎症通路中炎症相关蛋白的表达,从而达到保护器官目的。本研究得出,AP发生、发展涉及NF-κB p65等炎症相关因子的激活,产生并释放过度炎症介质介导过度炎症反应造成各器官的损伤;清胰汤可抑制AP大鼠体内过度炎症反应,降低TNF-α、IL-1水平,下调胰腺NF-κB p65表达,从而起到保护胰腺的治疗效果。
[1] 王念林,陈垦,龙友明,等.核因子-κB在大鼠急性坏死性胰腺炎中作用的实验研究.胰腺病学,2005,5:93-96.
[2] Ozhan G, Yanar HT, Ertekin C, et al. Polymorphisms in tumour necrosis factor alpha (TNFalpha) gene in patients with acute pancreatitis. Mediators Inflamm, 2010, 2010:482950.
[3] Yang DY, Duan SB, Aili JT. Effect of qingyi decoction in treating severe acute pancreatitis and its impacts on blood level of tumor necrosis factor-alpha, interleukin-6 and interleukin-8. Zhongguo Zhong Xi Yi Jie He Za Zhi,2009, 29:1122-1124.
[4] Viterbo D, Bluth MH, Mueller CM, et al. Mutational characterization of pancreatitis-assiociated protein 2 domains involved in mediating cytokine secretion in macrophages and the NF-kappaB pathway. J Immunol, 2008, 181:1959-1968.
[5] Wang YL, Zheng YJ, Zhang ZP, et al. Effects of gut barrier dysfunction and NF-kappaB activation on aggravating mechanism of severe acute pancteatitis. J Dig Dis, 2009,10:30-40.
[6] Long YM, Chen K, Liu XJ, et al. Cell-permeable Tat-NBD peptide attenuates rat pancreatitis and acinus cell inflammation response. World J Gastroenterol, 2009, 15:561-569.
[7] KanSH,Huang F,Tang J,et al.role of intrapulmonary expression of inducible Nitric oxide synthase gene and nuclear factor kappaB activation in severe pancreatitis-assosiated lung injury. Inflammation,2010,33:287-294.
[8] Szabolcs A, Biczó G,Rakonczay Z, et al.simultaneous proteosome inhibition and heat shock protein induction by bortezomib is beneficial experimental pancreatitis. Eur J Pharmacol,2009,616:270-274.
10.3760/cma.j.issn.1674-1935.2012.01.019
2010年广州市花都区医药卫生科技计划项目(HD10WSY17)
510800 广东广州,广州市花都区人民医院消化内科(王念林、张铁英、欧阳玉霞);广东药学院附属第一医院消化内科(杨元生、陈垦)
陈垦Email:chken@gdpc.edu.cn
2011-02-22)
(本文编辑:屠振兴)

