猪胰头部冷冻的炎症反应观察
曾健滢 李家亮 陈继冰 周亮 方刚 邓春娟 姚飞 黄生权 刘卫群 邱大卫 牛立志 左建生 徐克成
猪胰头部冷冻的炎症反应观察
曾健滢 李家亮 陈继冰 周亮 方刚 邓春娟 姚飞 黄生权 刘卫群 邱大卫 牛立志 左建生 徐克成
氩氦刀冷冻技术是近年兴起的微创肿瘤疗法之一,可作为手术切除的辅助疗法,有效消融不能手术切除的肝癌[1-2]、肺癌[3]和前列腺癌[4]等恶性肿瘤。目前该技术开始运用于治疗不能手术切除的胰腺肿瘤[5],并多见于治疗胰体尾部肿瘤。由于胰腺体积小,横径薄及质地软,且胰头部紧贴周围肝、胃和十二指肠、门静脉等重要器官和血管,故对于胰头部的冷冻难以完全照搬其他器官冷冻时的成功经验,使得冷冻治疗胰头癌仍处于起步阶段,其安全和有效性仍有待于实验和临床的进一步观察。本研究使用西藏小型猪,观察其胰头部冷冻后产生的局部及全身性炎症反应,为临床研究提供实验基础。
一、材料与方法
1.实验动物及分组:普通级西藏小型猪10头,雄性,体重25~35 kg,由南方医科大学实验动物中心提供,动物生产许可证号SCXK(粤)2006-0015,动物合格证号粤监证字0087238。按数字表法随机分成冷冻组(4头)、阴性对照组(3头)和空白对照组(3头)。血清IL-6、IL-8、TNF-α、淀粉酶和C-反应蛋白(CRP)的ELISA试剂盒均购自上海朗顿生物技术有限公司,检测用酶标分析仪(美国Rayto公司,RT-6500);血常规检测设备为全自动血液分析仪(日本Sysmex公司,KX-21)。
2.胰头部冷冻方法:氩氦冷冻系统,包括主机、2 mm冷冻探针和探温针均为美国Endocare公司产品(CryocareTM)。小型猪术前禁食24 h,禁水12 h。以3%的异氟烷混合气体面罩诱导麻醉,并以1%~1.5%浓度维持术中麻醉。消毒、铺单后开腹,分离胰腺。将直径为2 mm的冷冻探针直视下插入十二指肠襻胰头部区域。冷冻中心点距十二指肠及门静脉各1 cm,插入深度1 cm。尽可能避开主胰管,然后以100%的氩气输出功率激活探针,维持5 min后停输氩气,改输氦气复温至10~20℃,维持3 min,重复以上冷冻-复温循环1次后拔针。观察冷冻时胰腺表面组织的形态变化,用游标卡尺测量并记录冰球最大直径,于冷冻中心点置一缝线作为标记,关腹结束手术。阴性对照组予以插针,不冷冻,维持10 min后关腹。空白对照组仅开、关腹。术后自由饮食,护理期间不给予药物。术后第7天统计各组生存率,随后对实验猪实行安乐死,剖腹取胰腺。
3.血清淀粉酶、IL-6、IL-8、TNF-α和CRP检测:术后第1、3、5天采血,离心分离血清,用双抗体夹心ELISA法检测血清淀粉酶、IL-6、IL-8、TNF-α、CRP水平。
4.血常规检测:术后第7天经锁骨下缘中央静脉丛采血,通过全自动血液分析仪检测血常规各项指标。
5.胰腺病理学检查:肉眼观察胰头部冷冻坏死区域形态。标本送广州金域医学检验中心行病理学检查。
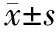
二、结果
1.术中所见及术后存活率:冷冻时胰腺表面形成以探针为中心的界限清楚的白色圆形冰球区域(图1),冰球周围组织形态、颜色无异常。冷冻区域最大直径平均为(19.8±3.3)mm。实验猪术中生命体征平稳,术中无死亡。术后48 h内均恢复正常饮食。术后7 d存活率100%。阴性对照组及空白对照组无异常改变。
2.胰腺病理改变:术后7 d,冷冻组胰腺肉眼可见冷冻中
心区形成近圆形红褐色病灶,呈骨髓样,质地糜烂;病灶周边组织颜色苍白,触摸质地柔软,与外周组织分界较明显。其他区域胰腺组织眼观无异常(图2)。
病理检查见胰头部以插针点为中心,平均半径为(5.9±0.7)mm的球状区域组织完全坏死,周围形成炎性反应带和肉芽肿,内见大量细胞碎片和中性粒细胞浸润(图3)。阴性及空白对照组胰腺未见异常。
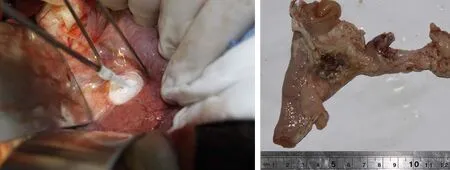
图1猪胰头部冷冻时冰球形成图2冷冻组术后7 d的胰腺
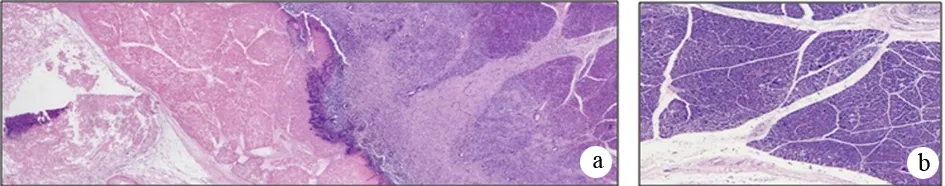

图3冷冻组胰腺冷冻部位(a)、阴性对照组插针部位(b,HE ×100)及冷冻组胰腺完全坏死区(c)、炎性反应带(d,HE ×400)
3.血清淀粉酶、IL-6、IL-8、TNF-α和CRP水平的变化:冷冻组各项血清指标在术后第1天均显著升高,随后均逐渐下降(表1)。冷冻组术后1、3、5 d血清TNF-α水平分别为(159.0±21.9)、(149.9±23.9)、(132.0±20.2)ng/L,显著高于阴性对照组的(139.8±6.9)、(123.7±6.1)、(117.5±5.0)ng/L和空白对照组的(130.3±7.2)、(115.4±11.1)、(107.2±3.7)ng/L(P值均<0.01)。术后第3天CRP水平恢复正常,第5天IL-8水平恢复正常(表1)。阴性对照组和空白对照组血清各项指标均无明显改变。
表1 各组冷冻前后血淀粉酶、CRP、IL-6、IL-8水平变化
注:与冷冻组比较,aP<0.05;bP<0.01
4.血常规变化:术后第7天,冷冻组的淋巴细胞总数、淋巴细胞百分数较阴性对照组显著升高,差异有统计学意义(P<0.01),而其他指标与阴性对照组比较,差异均无统计学意义(表2)。
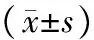
表2 各组在冷冻后第7天血常规的比较
注:与冷冻组比较,aP<0.05;bP<0.01
讨论冷冻治疗[6]是一种原位消融技术,其原理和基本方法是将冷冻探针插入靶组织,或将致冷源直接作用于靶组织,使局部温度迅速降低,直接破坏靶组织内细胞或血管,影响或断绝肿瘤的营养与氧气供应,达到破坏靶组织的目的。氩氦刀冷冻治疗已经广泛推广到多种实体肿瘤的治疗[7-9]。由于胰腺具有特殊解剖位置,胰头被包绕在十二指肠襻区域,胰周有下腔静脉,肠系膜上静脉、门静脉、肠系膜上动脉等重要血管,并有主胰管及胆管经过,加之胰腺是具有内外分泌功能的重要器官,因此,对胰头部冷冻,除造成胰腺正常组织坏死或损伤外,也可能造成十二指肠、胰周重要的大血管、胰管及胆管的损伤,使胰酶外泄,释放入血液及组织间隙,并引起严重的炎症反应。因此,氩氦刀冷冻消融胰腺组织所引起的炎症反应程度,以及是否会引起急性胰腺炎,成为氩氦刀冷冻系统能否用于治疗胰腺头部肿瘤的关键。
姚榛祥等[10]报道,给予急性胰腺炎大鼠及狗冷冻治疗后,血清及胰腺组织内的蛋白酶、脂肪酶、淀粉酶及磷脂酶均比冷冻治疗前显著下降。他们认为血清胰酶水平下降的原因可能是冷冻区域产生凝固坏死及周围细胞内酶蛋白灭活使释放入血液的活性酶蛋白减少所致。本研究结果显示,血清淀粉酶水平在冷冻后24 h即显著升高,以后逐渐下降,在冷冻后5 d仍处于高位,但没有超过阴性对照组水平的3倍。
体内TNF-α、IL-6、IL-8和CRP等免疫炎性因子水平可以反映出机体的炎症水平。本研究结果显示,冷冻组小型猪血清TNF-α、IL-6、IL-8在术后1、3、5 d均显著高于空白对照组,随后逐渐下降,而CRP水平仅在术后第1天呈一过性升高,随即恢复到正常值水平,病理检查见冷冻坏死区周边出现中性粒细胞浸润,表明胰腺冷冻损伤后存在炎症反应,这与胰酶释放入血,激活单核-巨噬细胞有关[11]。但胰腺的炎症程度低,没有引发严重并发症。因此,我们认为,在胰头部位进行冷冻可造成胰腺冷冻中心区组织坏死,并在短期内引发局部和全身轻微的炎症反应,但引发的炎症反应并不严重,没有导致急性胰腺炎发生。因此,氩氦刀冷冻胰头部相对安全,或可成为胰头部恶性肿瘤的一种治疗选择。
[1] Adam R, Majno P, Castaing D,et al. Treatment of irresectable liver tumours by percutaneous cryosurgery. Br J Surg, 1998, 85:1493-1494.
[2] Kuang M, Lu MD,Xie XY,et al. Liver cancer: increased microwave delivery to ablation zone with cooled-shaft antenna——experimental and clinical studies. Radiology, 2007, 242: 914-924.
[3] Maiwand MO, Asimakopoulos G. Cryosurgery for lung cancer: clinical results and technical aspects. Technol Cancer Res Treat, 2004, 3: 143-150.
[4] Katz AE, Rewcastle JC. The current and potential role of cryoablation as a primary therapy for localized prostate cancer. Curr Oncol Rep, 2003, 5: 231-238.
[5] Kovach SJ, Hendrickson RJ, Cappadona CR, et al.Cryoablation of unresectable pancreatic cancer. Surgery, 2002, 131: 463-464.
[6] Ng KK, Lam CM, Poon RT,et al. Comparison of systemic responses of radiofrequency ablation, cryotherapy, and surgical resection in a porcine liver model. Ann Surg Oncol, 2004, 11: 650-657.
[7] Pistorius GA, Alexander C, Krisch CM,et al. Local platelet trapping as the cause of thrombocytopenia after hepatic cryotherapy. World J Surg, 2005, 29: 657-660.
[8] Haddad FF, Chapman WC,Wright JK,et al. Clinical experience with cryosurgery for advanced hepatobiliary tumors. J Surg Res, 1998, 75: 103-108.
[9] Kollmar O, Richter S, Schilling MK,et al. Advanced hepatic tissue destruction in ablative cryosurgery: potentials of intermittent freezing and selective vascular inflow occlusion. Cryobiology, 2004, 48: 263-272.
[10] 姚棒祥,徐向阳,林琦远.重症胰腺炎的冷冻外科治疗.普外临床,1994,9:301-303.
[11] Bhatia M. Inflammatory response on the pancreatic acinar cell injury. Scand J Surg, 2005, 94: 97-102.
10.3760/cma.j.issn.1674-1935.2012.04.021
广东省卫生厅医学科研基金课题(WSTJJ2009-0401440106196602154756)
510305 广州,中国科学院广州生物院附属复大医院 广州复大肿瘤医院中心实验室
牛立志,Email:fudaclab@gmail.com
2011-09-22)
(本文编辑:屠振兴)

