血管紧张素Ⅱ1型受体抑制剂对人子宫内膜癌裸鼠皮下移植瘤的实验研究
石海燕,胡维维,许 欣,杨秀媚,赖均鹏,徐园园,陶金华
(佛山市第一人民医院 病理科,广东 佛山528000)
子宫内膜癌是妇科常见恶性肿瘤之一。因此,体外建立子宫内膜癌模型对研究其发病机制与治疗具有极为重要的意义。本研究应用血管生成因子(VEGF)和肿瘤血管密度(MVD)两个指标评估人子宫内膜癌祼鼠皮下移植瘤内血管形成程度,现报道如下。
1 材料与方法
1.1 材料
细胞株:人子宫内膜癌HEC-1B细胞株选自上海生命科学研究所,HEC-1B细胞以常规方法复苏、培养。取部分细胞进行种植,其余冻存于液氮罐中。实验动物:4-6周龄BALB/C雌性裸鼠12只,体重15-16g左右,购自广东省中山医科大学动物中心,均置于SPF环境下饲养。将裸鼠随机分为肿瘤组和血管紧张素Ⅱ1型受体(AT1R)肿瘤抑制组,每组6只。免疫组化试剂:CD34和VEGF均购自DAKO公司;厄贝沙坦购自Sanofi Winthrop Industrie公司。
1.2 方法
1.2.1 HEC-1B细胞的培养和细胞悬液的制备及裸鼠接种 复苏后的细胞株置于含10%胎牛血清的MEM培养液中,于37℃、5%CO2培养基中培养。选择处于对数生长期的细胞,用0.25%浓度的胰酶对其进行消化,然后PBS洗涤细胞2次;以1 000转/min的转速对细胞悬液离心5min,收集细胞,用0.9%浓度的生理盐水悬浮细胞,将细胞浓度调整至1×106/ml,接种至裸鼠右上肢背部皮下组织。
1.2.2 分组及给药 接种当天把裸鼠随机分为2组,除正常饮食外,肿瘤组每天胃饲生理盐水1次0.5ml,肿瘤抑制组每天胃饲10mg/kg的 AT1R抑制剂0.5ml,观察裸鼠的成瘤情况,约10天左右成瘤。成瘤后4周后,处死模型鼠,取下肿瘤,部分组织存储于液氮中备用,部分用10%甲醛固定。
1.2.3 肿瘤形态学检测 自接种第11天起,每两天测量1次肿瘤的体积(V=AB2/2),A为肿瘤最大直径,B为与A垂直的最大径,将肿瘤体积对时间的变化绘制成肿瘤生长曲线图。
1.2.4 组织病理观察 用10%浓度的福尔马林将剥取的肿瘤组织进行固定、脱水、透明、浸蜡、包埋,成功制成5μm厚的组织切片。用苏木素-伊红对组织切片进行染色,然后作肿瘤组织病理学检查。
1.2.5 肿瘤血管密度(microvessel density MVD)检测 MVD计数参照 Weidner[1]的评判标准。肿瘤组织常规切片后,每组肿瘤各取一张坏死组织最少、肿瘤细胞丰富的玻片,先在低倍镜下寻找内皮细胞染色(CD34染色)最密集的10个区域(形成微血管最丰富的区域),在高倍镜下观察视野下的组织微血管数,计算每个视野的数目,取平均值,即为每个高倍镜视野下的MVD,胞质呈棕黄色染色的内皮细胞簇或单个内皮细胞,与周围组织有明显界限,无论有没有血管腔,血管腔内有没有红细胞均定义为1个微血管。若管腔大于8个红细胞直径或管腔有明显肌层则不在计数范围内,将两组的MVD进行比较。
1.2.6 VEGF抗原阳性率的测定 VEGF阳性细胞判断以胞浆出现棕黄色团块或颗粒为准。高倍镜下随机计数5个高倍视野,每个视野计数100个细胞VEGF染色阳性细胞数,5个视野下平均阳性数作为每一例的阳性数,用百分数表示。VEGF染色阳性细胞数>30%即为阳性表达。
1.3 统计学处理
全部数据均用SPSS 17.0统计软件进行分析处理,其中,计量资料用均数±标准差()表示,组间比较应用t检验,组内比较应用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 裸鼠体重和成瘤情况观察
肿瘤抑制组的肿瘤生长速度明显慢于肿瘤组的肿瘤生长速度(P<0.05),见表1、图1。
表1 裸鼠体重和成瘤情况()
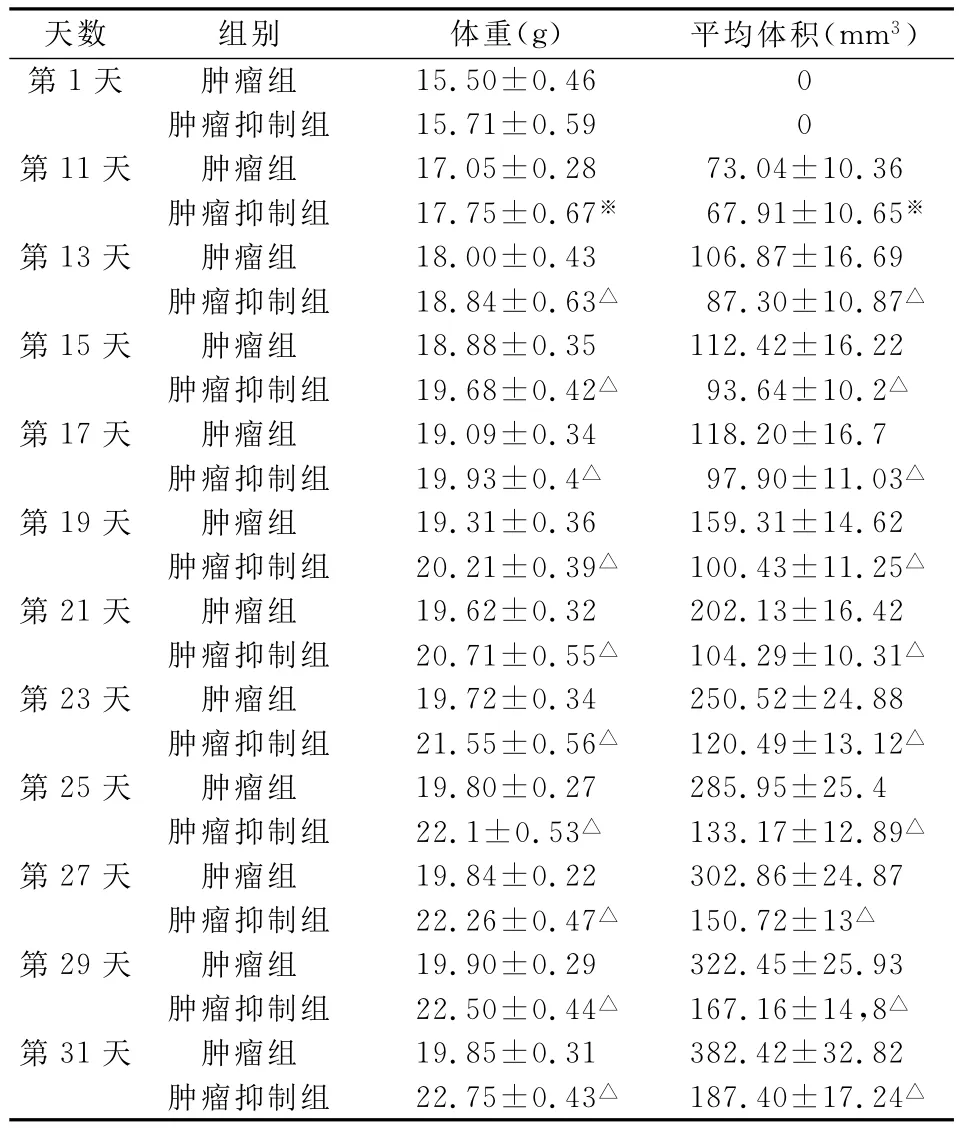
表1 裸鼠体重和成瘤情况()
注:与肿瘤组比较△P<0.01,※P<0.05。
天数 组别 体重(g) 平均体积(mm3)15.50±0.46 0肿瘤抑制组 15.71±0.59 0第11天 肿瘤组 17.05±0.28 73.04±10.36肿瘤抑制组 17.75±0.67※ 67.91±10.65※第13天 肿瘤组 18.00±0.43 106.87±16.69肿瘤抑制组 18.84±0.63△ 87.30±10.87△第15天 肿瘤组 18.88±0.35 112.42±16.22肿瘤抑制组 19.68±0.42△ 93.64±10.2△第17天 肿瘤组 19.09±0.34 118.20±16.7肿瘤抑制组 19.93±0.4△ 97.90±11.03△第19天 肿瘤组 19.31±0.36 159.31±14.62肿瘤抑制组 20.21±0.39△ 100.43±11.25△第21天 肿瘤组 19.62±0.32 202.13±16.42肿瘤抑制组 20.71±0.55△ 104.29±10.31△第23天 肿瘤组 19.72±0.34 250.52±24.88肿瘤抑制组 21.55±0.56△ 120.49±13.12△第25天 肿瘤组 19.80±0.27 285.95±25.4肿瘤抑制组 22.1±0.53△ 133.17±12.89△第27天 肿瘤组 19.84±0.22 302.86±24.87肿瘤抑制组 22.26±0.47△ 150.72±13△第29天 肿瘤组 19.90±0.29 322.45±25.93肿瘤抑制组 22.50±0.44△ 167.16±14,8△第31天 肿瘤组 19.85±0.31 382.42±32.82肿瘤抑制组 22.75±0.43△ 187.40±17.24第1天 肿瘤组△
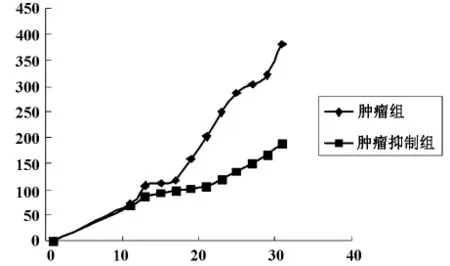
图1 肿瘤生长曲线图
两组模型鼠的平均体重:肿瘤组为19.07g,肿瘤抑制组为21.08g,裸鼠平均10天左右成瘤,直径均大于5mm,成瘤率为100%(12/12),肿瘤随着时间的增加而增大,4周后处死模型鼠,移植瘤表面较光滑,毛细血管丰富。肿瘤大小:肿瘤组最大径11.34mm,平均体积210.56mm3,肿瘤抑制组最大径9.01mm,平均体积119.13mm3,两组之间有显著的差异(P<0.05)。
2.2 肿瘤组织病理学检查
光镜下可以见到肿瘤细胞呈弥漫分布,核大深染,核呈圆形、卵圆形或形状不规则,核染色质不均匀,胞质少,部分细胞可见核仁,病理性核分裂多见,组织内可见坏死,肿瘤组肿瘤组织内见小灶的坏死,大小为1mm-3mm,肿瘤抑制组可见大片状的坏死约9mm大小,两组肿瘤组织间质血管增生情况见图2、图3。肿瘤组内可见肌肉内癌组织的侵犯,但未见淋巴结的转移,见图4。

图2 肿瘤组HE×40 肿瘤组CD34×200 肿瘤组VEGF×200
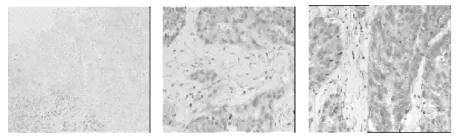
图3 肿瘤抑制组 肿瘤抑制组CD34肿瘤抑制组VEGF HE×40 ×200 ×200
2.3 两组移植瘤肿瘤组织间质MVD的比较
用药组的CD34与VEGF的表达均MVD少于对照组,两组比较有显著的差异性(P<0.05)。见表2。

图4 肿瘤组肌肉内见癌的侵犯
表2 两组移植瘤肿瘤组织间质MVD的比较()

表2 两组移植瘤肿瘤组织间质MVD的比较()
CD34 VEGF组别48.59±4.52 46.38±4.31肿瘤抑制组 15.59±3.15 15.42±3.10 t值 59.96 58.75 P值 0.肿瘤组000 0.000
2.4 两组移植瘤肿瘤组织间质VEGF阳性率比较
肿瘤组染色后有5例VEGF阳性,阳性率为83.3%;肿瘤抑制组染色后有1例VEGF阳性,阳性率为16.7%,两组比较有显著性差异(P<0.05)。
3 讨论
本研究中成功的建立了HEC-1B人子宫内膜癌裸鼠皮下移植瘤模型,此模型在组织病理学、免疫组化表型都与子宫内膜癌癌细胞相同,而且肿瘤组织移植生长率为100%,这就说明此模型的生物学特性是稳定的,从而为基础研究提供了非常有价值的动物模型。
大量研究发现几乎所有组织都具有独立的RAS(肾素-血管紧张素)系统,主要调节局部组织的生长和分化[2]。而多数肿瘤如肺癌、肝癌、乳腺癌、卵巢癌、宫颈癌等组织中都存在局部RAS活性因子的表达上调,包括 AT1R 表达的上调[3-8]。我们之前的研究表明从正常子宫内膜上皮到非典型增生再到子宫内膜癌的发展过程中,AT1R表达能力是逐步上调的,且AT1R的表达与年龄、FIGO分期、淋巴结转移状况和肌层浸润深度等因素关系密切[9]。
我们的实验证实了AT1R抑制剂对肿瘤的生长有明显的抑制作用,首先表现在裸鼠的体重方面,应用了抑制剂的模型体重明显比对照组增加;其次表现在移植瘤上,应用抑制剂的移植瘤的最大直径和平均体积均明显小于对照组;再其次模型中移植瘤的肿瘤细胞的变化表现在两个方面,其一,肿瘤细胞的变性、坏死,抑制剂组的坏死范围远远高于对照组;其二,肿瘤间质血管的增生情况,对照组中间质血管丰富,明显增生,而抑制剂组中肿瘤间质的血管明显的减少。从上面的实验可以得出,AT1R抑制剂对肿瘤生长的抑制作用非常的明显,主要表现在抑制肿瘤组织间质内血管的生成,使肿瘤细胞供血供氧不足,从而肿瘤细胞坏死,进而起到抑制肿瘤生长的作用,因此AT1R抑制剂在恶性肿瘤的治疗方面起着很显著的作用,至于什么剂量是最合适的剂量,有待我们下一步实验结果。
[1]Weidner N,Intratumor microvessel density as a prognostic factor in cancer[J].Am J Pathol,1995,147(1):9.
[2]罗 营,麋若然.去势雌性裸小鼠人子宫内膜癌皮下移植瘤动物模型的建立[J].天津医科大学学报,2004,10(3):391.
[3]Bauvois B.Transmembrane proteases in cell growth andinvasion:new contributors to angiogenesis[J].Oncogene,2004,23:317.
[4]Deshayes F,Nahmias C.Angiotensin receptors:a new role in cancer[J]?Trends Endocrinol Metab,2005,16:293.
[5]Egami K,Murohara T,Shimada T,et al.Role of host angiotensin II type 1receptor in tumor angiogenesis and growth[J].J Clin Invest,2003,112:67.
[6]Ino K,Shibata K,Kajiyama H,et al.Manipulating the angiotensin system-new approaches to the treatment of solid tumours[J].Ex-pert Opin Biol Ther,2006 ,6(3):243.
[7]Dinh DT,Frauman AG,Somers GR,et al.Evidence for activation of the rennin-angiotensin system in the human prostate:increased angiotensin II and reduced AT1-receptor expression in benign prostatic hyperplasia[J].J pathol,2002,196(2):213.
[8]De paepe B,Verstraeten VL,de potter CR,et al.Growth stimulatory angiotensis II type-1receptor is up-regulated in breast hyperplasia and in situ carcinoma but not in invasive carcinoma[J].Histochem cell Biol,2001,116(3):247.
[9]胡维维,陶金华,许 欣,等.血管紧张素Ⅱ1型受体和血管紧张素转化酶在子宫内膜癌中的表达及相关性[J].临床实验与病理学杂志,2011,5.

