重组Kinectin蛋白的表达、纯化及应用研究
黄天明,赵飞兰,莫发荣,晁耐霞,谢小薰,罗国容
(广西医科大学 组 织学与胚胎学教研室,广西 南 宁530021)
本课题组应用SEREX(serological analysis of recombinant cDNA expression libraries)技术,从广西人肝细胞癌(HCC)的cDNA文库中筛选出一系列 HCC相关的抗原基因[1,2],其中编号为 HCC-27-9-3的基因序列与kinectin的N末端同源,且初步检测表明,其抗体在HCC病人中有较高的特异性和阳性率[3]。本研究在对此kinectin基因进行了体外重组、克隆及表达的基础上[4]对其诱导及纯化条件进行了优化,并检测了所得MBP-kinectin融合蛋白致敏DC及刺激自体T淋巴细胞增殖的能力,为其开发应用奠定了基础。
1 材料与方法
1.1 材料 HCC-27-9-3重组噬菌粒为本室自存;大肠杆菌DH5α和 TB1,质粒p MAL-C2,Amylose resin亲和层析柱,RPMI1640培养液,胎牛血清(FCS),Ficoll分离液(1.077 g/ml),T细胞尼龙毛柱,脂多糖(LPS),重组人rhGM-CSF、rhIL-4、IL-12、IFN-γ,ELISA检测试剂盒,MTT,IPTG,X-gal,Taq酶,d NTP,Bam HI,HindIII,XmnI,T4DNA 连接酶,DNA marker,PEG8000,小分子量胶回收试剂盒,其余化学试剂均为国产分析纯;SDS-PAGE由3%浓缩胶和12%分离胶组成,蛋白定量分析用BIO-RAD公司的Quantity One凝胶分析软件,引物均由上海生工合成,蛋白的飞行质谱测序分析送复旦大学进行。
1.2 方法
1.2.1 重组质粒的构建及鉴定 用PCR扩增HCC-27-9-3重组噬菌粒中的kinectin目的基因片断并将其插入p MAL-C2载体质粒中,先转入DH5α菌,经蓝白斑实验、PCR法、酶切法及DNA测序筛选出正确的重组子后,再转入TB1表达宿主菌。
1.2.2 目的基因在宿主菌中的诱导表达 将转有正确重组质粒的TB1工程菌置于LB-Amp+板中培养过夜后,挑单克隆至3 ml LB-Amp+培养液中,37℃恒温振荡培养至OD600为0.4,取1 ml留作诱导前对照,余加入IPTG至终浓度0.5 mmol/L,继续诱导3个小时,8 000 r/min离心10 min,弃上清,收集菌体,每克菌体沉淀加入15 ml过柱缓冲液,置冰浴中,超声波破菌3个周期(每个周期20次,每次3 s,间歇4 s),4℃12 000 r/min离心30 min,分别收集上清液及沉淀,SDS-PAGE电泳鉴定。
1.2.3 诱导条件的优化 将上述的单克隆培养液37℃振荡培养过夜后,按1∶100比例分别转种到含10 ml LB-Amp+培养液的大离心管中,分别按以下方法依次对诱导条件进行优化。(1)37℃分别培养1 h、2 h、3 h、4 h、5 h、6 h、7 h后,加入终浓度1 mmol/L的IPTG,转至37℃继续培养4 h;(2)37℃培养2 h后(前面实验表明此为较佳IPTG加入时机),加入终浓度为1 mmol/L的IPTG,分别在37℃、34℃和30℃继续诱导3个h;(3)37℃培养2 h后,加入终浓度为1 mmol/L的IPTG,将温度降至34℃(前面实验表明此为较佳诱导温度),分别继续诱导1 h、2 h、3 h、4 h、5 h、6 h;(4)37℃培养2 h后,分别加入IPTG至终浓度0.2、0.5、0.8、1.0、2.0和3.0 mmol/L。随后降低温度至34℃继续培养3 h(前面实验表明此为较佳诱导时间)。收集上述诱导产物并超声破菌后,取上清和(或)沉淀分别走12%SDS-PAGE电泳,Quantity one软件进行定量分析比较。
1.2.4 融合蛋白的分离纯化 方法按New England Biolabs公司的说明书进行。然而我们发现,这种方法获得的融合蛋白含有较多的杂带,估计为蛋白质降解的产物。为此,我们对诱导及纯化条件进行了改进,以抑制细菌蛋白酶的水解作用。具体如下:诱导时在培养液中加入0.2%的葡萄糖,破菌时加入1 mmol/L的PMSF,在冰浴中破菌,在4℃的环境中过柱洗脱。
最后将收集的蛋白洗脱液用SDS-PAGE电泳鉴定,并送测序。所得融合蛋白保存备用。
1.2.5 DC的制备与致敏 取健康人外周血50 ml并常规法分离外周血单个核细胞(PBMC),用RPMI1640完全培养基重悬细胞,置37℃、5%CO2培养箱培养4 h,吸出未贴壁细胞(供分离T淋巴细胞用),留下贴壁细胞,加入含100 ng/ml rh GM-CSF、50 ng/ml rhIL-4 及 10%FCS 的 RPMI1640 培养液,隔日半对量换液,同时加细胞因子(首次浓度的1/2),收集培养7 d的细胞,用光镜及电镜进行鉴定。将所得DC分为3组,分别加入20 mg的MBP-kinectin和20 mg的MBP蛋白共培养,还有一组为空白对照。培养3 d后收集各组上清液,按试剂盒说明书用ELISA方法检测IL-12和IFN-γ含量。
1.2.6 自体T淋巴细胞增殖能力观察 上述吸出的未贴壁细胞过T细胞尼龙毛柱后即得纯化的T淋巴细胞。将细胞稀释为1×105/ml,并分为3组,加入96孔板,每组设3个复孔,均设空白对照孔,然后分别加入上述的3组DC共孵育,每孔总量为200 μl。37℃、5%CO2培养96 h后每孔加入 MTT 20 μl,培养4 h,离心弃上清,加入DMSO 150μl/孔,轻微振荡,10 min后检测各孔光密度(OD)值。T淋巴细胞增殖能力以刺激指数(SI)表示,SI=实验孔OD值/空白对照孔OD值。
1.2.7 统计学分析 采用SPSS13.0软件,组间比较用方差分析,P≤0.05为差异有统计学意义。
2 结果
2.1 重组质粒的构建与鉴定 构建的重组质粒经蓝白斑实验、PCR鉴定及酶切鉴定后,送基因测序,结果表明,所插入目的基因序列及读码框架完全正确。
2.2 目的基因在宿主菌中的诱导表达 将重组质粒转入 TB1宿主菌,并经IPTG诱导后,SDSPAGE电泳显示,在66.2 k Da marker下方可见一诱导条带(图1),而未诱导的对照则未见有此条带。
Quantity one凝胶分析软件分析结果提示,目的蛋白分子量约为62.374 k Da,与 MBP-Kinectin理论分子量的61 k Da大致相符(图2)。目的蛋白约占菌体蛋白总量的12.9%(图3)。
2.3 诱导条件的优化 不同时机加入IPTG进行诱导的产物电泳结果见图4。图中,A为marker,B、C、D、E、F、G、H 分别为第1、2、3、4、5、6、7个小时后加入IPTG诱导的产物,I为DH5α工程菌于第2个小时加入IPTG诱导的对照,J为空白TB1菌于第2个小时加入IPTG诱导的对照。由图可见,TB1工程菌在37℃振荡培养两个小时后加入IPTG,诱导效果较好。经OD值检测,此时细菌的OD值约为0.4左右。
34℃条件下,诱导时间长短与目的蛋白表达百分含量的关系如图5所示。由图可见,在诱导的前3个小时,可溶性目的蛋白的百分含量并无显著差异,但随后则会急剧下降。
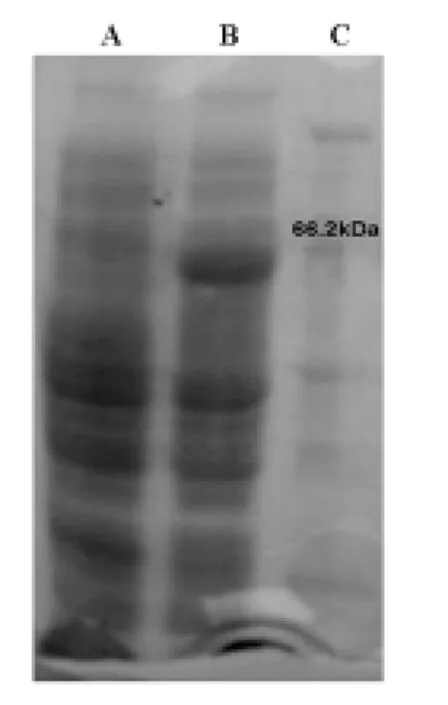
图1 诱导与未诱导产物的比较
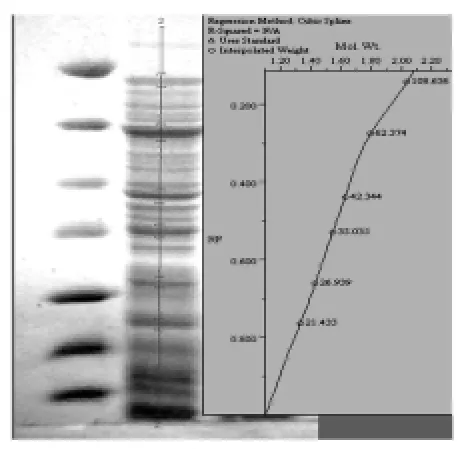
图2 目的蛋白的分子量 估算

图3 目的蛋白条带的光密度 分析
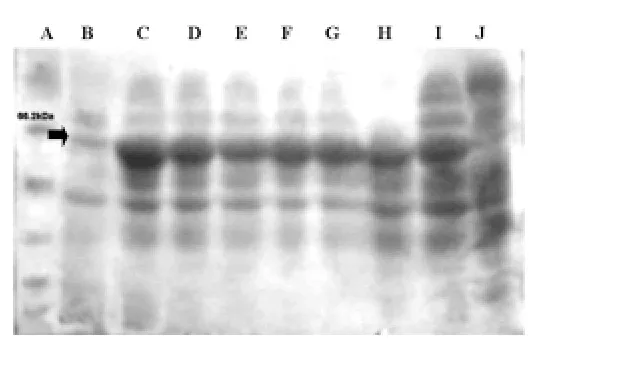
图4 不同时间加入IPTG诱导 的产物电泳图
目的蛋白表达百分含量与IPTG浓度的关系如图6所示。由图可见,当IPTG浓度在0.2-3.0 mmol/L之间变化时,可溶性目的蛋白的百分含量随IPTG浓度变化的改变并不是很明显。
2.4 融合蛋白的分离纯化 按说明书方法将上清液过柱纯化后,SDS-PAGE电泳结果如图7(左)所示:图中 A为 marker;B、C、D、E、F、G、H、I分别为第1、2、3、4、5、6、7、8管蛋白洗脱收集液;J为过柱穿透液;。由图可见,在目的条带的周围出现了较多的杂带。这些杂带蛋白的分子量主要介于36.0 k Da-66.2 k Da之间(即大致介于 MBP与 MBPKinectin之间),图7(右)为经过方法改良后收集的过柱洗脱液电泳图,图中A为marker,B为过柱穿透液,C、D、E、F、G、H 分别为第3、4、5、6、7管蛋白洗脱收集液。由图可见,蛋白杂带较前明显减少了。
将纯化后的融合蛋白送质谱测序分析,结果表明:1)重组蛋白的氨基酸序列完全正确;2)纯化产物中存在有一些融合蛋白的降解片断。
2.5 各组上清液中IL-12和IFN-γ含量的比较经共孵化后,各组上清液中IL-12和IFN-γ的含量分别为:MBP-kinectin组:(615.32±7.93)pg/ml、(544.28±7.17)pg/ml;MBP 组:(382.13±5.21)pg/ml、(308.46±6.44)pg/ml;空白对照组:(299.40±10.22)pg/ml、(228.03±6.70)pg/ml。MBP-kinectin组均高于MBP组和空白对照组,且三组相比,P均<0.05,差异有统计学意义。
2.6 各组T淋巴细胞增殖能力比较 MBP-kinectin组SI为53.14±0.62,MBP组为22.14±0.31,对照组为10.86±0.65。MBP-kinectin组高于MBP组和空白对照组,且三组相比,P均<0.001,差异有统计学意义。
3 讨论
kinectin是一种与囊泡转运相关的膜受体蛋白,其最早发现定位于鸡胚脑细胞的内质网膜上,主要参与了细胞内囊泡的转运[5]。后来,kinectin还陆续被发现与一些细胞内的功能及信号蛋白相关,如整合素、Rho家族蛋白、EF1复合体等。这些蛋白在细胞的分裂、分化及骨架构建中都发挥着极其重要的作用,可能与肿瘤的发生和发展密切相关[6-8]。本课题组罗国容等[2]用SEREX技术在肝癌患者血清中检测到了抗kinectin抗体。前期研究表明,其在肝癌患者中有较高的特异性和阳性率,提示,kinectin有可能用于对肝癌的免疫治疗。用基因工程方法获取大量的kinectin蛋白是对其进行深入研究的前提和基础。

图5 诱导时间和目的蛋白表达
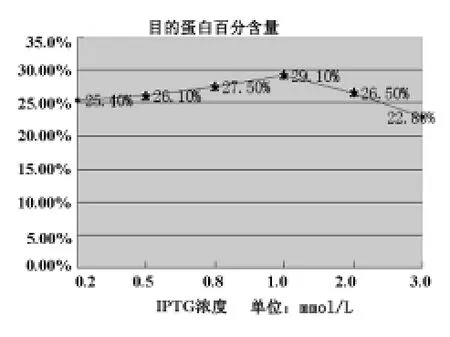
图6 IPTG浓度和蛋白表达百分 含量的关系图
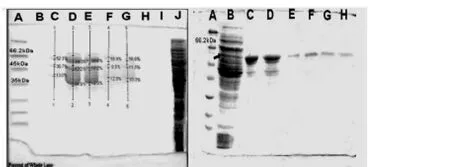
图7 过柱洗脱收集液电泳图
p MAL-C2载体系统是一种较好的抗原蛋白表达体系,影响重组质粒表达的因素有以下几方面[9]:1)温度是进行重组蛋白表达的基本平台,其主要通过影响蛋白质的合成速度、包涵体的形成概率及细菌蛋白酶对目的蛋白的水解活性来影响诱导效果。适宜的温度应兼顾蛋白的产量及可溶性蛋白的比例。本实验中,工程菌在34℃诱导时的目的蛋白产量较高;且34℃诱导时,可溶性目的蛋白含量可达菌体可溶性蛋白总量的17.8%,也远高于37℃时的13.3%。2)诱导时间长短也是影响重组蛋白表达的一个重要因素。诱导时间过短,蛋白表达量较少;但如果时间过长,则蛋白可能会被细菌蛋白酶降解。本实验中,当工程菌诱导1-3 h时,目的蛋白表达的百分含量无显著差异,但考虑到诱导时间较长时,菌体蛋白的总表达量会增多,目的蛋白的绝对量也较多,故选取3 h为较理想的诱导时间。3)IPTG的浓度对目的蛋白产量的影响也很大。IPTG浓度过低,可能会使诱导效应降低;但其浓度过高,则可能会对宿主菌产生强烈的毒性作用而抑制细菌的生长繁殖,从而使蛋白产量降低。然而本实验中:当IPTG浓度在0.2-3.0 mmol/L之间变化时,目的蛋白的百分含量并无明显差异,但通过加测菌液的OD值发现,当IPTG浓度为0.5 mmol/L时,OD值最高,可达1.6左右。从经济角度出发,并考虑蛋白的总产量,选用0.5 mmol/L浓度的IPTG进行诱导似为最妥。4)IPTG的加入时机是影响蛋白表达的另一个重要因素。在液体培养基中,细菌的生长通常包括迟缓期、对数生长期、稳定期和衰亡期四个阶段。在对数生长期时,细菌的OD值通常为0.3-0.6,此时细菌的生长最活跃,蛋白的合成速度也最快;此时加入IPTG进行诱导,效果最好。本实验中,当TB1菌37℃振荡培养2个小时后,其OD值为0.4左右,约相当于对数生长初期,此时加入IPTG诱导即可获得较高诱导表达效率。
经纯化后的蛋白,会出现一些杂带。通过分析,我们认为,杂带蛋白可能是MBP-kinectin融合蛋白的kinectin部分发生了降解(MBP蛋白非常稳定,不易降解),从而产生的分子量介于MBP和MBP-kinectin之间的降解产物。用获得的MBP-kinectin融合蛋白与DC共培养,可使DC产生较高水平的IL-12和IFN-γ,而IL-12是促进Th1分化最主要的细胞因子。用MTT法检测T淋巴细胞的增殖情况也证实,用MBP-kinectin致敏的DC确实能有效的刺激T淋巴细胞的增殖。这也为我们在后续实验中运用MBP-kinectin致敏DC诱导细胞毒性T淋巴细胞进行杀伤提供了可靠的理论依据。
[1]Stenner F,Luo G,Sahin U,et al.Definition of Tumor-associated Antigens in Hepatocellular CarcinomaCancer Epidemiology[J].Biomarkers & Prevention,2000,9(3):285.
[2]罗国容,刘启福,Frank Stenner,et al.自身血清抗体筛选人肝细胞癌抗原的分子辨认[J].中华医学杂志,1999,79(6):447.
[3]谢小薰,王延伟,黎 鹏,等.肝细胞癌相关抗原kinectin的血清学分析[J].科学技术与工程,2003,3(2):143.
[4]黄天明,黄绍明,莫发荣,等.肝癌相关抗原Kinectin基因片段的重组表达[J].广西医科大学学报,2006,23(3):345.
[5]Toyoshima I,Yu H,Steuer ER,et al.Kinectin,a major kinesinbinding protein on ER[J].J Cell Biol,1992,118(5):1121.
[6]Huan Tran,Roumen Pankov,Simon D.Tran,et al.Integrin clustering induces kinectin accumulation[J].Journal of Cell Science,2002,115(10):2031.
[7]E Vignal,A Blangy,M Martin,et al.Kinectin Is a Key Effector of RhoG Microtubule-Dependent Cellular Activity[J].Molecular and Cellular Biology,2001,21(23):8022.
[8]Lee-Lee Ong,Connie PN Er,Andrea Ho May T.Aung,et al.Kinectin Anchors the Translation Elongation Factor-1δto the Endoplasmic Reticulum[J].J.Biol.Chem.,2003,278(34):32115.
[9]Joseph Sambrook,David W.Russell,et al.Molecular Cloning-a laboratory manual(Third Edition)(影印版)[M].西安:世界图书出版公司,2002,3:15.14-15.19.

