Er:YAG激光照射后釉质结构和成分变化的研究
叶丽君,刘鲁川,周 霞,刘 锐,刘 宁,李向杰,王金川
(第三军医大学大坪医院野战外科研究所口腔科,重庆 400042)
近年来,激光技术广泛应用于医学各领域,尤其是在口腔医学中,应用激光进行去龋、制洞等方面的作用均已得到证实[1-2]。Er:YAG激光波长2940 nm,有很好的水吸收性,也可被羟基磷灰石吸收,因此可有效地切割牙体硬组织。因釉质的主要无机成分是钙和磷,根据Er:YAG激光的作用机理,经其照射后釉质表面的成分和结构也必然会发生变化。有鉴于此,本研究旨在观察Er:YAG激光不同能量和不同照射时间对釉质表面结构和成分的影响,为进一步的临床研究提供依据。
1 材料和方法
1.1 主要仪器
Er:YAG激光(DEKA,意大利);高速涡轮机(NSK,日本);体视显微镜(SMZ1500,日本);能量色散型X射线荧光光谱(EDX720,美国);扫描电子显微镜(AMRAY-1000B,美国)。
1.2 方法
1.2.1 釉质样本制备
选取15~25岁志愿者因正畸减数拔除的牙冠完整、无龋、无裂纹的前磨牙,刮除表面软组织和牙石,超声清洗后,用高速涡轮机和0.3 mm金钢砂片自釉牙骨质界处截去牙根,将牙冠按近中远中向和颊舌向作“+”形纵向切开,制成4 mm×4 mm×2.5 mm大小的釉质块104个。分别用240、400、600、800目砂纸依次打磨釉质,使其表面光滑无附着物。4℃生理盐水储存备用,储存时间<4周。
1.2.2 实验分组和激光照射
从104个釉质样本中随机抽取8个用于空白对照(C组),另96个样本随机分为A(照射10 s)和B(照射20 s)两大组,每一大组再按功率随机分为 1、2、3、4、5、6 W 6 个亚组,每个亚组 8 个样本。然后将A、B两大组所有样本固定于石蜡上(釉质面向上),用Er:YAG激光在20 Hz频率下,按相应分组(不同功率和不同照射时间)分别对每个样本进行照射。照射时激光机头用三脚架固定,对准样本中央,光纤距釉质表面1 cm并与之垂直,同时以5 mL/min的量喷水。
1.2.3 釉质表面形态观察
对照射完成后的A、B两组样本分别用体视显微镜放大100倍观察其表面形态,并用与之配套的成像系统测量每个样本表面经激光照射形成的凹坑直径。然后,再在体视显微镜下用高速涡轮机和0.3 mm的金钢砂片将每个样本沿凹坑中央纵切成两半,用配套的成像系统测量其凹坑洞边缘到坑底的距离作为凹坑的深度。
1.2.4 化学成分测量
取A、B、C 3组所有样本,用能量色散型X射线荧光分析仪定点测量实验组凹坑部位和空白组样本表面部位的Ca、P含量。
1.3 统计学分析
2 结果
2.1 激光照射后釉质表面形态变化
A、B两组样本经Er:YAG激光以1~6 W不同能量分别照射10 s(A组)和20 s(B组)后,所有样本表面均产生消融性凹坑,其表面有不同程度的粗糙颗粒,凹坑底部呈不平坦状态,但未出现明显的炭化现象。
2.2 凹坑直径和深度的变化(表1)
在激光频率相同的情况下,随功率和照射时间的增大,凹坑直径和深度均相应增加。相同功率下不同照射时间相比,无论是直径还是深度,均是B组大于A组,差异均有统计学意义(P<0.05)。同一照射时间组内不同功率相比,凹坑直径和深度均有随功率增大而增大的趋势。
表1 不同照射时间和功率各组釉质表面凹坑直径、深度比较(mm,)
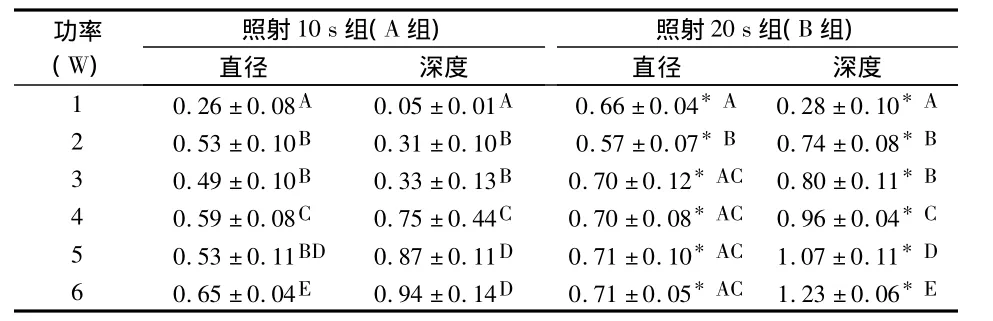
表1 不同照射时间和功率各组釉质表面凹坑直径、深度比较(mm,)
不同字母为组内不同功率间比较P<0.05;*为同一功率下B组和A组相比P<0.05
功率(W)照射10 s组(A组)照射20 s组(B组)直径 深度 直径 深度1 0.26 ±0.08A 0.05 ±0.01A 0.66 ± 0.04*A 0.28 ±0.10*A 2 0.53 ±0.10B 0.31 ±0.10B 0.57 ±0.07*B 0.74 ±0.08*B 3 0.49 ±0.10B 0.33 ±0.13B 0.70 ± 0.12*AC 0.80 ±0.11*B 4 0.59 ±0.08C 0.75 ±0.44C 0.70 ± 0.08*AC 0.96 ±0.04*C 5 0.53 ±0.11BD 0.87 ±0.11D 0.71 ± 0.10*AC 1.07 ±0.11*D 6 0.65 ±0.04E 0.94 ±0.14D 0.71 ± 0.05*AC 1.23 ±0.06*E
2.3 Ca、P含量和Ca/P比值的变化(表2)
在激光频率相同的情况下,随功率和时间的增大Ca、P含量和Ca/P比值变化显示A组和B组经不同功率照射后釉质表面均明显高于空白对照组,Ca、P含量差异有统计学差异(P<0.05);但Ca/P比值均与空白对照组无统计学差异(P>0.05)。A组与B组相比,Ca含量仅2 W时,有显著差异;P含量仅5 W和6 W时有显著差异,其他各组间以及所有组Ca/P比值A、B之间相比均无统计学差异(P >0.05)。
表2 不同照射时间和功率各组Ca、P含量(%)Ca/P比较()

表2 不同照射时间和功率各组Ca、P含量(%)Ca/P比较()
不同字母为组内不同功率间比较P<0.05;*为同一功率下B组和A组相比P<0.05
功率(W)P Ca A组 B组A组 B组Ca/p A组 B组0 27.29 ±2.44A27.29 ±2.44A 15.49 ±0.35A15.49 ±0.35A 1.75 ±0.15A 1.75 ±0.15A 1 30.57 ±2.08B29.67 ±0.57B 17.42 ±0.05B17.48 ±0.33B 1.76 ±0.12A 1.70 ±0.04A 2 30.83 ±1.42B29.50 ±0.51B 17.27 ±0.14B17.13 ±0.31B 1.79 ±0.09A 1.72 ±0.03A 3 30.15 ±0.68B29.70 ±0.38B 16.85 ±0.30B16.99 ±0.28B 1.79 ±0.05A 1.76 ±0.03A 4 30.06 ±0.80B29.29 ±0.73B 17.22 ±0.21B16.96 ±0.22B 1.75 ±0.04A 1.73 ±0.05A 5 30.09 ±0.85B29.66 ±0.24B 17.11 ±0.22B16.86 ±0.20B*1.76 ±0.04A 1.76 ±0.02A 6 29.65 ±0.43C29.28 ±0.74B 16.54 ±0.40B16.85 ±0.24B*1.79 ±0.03A 1.74 ±0.04A*
3 讨论
制洞是进行牙体牙髓治疗的必要步骤。但使用高速涡轮机和牙钻制洞时,常会磨除过多的健康牙体组织,而且还会产生敏感和疼痛。自激光引入口腔治疗以来,已有不同的激光系统应用于临床。其中Er:YAG激光不仅可用于软组织处理,还能有效切割牙体硬组织进行制洞后釉质和牙本质边缘清洁[2]。其机理主要是激光产生的光热效应,被牙齿中的水和羟磷灰石吸收后,产生微爆炸,使釉质结构破碎,形成牙体切割的效果[3]。大量的文献与其他激光相比,Er:YAG激光对釉质的消融效率更高,且不易损害健康牙体组织,同时还具有减少脱矿的作用[4-5]。
有研究认为:激光对牙体硬组织的消融率主要受照射时间和强度等因素的影响[6]。Corona等[1]用不同能量的Er:YAG激光照射釉质,观察其消融率和形态的变化,结果显示能量的增加和釉质消融效率和形态的变化成正比关系,认为激光照射牙体硬组织的不同参数是提供临床治疗的重要指标。本研究选用的参数参考临床上的应用,实验结果显示:随着激光能量和照射时间的增加,直径和深度均呈上升的趋势,但照射20 s时(B组),凹坑直径从3 W以后趋向稳定,而深度仍保持稳定上升趋势,其部分原因可能与有机物从牙齿的表面向深部逐渐递增有关。另外,在照射过程中髓腔温度的变化也值得注意,我们在前期的实验和借鉴国外的研究,认为在本研究的界定范围内髓腔温度变化均在安全阈值内[7]。
釉质主要由无机物、有机物和水组成,其中钙、磷等无机物的含量所占比例最大[8]。波长2940 nm的Er:YAG激光除了有很好的水吸收性,而且在照射时可被羟基磷灰石吸收,故可以有效地切割牙体硬组织。但是,激光照射后釉质表面的化学成分有无变化一直是学者们关注的重点[4,9]。Choeysuppaket[9]报道:Er:YAG 激光照射可减少釉质和牙本质的有机物和无机物。一般来讲,Ca/P比值越高,磷酸盐含量越高,钙化组织沉积越稳定。Bevilácqua等[10]研究发现:利用 Er:YAG 激光和氟化物结合照射釉质,可以减少釉质的酸溶解度,从而防止釉质的脱矿。本研究结果显示:激光照射后,釉质表面的 Ca、P含量均明显高于空白对照组,这可能是因为激光在照射时釉质表面能瞬间达到300~400℃,使牙体表面水分减少和有机物质的熔化和膨胀,从而降低了Ca、P的溶出率,使激光照射后的釉质Ca、P含量相对增高。实验组和对照组的Ca/P比值相比没有明显差别,可能因为牙体硬组织中的主要无机物钙和磷多以HA的形式存在[8],其分子中Ca/P比值恒定。同时还表明激光照射后的釉质表面仍以HA晶体形式存在。
Er-YAG激光和传统的涡轮机相比可以达到无噪音、无振动和无疼痛的效果,且在治疗中具有出血量少、不用接触组织,减少感染机会和疼痛,从而缓解紧张。在本研究界定的范围内,选择合适的参数制洞,不会造成组织的炭化和牙髓的损害。但激光参数、有无喷水和喷水量的选择、激光机头照射距离、照射时间等因素的选择都会影响牙体组织结构和成分的变化,因此在今后的研究中需要更详细的探索和证实。
[1]Corona SA,Souza-Gabriel AE,Chinelatti MA,et al.Influence of energy and pulse repetition rate of Er:YAG laser on enamel ablation ability and morphological analysis of the laser-irradiated surface[J].J Biomed Mater Res A,2008,84(3):569-575.
[2]Kilinc E,Roshkind DM,Antonson SA,et al.Thermal safety of Er:YAG and Er,Cr:YSGG lasers in hard tissue removal[J].Photomed Laser Surg,2009,27(4):565 -570.
[3]Mahajan A.Lasers in periodontics-a review[J].Euro J Dent,2010,3(1):1 -11.
[4]Altinok B,Tanboga I,Peker S,et al.The effect of laser-activated acidulated phosphate fluoride on enamel submitted to erosive solution only:an in vitro preliminary evaluation[J].Eur J Paediatr Dent,2011,12(1):13 -16.
[5]Watanabe T,Iwai K,Katagiri T,et al.Synchronous radiation with Er:YAG and Ho:YAG lasers for efficient ablation of hard tissues[J].Biomed Opt Express,2010,1(2):337 -346.
[6]George R.Laser in Dentistry-Review [J].Int J Dent Clin,2009,1(1):13 -19.
[7]Krmek SJ,Miletic I,Simeon P,et al.The temperature changes in the pulp chamber during cavity preparation with the Er:YAG laser using a very short pulse[J].Photomed Laser Surg,2009,27(2):351-355.
[8]樊明文.牙体牙髓病学[M].北京:人民卫生出版社,2001:209-212.
[9]Choeysuppaket A,Pokaipisit A,Limsuwan P.Compositional changes of enamel and dentine after Er:YAG iaser irradiation[J].Adv Mater Res,2010,93(1):529 -532.
[10]Bevilácqua FM,Zezell DM,Magnani R,et al.Fluoride uptake and acid resistance of enamel irradiated with Er:YAG laser[J].Lase Med Sci,2008,23(2):141 -147.

