不同浓度肿瘤坏死因子对人牙周膜细胞增殖和碱性磷酸酶活性的影响
郝立辉
(邢台医学高等专科学校口腔系,河北邢台 054000)
牙周膜细胞是一组由成纤维细胞、成骨细胞、成牙骨质细胞和未分化的间充质干细胞等多种细胞成分组成的异质性细胞群,具有合成新生牙周组织的潜能[1]。在正常条件下牙周膜细胞具有一定的增殖和分化能力,对牙周支持组织的发育、功能维持和再生发挥重要作用。
牙周炎是通过多种炎性因子和细胞毒性作用对牙周组织产生的破坏性影响,造成胶原纤维降解、牙槽骨吸收等病理性变化,细菌等外界刺激造成炎性因子如IL-1β、TNF-α等在局部产生,活化T、B淋巴细胞和巨噬细胞产生破坏作用,导致牙周组织中的RANKL/RANK/OPG调节系统失衡,最终造成牙周膜、牙槽骨破坏[2]。有研究报道:炎症因子可影响细胞的增殖和分化[3],本研究将着重研究不同浓度TNF-α对人牙周膜细胞增殖和分化的影响,以探讨炎症因子在牙周组织再生中发挥的作用。
1 材料和方法
1.1 主要试剂和仪器
胎牛血清(FBS)、DMEM培养基、胰蛋白酶、胶原酶、Dispase酶、谷氨酰胺、青链霉素(Gibco,美国);外源肿瘤坏死性因子(TNF-α,Peprotech,美国);兔抗人波形丝蛋白和角蛋白、羊抗兔荧光二抗(Abcam,美国);免疫组化试剂盒 (生物晶美公司);MTT(Sigma公司 ,美国);二甲基亚砜(DMSO,天津汇英化学试剂有限公司);酶联免疫检测仪(Bio Tek公司,美国);碱磷酶试剂盒(南京建成);实时定量PCR检测仪和荧光染料(Toyobo Co.,LTD.Osaka)。
1.2 人牙周膜细胞(HPLCs)的体外培养和鉴定
取因阻生或正畸需要拔除的前磨牙,在超净工作台中用0.01 mol/L PBS冲洗5~7次后,刮取根中/下1/3的牙周膜,剪成 1 mm×1 mm×1 mm的组织块,Ⅰ型胶原酶消化 15 min,置离心管内800 r/min离心5 min弃上清后,重悬并放置在6孔板中(含 150 mL/L FBS、100μmol/L 抗坏血酸、0.292 mg/mL谷氨酰胺、100 units/mL 青霉素/链霉素的 α-MEM 培养基)。在37℃、50 mL/mL CO2、饱和湿度条件下培养3~7 d,待细胞从组织块边缘爬出并生长达80%汇合时,用胰蛋白酶/EDTA(2.5 g/L,pH=6.4)消化传代。
取第2代生长良好的HPDLCs胰酶消化后,以2×104/孔的密度接种于24孔培养板,待细胞贴壁24 h后,用40 g/L多聚甲醛室温下固定20 min后进行免疫荧光染色鉴定。兔抗人波形丝蛋白一抗浓度为1∶200;角蛋白浓度为1∶150,避光滴加FITC标记的羊抗兔(1∶200),孵育完成后,Hoechst 33342(50 g/mL,Sigma)衬染细胞核15 min。荧光显微镜下观察,用 DP controller(Olympus)和 DP manager软件处理图像。
1.3 不同浓度肿瘤坏死因子(TNF-α)对人牙周膜细胞增殖的影响
取第4代HPDLCs,待细胞贴壁后PBS冲洗细胞3遍,在常规培养液中分别加入TNF-α(1、5、10、20 ng/mL),PDLCs加入等量PBS作为对照组(0 ng/mL),每2 d半量换液。
1.3.1 MTT 法检测 HPDLCS活性
取第4代对数生长期HPDLCs,经胰蛋白酶消化后离心,用含10 mL/L FBS的α-MEM制成细胞悬液,以5×103/孔接种于96孔培养板,标准条件下进行培养。弃原培养液,将细胞随机分为5组(1个对照组和4个实验组),每组复3孔。4个实验组分别加入含 TNF-α 终末浓度为 1、5、10、20 ng/mL的α-MEM培养液;对照组加入等量不含TNF-α的α-MEM培养液,继续培养,每2 d半量换液 1 次。分别于培养后 0、1、2、3、4、5、6、7 d 各时间点,用MTT法测定 HPDLCs的增殖能力。每孔加入100 μL 5 mg/mL MTT液,置50 mL/L CO2孵箱中,37℃孵育4 h后,吸净孔内液体,加入500 μL二甲基亚砜振荡器震荡15 min,在酶联免疫检测仪上测量波长490 nm的光密度(OD)值。
1.3.2 实时定量PCR检测HPDLCs周期蛋白D1(Cyclin D1)mRNA的表达
取第4代 PDLCs以1×104/mL密度接种于T25 cm 培养瓶,分别用0、1、5、10、20 ng/mL 不同浓度TNF-α刺激72 h后提取 RNA,进行逆转录反应。逆转录所得 cDNA进行荧光定量 PCR检测,目的基因及管家基因在不同的反应管中进行扩增,反应体系均为20 μL。Cyclin D1上游引物序列:5'-TGATGCTGGGCACTTCATCTG -3';Cyclin D1 下游引物序列:5'-TCCAATCATCCCGAATGAGAGTC-3';ACTIN上游引物序列:5'-TGGCACCCAGCACAATGAA-3';ACTIN下游引物序列:5'-CTAAGTCATAGTCCGCCTAGAAGCA-3'。反应条件:95℃变性20 min,95℃ 30 s,60℃ 1 min,40个循环。T7500型实时荧光定量 PCR仪检测记录数据,结果根据标准曲线由软件自动计算后得出。实验进行3次重复。
1.4 不同浓度 TNF-α 对 HPDLCs碱性磷酸酶(ALP)活性的影响
取第4代 PDLCs以2×103/孔的密度接种于96孔板,加入含100 mL/L FBS的α-MEM培养液(200 μL/孔),于37 ℃、5 mL/L CO2培养箱中培养24 h,待细胞贴壁伸展后,弃原液,将细胞随机分为5组,分别加入含 TNF-α 终末浓度为 0、1、5、10、20 ng/mL的α-MEM培养液,继续培养72 h后,用碱性磷酸酶试剂盒进行ALP活性的分析。具体方法如下:①吸去培养液,细胞用0.01 mol/L的PBS洗涤3次;②吸干,每孔加入50 μL的2 g/L的TritonX-100,37℃,30 min,裂解细胞;③每孔加入ALP 试剂盒标准液50 μL,底物缓冲液50 μL,37 ℃30 min;④每孔加入底物终止液150 μL,用酶联仪检测520 nm的光密度(OD)值。时间为横座标,吸光度值为纵座标,绘制ALP变化曲线。本研究进行3次重复。
1.5 统计学分析
分析SPSS 13.0统计软件进行统计分析,两组间比较用独立样本t检验,检验水准α=0.05。
2 结果
2.1 人牙周膜细胞原代培养和鉴定
采用组织块培养法原代培养48 h后,可见细胞从组织块边缘爬出,细胞呈长梭形、椭圆形及铺路石样(图1)。传至第3代时细胞生长旺盛,形态为纺锤形或成纤维细胞样,细胞直径约100 μm左右,胞浆透明,整体呈旋涡状生长(图2)。对第2代牙周膜细胞进行免疫荧光染色鉴定,抗波形蛋白染色后可见胞浆内绿色荧光表达,说明波形丝蛋白染色呈阳性阳性(图3);抗角蛋白染色呈阴性(图4),符合间叶来源细胞特征。
图1 牙周膜细胞原代培养(×40)

图2 第3代细胞呈长梭形旋涡状生长(×40)
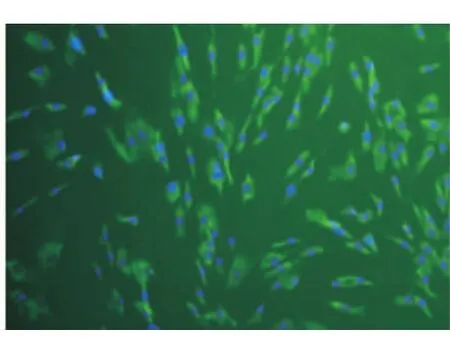
图3 波形丝蛋白染色阳性(×40)
图4 角蛋白染色阴性(×40)
2.2 不同浓度TNF-α对HPDLCs细胞增殖的影响
培养0~2 d各浓度TNF-α刺激组与对照组细胞增殖活性无显著差别(P>0.05),3~7 d时,1 ng/mL和5 ng/mL TNF-α对HPDLCs增殖均有一定促进作用,与对照组相比,差异有统计学意义(P <0.05);在10 ng/mL和20 ng/mL TNF-α 刺激下,HPDLCs增殖活性明显降低,与对照组相比,3~7d各时间点差异均有统计学意义 (P<0.05)(图5)。
2.3 不同浓度TNF-α对HPDLCs周期蛋白D1表达的影响
1、5、10、20 ng/mL TNF-α 刺激 HPDLCs 72 h后,其Cyclin D1的表达均发生变化,与对照组相比1、5 ng/mL浓度Cyclin D1 mRNA表达水平显著增高(P<0.05),其中5 ng/mL组升高最明显,约为对照组的1.73倍;随着 TNF-α 浓度的增加,Cyclin D1mRNA的表达呈降低趋势,10 ng/mL、20 ng/mL组cyclin D1 mRNA表达量较对照组显著降低(P<0.05),其中20 ng/mL组降低幅度最大(图6)。
2.4 不同浓度TNF-α对HPDLCs ALP活性的影响
低浓度(1、5 ng/mL)TNF-α刺激 HPDLCs 72 h后,细胞 ALP活性均较对照组明显增高(P<0.05),其中5ng/mL组升高最显著;10 ng/mL及20 ng/mL组细胞ALP活性均较对照组明显降低(P<0.05),其中20 ng/mL组降低幅度最大(图7)。
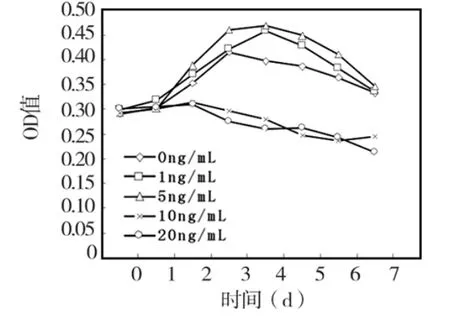
图5 不同浓度TNF-α对 HPDLCs细胞增殖活性的影响

图6 不同浓度TNF-α对HPDLCs周期蛋白D1mRNA表达的影响
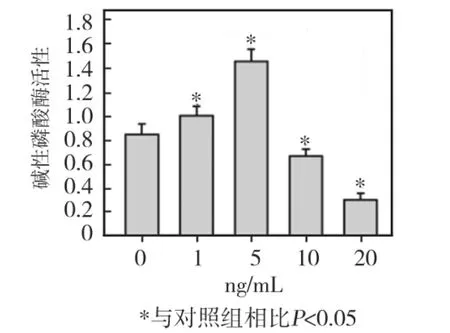
图7 不同浓度TNF-α对HPDLCs ALP活性的影响
3 讨论
牙周膜细胞是具有多种生物学功能和分化潜能的细胞群,是牙周组织再生修复的重要细胞。大量研究表明,在牙周炎造成的组织损伤过程中,TNFα和IL-1β作为主要炎症因子影响组织的再生[4]。牙周组织包括牙龈、牙周膜、牙槽骨等多种软硬组织在炎症因子(TNFα、IL-1β)作用下均可造成损伤。有研究表明,用LPS体外刺激牙周膜细胞后可诱导牙周膜细胞分泌TNFα和IL-1β,同时这两种炎症因子的基因表达也显著升高[5]。Rossa等[6]报道,利用炎症因子可以体外模拟牙周炎导致的炎症微环境,在炎症微环境中牙周膜细胞表达MMP-13,同时p38 MAPK可负向调控MMP13的表达[6]。
近期相关研究表明,炎症微环境可以改变细胞的功能[7],牙周膜细胞是牙周组织再生的关键细胞,不同的炎症因子对其刺激后可以导致细胞增殖、分化或引起细胞凋亡。本研究采用不同浓度的TNF-α对牙周膜细胞进行刺激结果显示,TNF-α在一定浓度范围内可提高牙周膜细胞增殖活性,但是当浓度增加至10 ng/mL及20 ng/mL时细胞的增殖活性受到了显著抑制,其中以20 ng/L效果最为显著。Cyclin D1是一种重要的细胞周期蛋白,在细胞增殖中起正性调控作用,Cyclin D1通过与CDK4和CDK6形成复合体,而使Rb蛋白磷酸化 ,促进 G1/S期转移,当Cyclin D1蛋白高表达时,就会导致细胞增殖[8]。本结果显示,低浓度TNF-α刺激可促进牙周膜细胞增殖。其原因可能是,当细胞受到炎症刺激时可激活调控细胞增殖的Wnt信号通路[9];另外牙周膜细胞群具有一定的免疫调节能力,炎症刺激可启动其免疫调节机制也可以导致细胞增殖[10]。但是随着TNF-α浓度的增高,HPDLCs增殖活性和细胞周期蛋白表达都受到了不同程度的抑制,可能是由于TNF-α刺激后部分TNF-α与其在细胞膜上的受体结合转移到细胞内,从而以活化NFk-β信号通路,导致细胞的凋亡。
牙周膜细胞的成骨表型特点包括表达高水平的碱性磷酸酶、转化生长因子β1、降钙素、细胞外基质蛋白以及形成矿化结节等。Fujita等[11]发现外源性炎症因子能显著降低牙周膜细胞ALP活性,并影响牙周膜细胞的分化、增殖和相关基质蛋白的形成,认为炎症微环境中的关键炎症因子可能通过抑制牙周膜细胞的增殖、分化和合成基质蛋白等在牙周组织的修复和损伤中发挥重要作用。本研究发现10、20 ng/mL浓度的TNF-α刺激后HPDLCs ALP表达显著降低,提示在牙周炎的发展过程中,炎症因子的分泌增加也可直接影响ALP的合成,从而影响矿化基质的形成,可能是导致牙周病引起软硬组织损伤的关键因素。
[1]Pavasant P,Yongchaitrakul T.Role of mechanical stress on the function of periodontal ligament cells[J].Periodontol,2011,56(1):154-165.
[2]Mitsuhashi M,Yamaguchi M,Kojima T,et al.Effects of HSP70 on the compression force-induced TNF-α and RANKL expression in human periodontal ligament cells[J].Inflamm Res,2011,60(2):187-194.
[3]Shu L,Guan SM,Fu SM,et al.Estrogen modulates cytokine expression in human periodontal ligament cells[J].J Dent Res,2008,87(2):142-147.
[4]Choi YG,Seok YH,Yeo S,et al.Protective changes of inflammation-related gene expression by the leaves of Eriobotrya japonica in the LPS-stimulated human gingival fibroblast:microarray analysis[J].J Ethnopharmacol,2011,135(3):636 -645.
[5]Ishikado A,Uesaki S,Suido H,et al.Human trial of liposomal lactoferrin supplementation for periodontal disease[J].Biol Pharm Bull,2010,33(10):1758 -1762.
[6]Rossa C Jr,Liu M,Patil C,et al.MKK3/6-p38 MAPK negatively regulates murine MMP-13 gene expression induced by IL-1beta and TNF-alpha in immortalized periodontal ligament fibroblasts[J].Matrix Biol,2005,24(7):478 -488.
[7]Suzawa M,Takada I,Yanagisawa J,et al.Cytokines suppress adipogenesis and PPAR-gamma function through the TAK1/TAB1/NIK cascade[J].Nat Cell Biol,2003,5(3):224 -230.
[8]Jantscher F,Pirker C,Mayer CE,et al.Overexpression of Aurora-A in primary cells interferes with S-phase entry by diminishing Cyclin D1 dependent activities[J].Mol Cancer,2011,16(10):28-40.
[9]Zhong N,Gersch RP,Hadjiargyrou M.Wnt signaling activation during bone regeneration and the role of dishevelled in chondrocyte proliferation and differentiation[J].Bone,2006,39(1):5 -16.
[10]Kim HS,Kim KH,Kim SH,et al.Immunomodulatory effect of canine periodontal ligament stem cells on allogenic and xenogenic peripheral blood mononuclear cells[J].J Periodontal Implant Sci,2010,40(6):265 -270.
[11]Yoshihara R,Shiozawa S,Fujita T.Tumor necrosis factor alpha and interferon gamma inhibit proliferation and alkaline phosphatase activity of human osteoblastic SaOS-2 cell line[J].Lymphokine Res,1990,9(1):59-66.

