机械牵张力对人成骨样细胞糖链影响的初步研究
李少妮,崔继红,李菲菲,陈富林,李 铮,冯 雪
(陕西西安:1.第四军医大学口腔医学院,710032;2.西北大学生命科学院,710069)
近年来,对于正畸骨改建越来越重视,机械力学刺激不仅对骨骼系统的生长发育、正常骨量的维持、骨折修复和塑型都具有极为重要的作用[1-2],同时也可作为一种胞外信号传递至细胞内,引起细胞内信号的级联反应,进而调节细胞增殖、分化、分泌等生物学效应[3-4]。针对机械刺激成骨细胞的研究多在基因层面[5],对细胞表面糖谱的研究却很少涉及。解析细胞表面糖谱,将有助于解析糖基化修饰下隐藏的重要生命现象[6]。本研究以Flexcell细胞应力培养系统对人成骨肉瘤MG-63细胞施以不同加载时间的周期性张应变,利用凝集素芯片技术对不同加载时长成骨样细胞的糖蛋白糖谱的影响进行研究,筛选出糖蛋白糖谱中差异表达糖蛋白糖链,从而分析糖蛋白糖链在不同加载时长情况下与骨改建中细胞信号转导的关系。
1 材料和方法
1.1 主要材料和仪器
人成骨肉瘤 MG-63细胞(ATCC,MI,美国);MEM(北京赛默飞世尔公司);胎牛血清(北京民海生物公司);6孔弹性基底膜培养板(Flexcell,美国);BCA蛋白定量试剂盒(武汉博士德公司);Cy3荧光染料(Amerhsma公司,美国);76 mm×25 mm×1 mm玻璃片基(Gold Seal公司);37种凝集素(表1);FX-4000T细胞加载装置(Flexcell公司,美国);晶芯 SmartArrayer48点样仪(北京博奥生物公司);杂交箱HL-2000(UVP公司,美国);生物芯片扫描仪4000B(Axon,美国)。
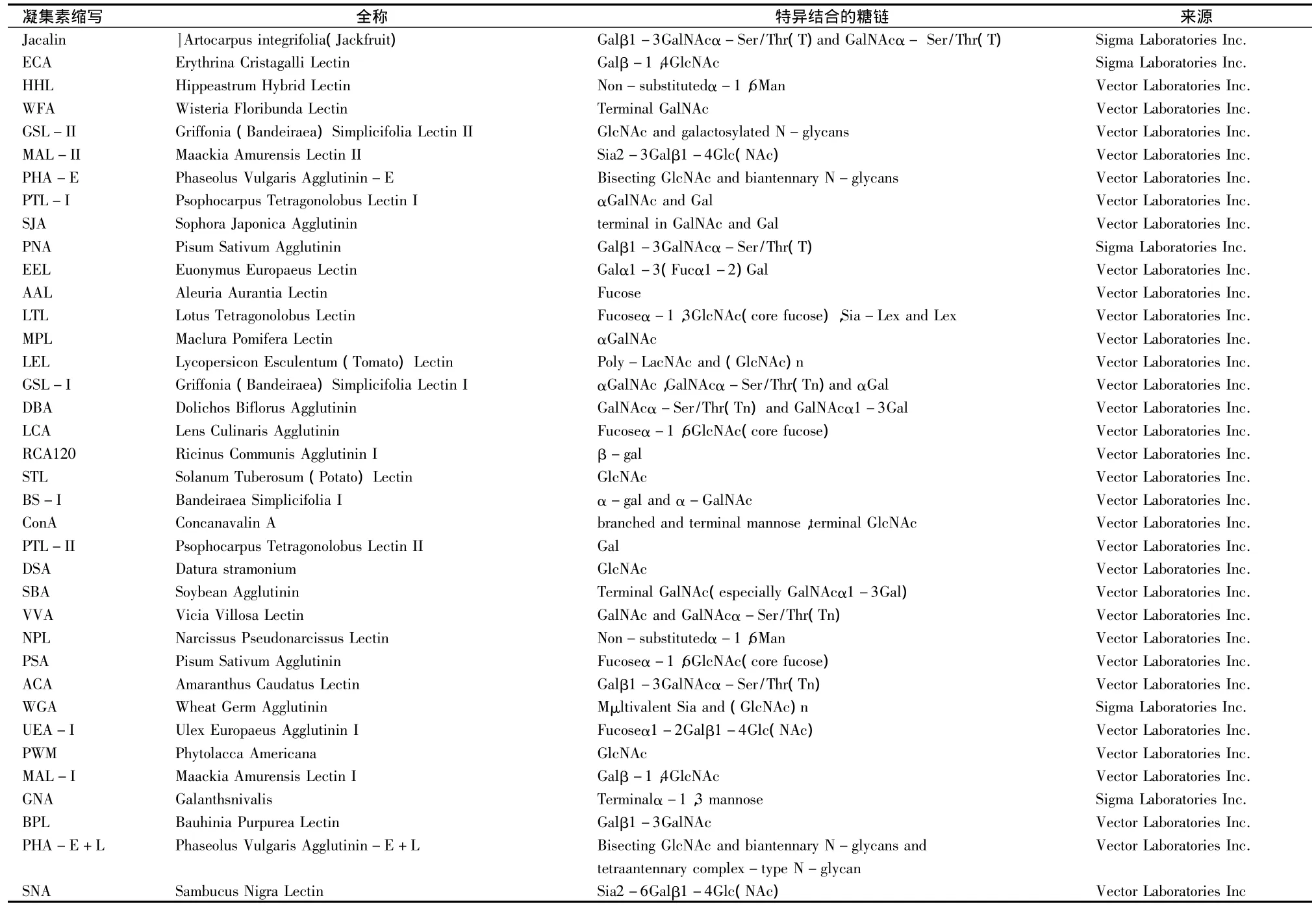
表1 凝集素及其特异结合糖链
1.2 细胞培养和加力
取MG-63细胞用MEM培养基(含有100 mL/L FBS、100 IU/mL 青霉素、100 μg/mL 链霉素),在37℃、50 mL/L CO2培养箱中培养,待细胞贴壁生长后,以2×105/孔接种于Ⅰ型胶原包被的BioFlex弹性基底膜6孔板内,继续培养至细胞生长融合达到80%时,更换含20 mL/L FBS的MEM培养液继续培养24 h,使细胞同步化。然后,将细胞随机分为4个实验组和1个对照组,4个实验组采用FX -4000T细胞加载系统分别加载 4、8、12、24 h。加载条件:形变率为12%,波形为正弦波,频率为0.1 Hz。对照组不加载,在相同条件下静态培养。
1.3 提取总蛋白
取对照组和各实验组培养板,分别于每孔加入100 μL裂解液;充分吹打,冰上裂解细胞30 min;将溶液转入1.5 mL EP管中12000 r/min 4℃离心20 min,吸取上清分装做下游分析;用BCA法定量后分装保存于-20℃。
1.4 凝集素芯片检测糖链差异
1.4.1 凝集素芯片的制备
将37种凝集素分别溶于点样缓冲液中,BSA做阴性质控,Cy3标记BSA做位置标记,每种凝集素重复3次,用晶芯48点样系统以10×12的矩阵点制于环氧化修饰的玻片上。再在60%湿度中孵育3 h,37℃抽真空干燥3 h,备用。
1.4.2 凝集素芯片的荧光标记
各取100 μL对照组和各实验组总蛋白分别与100 μL Na2CO3混匀,将混合液与Cy3荧光染料孵育标记,Sephadex G-25柱分离纯化Cy3标记蛋白。收取标记后蛋白,测定偶联荧光蛋白浓度。
1.4.3 凝集素芯片孵育
吸取Cy3标记后的对照组和各实验组细胞总蛋白各 20 μL 与 180 μL 含 0.05%Tween-20 和10 g/L BSA的PBS混匀,吸取50 μL混匀液覆盖点样区,加盖玻片孵育3 h,之后分别用含0.05%Tween-20的10 mmol/L的PBST和10 mmol/L PBS各清洗2次,每次2 min,最后离心甩干芯片。
1.4.4 数据扫描和分析
用GenPix 4000B芯片扫描仪扫描芯片,光电倍增管PMT设为100%,先进行预扫描,调节明亮度和对比度,使达到最佳视觉效果,然后选定点样区域,进行精确扫描。用GenePix 3.0软件从扫描结果图中获取荧光信号强度值和背景值等信息进行分析。
1.4.5 统计学分析
每个点的荧光信号读数减去背景荧光读数之后所得的值纳入后续统计学分析。采用中位值矫正的方法,对不同芯片的荧光读数进行荧光偏差矫正。矫正后的值每3个重复点计算均值和离均差,再经SPSS17.0软件进行t检验分析,α=0.05。
2 结果
2.1 凝集素芯片
从芯片扫描图中,获得对照组和各实验组的荧光信号,凝集素芯片上每个点9个重复。在对照组细胞中EEL与其糖蛋白有最大结合,而在8 h实验组细胞中ACA与其糖蛋白有最大结合(图1)。

图1 细胞对照组和加力实验组总蛋白凝集素芯片扫描结果
2.2 糖谱差异分析
对照组和实验组数据经归一化处理后,得出均数和标准差,发现8 h实验组差异表达的凝集素最多,其中GSL-Ⅰ对应 Ratio值最大,达36,说明其对应糖链表达升高最显著。GSL-Ⅰ特异性识别的糖链为 αGalNAc,GalNAcα-Ser/Thr(Tn)and αGal,说明在成骨细胞受机械加载8 h后该结构大量增加。以Ratio值<0.5视为表达降低,则8 h加载后STL对应Ratio值最小,说明其对应糖链表达降低最显著。STL特异性识别糖链结构为GlcNAc,说明在8 h机械加载后该结构大量减少(表2,图2)。
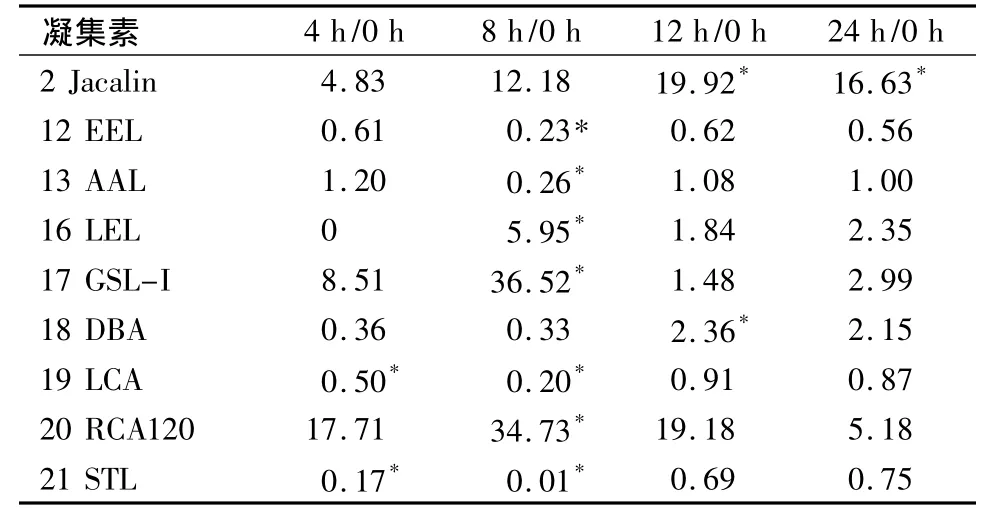
表2 不同加载时长凝集素差异表达对应糖链Ratio值
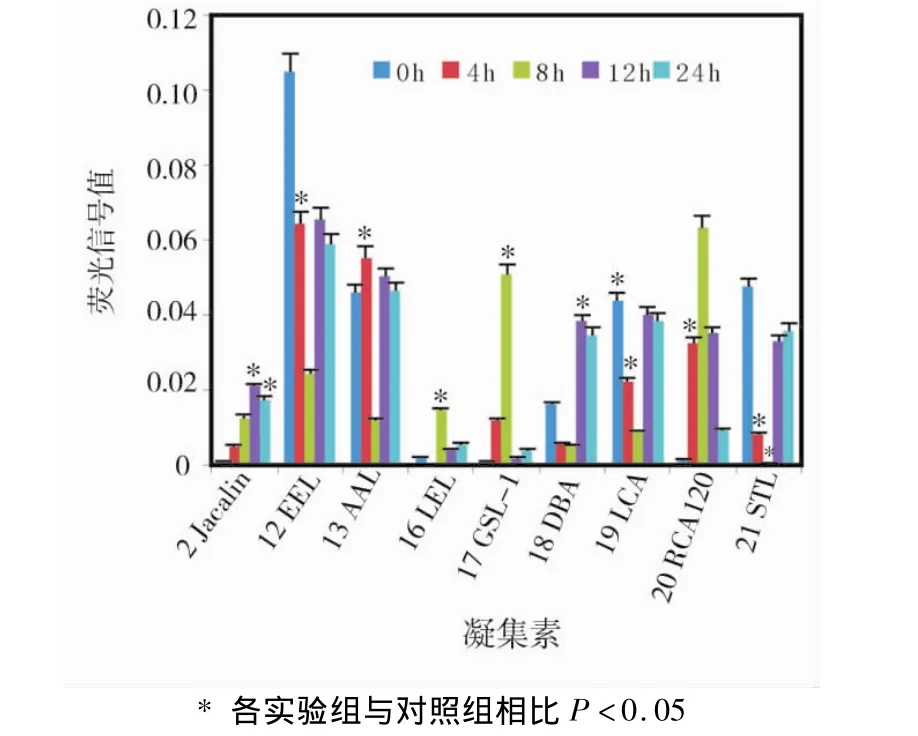
图2 实验组与对照组差异表达凝集素荧光值比较
3 讨论
蛋白质的糖基化修饰是最普遍、最重要的蛋白翻译后修饰之一。糖蛋白糖链部分影响着蛋白质的折叠、稳定、运输和定位,并可通过糖-蛋白质之间的特异性识别参与各种生命现象的调节,如细胞转化、细胞调控、细胞识别、粘连与运动、信号传导、免疫与应答等。在许多疾病的发生、发展过程中,糖蛋白的糖基化程度或糖链结构都发生了改变,导致糖蛋白及其所在细胞的功能障碍[7-8]。成骨细胞是骨形成和骨重建中重要的功能细胞,成骨细胞的增殖、分化受多种因子的调节[9]。
本研究利用凝集素芯片研究了不同加载时长机械应力对成骨细胞的糖蛋白糖谱及其表达差异,分析出一系列骨改建相关糖蛋白糖链。在加力后实验组凝集素Jacalin、GSL-I、DBA的亲和作用增强,提示在机械牵张力作用下成骨样细胞表面可能出现增多的N-乙酰半乳糖胺(包括α1-3链接方式),这一分支结构的增加是由于生成这一结构的糖基转移酶表达量或是活性增加所致。Hazuki E等通过比较野生型及Galnt1基因敲除小鼠中糖蛋白的表达,鉴定了N-乙酰半乳糖氨基转移酶(pp-GalNAcT-1)是骨糖蛋白中骨桥蛋白(OPN)O糖基化(寡糖链连接在Thr和Ser残基上)必不可少的特异结合位点[10]。有文献表明机械牵张作用可显著影响成骨细胞骨桥蛋白(OPN)mRNA的表达水平[11]。推测在机械牵张应力刺激下成骨细胞的ppGalNAcT-1表达增加,之后导致骨桥蛋白(OPN)的受体在细胞表面驻留,持续传递细胞生长信号。OPN由成骨细胞分泌,具有促进细胞的粘附和伸展的作用[12],是一种能够诱导成熟成骨细胞表型表达并与矿化骨基质密切相关的活性蛋白[13]。在加力后实验组凝集素LCA、STL的亲和作用减弱,提示在机械牵张力作用后成骨样细胞表面可能出现减少的N-乙酰葡糖胺结构。有文献报道,Glc-NAc修饰的状态和水平能表现出反映细胞状态的调节点,如果GlcNAc修饰全面上升或下降,将会极大影响细胞对外界刺激的反应能力。GlcNAc的修饰能被看成是细胞内的一种信号,在很大程度上决定细胞如何去削减外界对自身的刺激[14]。
比对不同加载时长,发现 DBA[GalNAcα-Ser/Thr(Tn)and GalNAcα1-3Gal]呈时间依赖性表达增高。Talaei-Khozani T 等[15]研究发现,DBA在软骨、钙离子沉淀物及蛋白聚糖产物中都表达升高,推测DBA能有效诱导骨化及软骨形成。
凝集素芯片是一种糖捕获芯片,可用于迅速获悉糖蛋白不同的糖基化特征,可以快速、高通量地获得糖蛋白聚糖结构信息[16]。本研究通过凝集素芯片技术找出一系列骨改建相关糖蛋白糖链。进一步分析发现,细胞表面糖谱随加载时长不同而表达不同,提示糖蛋白糖链与许多重要生命事件如细胞分化、细胞粘附、信号转导等紧密相关。但由于凝集素与聚糖链结合具有重叠性,加之目前凝集素所能亲和识别的糖链信息仍有限[17],凝集素芯片技术还需与其他技术联合使用。
[1]Zhang P,Malacinski GM,Yokota H.Joint loading modality:its application to bone formation and fracture healing[J].Br J Sports Med,2008,42(7):556-560.
[2]Colletti LA,Edwards J,Gordon L,et al.The effects of musclebuilding exercise on bone mineral density of the radius,spine,and hip in young men [J].Calcif Tissue Int,1989,45(1):12-14.
[3]Duncan RL,Turner CH.Mechanotransduction and the functional response of bone to mechanical strain [J].Calcif Tissue Int,1995,57(5):344-358.
[4]Jones DB,Nolte H,Scholubbers JG.Biochemical signal transduction of mechanical strain in osteoblast-like cells[J].Biomater,1991,12(2):101 -110.
[5]Rath B,Nam J,Knobloch TJ.Compressive forces induce osteogenic gene expression in calvarial osteoblasts[J].J Biomech,2008,41(5):1095-1103.
[6]Pilobello KT,Mahal LK.Deciphering the glycocode:the complexity and a nalytical challenge of glycomics[J].Curr Opin Chem Biol,2007,11(3):300 -305.
[7]Gabius HJ,Andre S,Kaltner H,et al.The sugar code:functional lectinomics[J].Biochim Biophy Acta,2002,157(2 - 3)2:165-177.
[8]Varki A,Cllmnlings RD,Esko JD,et al.Essentials of glycobiology[M].Beijing:Science,2003:416 -417.
[9]Chau JF,Leong WF,Li B.Signaling pathways governing osteoblast proliferation differentiation and function[J].Histol His-topathol,2009,24(12):1593 -1606.
[10]Miwa HE,Gerken TA,Jamison O,et al.Isoform-specific O-glycosylation of osteopontin and bone sialoprotein by polypeptide N-aceylgalactosaminyltransferase-1[J].J Biol Chem,2010,285(2):1208 -1219.
[11]刘大为,傅民魁,李盛琳,等.机械牵张作用对UMR-106细胞骨桥蛋白mRNA和TGF-β1 mRNA表达的影响[J].中华口腔医学杂志,2000,35(1):27-30.
[12]王立平,党耕町.骨桥蛋白在骨愈合过程中的基因表达[J].北京医科大学学报,1998,30(4):355-357.
[13]Bulter WT.The nature and significance of osteopontin[J].Connec Tissue Res,1989,23(2 -3):123 -126.
[14]Wells L,Vosseller K,Hart GW.Glycosylation of nucleocytoplasmic proteins:signal transduction and O-GlcNAc[J].Science,2001,291(5512):2376 -2378.
[15]Ingram RT,Clarke BL,Fisher LW,et al.Distribution of noncollagenous proteins in the matrix of adult human bone:evidence of anatomic and functional heterogeneity[J].Bone Miner Res,1993,8(9):1019-1029.
[16]Angeloni S,Ridet JL,Kusy N,et al.Glycoprofiling with micro-arrays of glycoconjugates and lectins[J].Glycobiology,2005,15(1):31-41.
[17]Gupta G,Surolia A,Sampathkumar SG.Lectin microarrays for glycomic analysis[J].OMICS,2010,14(4):419 -436.

