正交试验优选癣湿凝胶制备工艺
邓燕芬,庞廷媛,程国华(广州医学院附属肿瘤医院,广州510095)
正交试验优选癣湿凝胶制备工艺
邓燕芬*,庞廷媛,程国华#(广州医学院附属肿瘤医院,广州510095)
目的:优选癣湿凝胶的制备工艺。方法:在单因素试验基础上,以乙醇与冰乙酸比例、浸渍时间、渗漉速度为考察因素,以总固体量和蛇床子素含量为评价指标,采用正交试验优选制备工艺。结果:最佳制备工艺为乙醇-冰乙酸(4∶1,V/V),浸渍时间56 h,渗漉速度0.2 mL·min-1。结论:该工艺简便、稳定,可用于制备癣湿凝胶。
癣湿凝胶;蛇床子素;制备工艺
癣湿水剂是由土荆皮、蛇床子、百部、蝉蜕、斑蝥等12味中药组成的外用制剂,具有抗真菌、抗细菌的作用,用于各种癣症的治疗,疗效确切[1]。近年来,凝胶剂作为一种新型外用剂型,广泛应用于临床皮肤病的治疗和美容护肤,其具有涂展性好、无油腻感、不污染衣物、易于清洗,透皮、吸收速度比霜剂快等特点[2]。故笔者将该处方的水剂研制成凝胶剂,在单因素试验的基础上,筛选出对制备工艺影响较大的因素,采用正交试验优化工艺条件。
1 仪器与试药
BT125 D Sartorius电子天平(北京赛多利斯天平有限公司);XSZ-7 G生物显微镜及枪型夜视摄像机(重庆光学仪器厂);RW20 DZM.n强力流线型搅拌机(德国IKA公司);GZX-9070 MBE数显鼓风干燥箱(上海博迅实业有限公司医疗设备厂);QE-300中药粉碎机(武义县屹立工具有限公司)。
土荆皮(产地:广东,批号:090909)、蛇床子(产地:河北,批号:090502),均购于广东天诚中药饮片有限公司;大风子仁(产地:安徽,批号:090612)、百部(产地:安徽,批号:090514)、凤仙透骨草(产地:安徽,批号:090317)、斑蝥(产地:安徽,批号:090415),均购于广东和翔制药有限公司;防风(产地:陕西,批号:090521)、吴茱萸(产地:贵州,批号:090625)、花椒(产地:安徽,批号:090313),均购于广东广弘医药有限公司;当归(产地:甘肃,批号:090709)、侧柏叶(产地:广东,批号:090306)、蝉蜕(产地:湖北,批号:090629),均购于广州市白云健药品有限公司;无水乙醇(分析纯,成都市科龙化工试剂厂);冰乙酸(优级纯,上海化学试剂公司)。
2 方法与结果
2.1 癣湿凝胶的制备工艺
将处方中斑蝥粉碎成细粉,其余11味药材粉碎成粗粉,与斑蝥粉末混匀,照流浸膏剂与浸膏剂项下的渗漉法[3]试验,用乙醇-冰乙酸(3∶1,V/V)的混合液作溶剂,浸渍48 h,缓缓渗漉,收集渗漉液1000mL,静置;取上清液,滤过,加凝胶基质适量,搅匀,灌装,即得。
2.2 单因素试验
2.2.1 不同比例的提取溶剂对总固体量、蛇床子素溶出的影响分别取一个处方量的同批号药材5份,用不同比例的乙醇-冰乙酸作溶剂,按“2.1”项下方法制成1000 mL癣湿凝胶,测定样品中的蛇床子素含量[4]、总固体量[2]、醋酸含量[5],结果见表1。
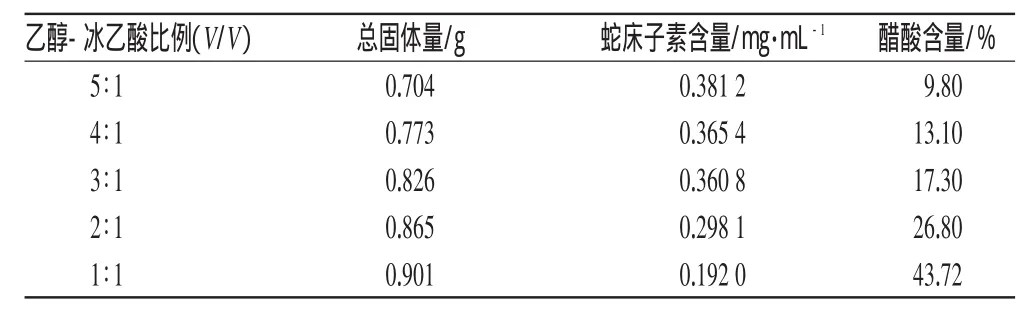
表1 不同比例的提取溶剂对蛇床子素和总固体物溶出的影响Tab 1Effects of extraction solution with different proportions on the dissolution of osthole and total solid matters
从表1可知,乙醇比例升高,样品中蛇床子素含量升高,总固体量下降。由于质量标准中规定总固体量应>0.75 g,醋酸含量应高于10.0%,而醋酸量太高,对皮肤刺激性较大,因此选择乙醇-冰乙酸比例以4∶1或3∶1较为合适。而以乙醇-冰乙酸(3∶1,V/V)为提取溶剂比乙醇-冰乙酸(4∶1,V/V)为提取溶剂样品中蛇床子素含量少约1%,总固体量却多约7%,故初步选择乙醇-冰乙酸(3∶1,V/V)为提取溶剂。
2.2.2 不同粒度的药材对总固体量、蛇床子素溶出的影响
取同批号药材适量,分成4组,每组一个处方量,分别将3组药材粉碎成细粉、粗粉和1cm以下粗粒。另一组作为对照组。按“2.1”项下方法制成1000 mL癣湿凝胶,测定样品中蛇床子素含量和总固体量,并观察澄清度,结果见表2。
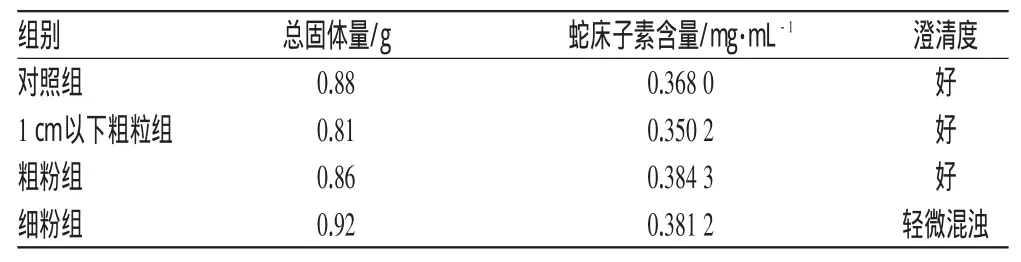
表2 不同粒度的药材对蛇床子素和总固体物溶出的影响Tab 2 Effects of medicinal material with different granularity on the dissolution of osthole and total solid matters
由表2可知,药材的粒度越细,越有利于总固体物、有效成分溶出。因此,宜于将药材粉碎成粗粉或细粉。但药材粒度太细,静置较长,且样品中有轻微混浊,故药材粒度选择粗粉较为合适。
2.2.3 不同浸渍时间对总固体量、蛇床子素溶出的影响取同批号药材适量,分为5组,每组一个处方量,按“2.1”项下方法分别浸渍24、32、48、60、72 h后渗漉,制成1000 mL癣湿凝胶,测定样品中总固体量、蛇床子素含量,结果见表3。

表3 不同浸渍时间对总固体量、蛇床子素溶出的影响Tab 3Effects of different maceration time on the dissolution of osthole and total solid matters
由表3可知,浸渍48 h后渗漉,样品的总固体量、蛇床子素含量没有明显的变化。从节省生产时间考虑,选择浸渍48 h较为适宜。
2.2.4 不同渗漉速度对总固体量、蛇床子素溶出的影响取同批号药材适量,分成6组,每组一个处方量,按“2.1”项下方法分别以0.2、0.5、1.0、1.5、2.0、2.5 mL·min-1速度渗漉,收集渗漉液1000 mL,测定样品中总固体量、蛇床子素含量,结果见表4。

表4 不同渗漉速度对总固体量、蛇床子素溶出的影响Tab 4Effects of different percolation velocity on the dissolution of osthole and total solid matters
由表4可知,当渗漉速度为0.2~1.0 mL·min-1时,总固体量、蛇床子素含量均无明显变化,但渗漉速度为1.5~2.5 mL· min-1时,总固体量、蛇床子素含量均明显减少。因此,渗漉速度应为0.2~1.0 mL·min-1,即每分钟1~5 mL·kg-1较为合适。2.2.5不同渗漉液收集量对总固体量、蛇床子素含量的影响
取一个处方量药材,按“2.1”项下方法制备,分步收集渗漉液,每200 mL为一份,共收集8份,总量为1600 mL,测定渗漉液分别为200、400、600、800、1000、1200、1400、1600 mL时的总固体量和蛇床子素含量,并计算蛇床子素浸出率(浸出率=(蛇床子素量/总浸出量)×100%),结果见表5。

表5 不同渗漉液收集量对总固体量、蛇床子素含量的影响Tab 5Effects of different percolate collection volume on the dissolution of osthole and total solid matters
由表5可知,渗漉液收集至总量800 mL时,总固体量、蛇床子素浸出率已近90%,至1000 mL时蛇床子素浸出率已近95%,从节省成本和生产时间考虑,收集渗漉液1000 mL较为合理。
2.3 正交试验优选工艺
按处方量称取药材适量,在单因素试验基础上,选取对工艺影响较大的3个因素,即乙醇与冰乙酸比例(A)、浸渍时间(B)、渗漉速度(C)进行考察,以总固体量、蛇床子素含量为指标,按正交试验L9(34)表安排试验[4]。因素水平见表6;正交试验结果见表7;方差分析结果见表8。

表6 因素水平Tab 6 Factors and levels
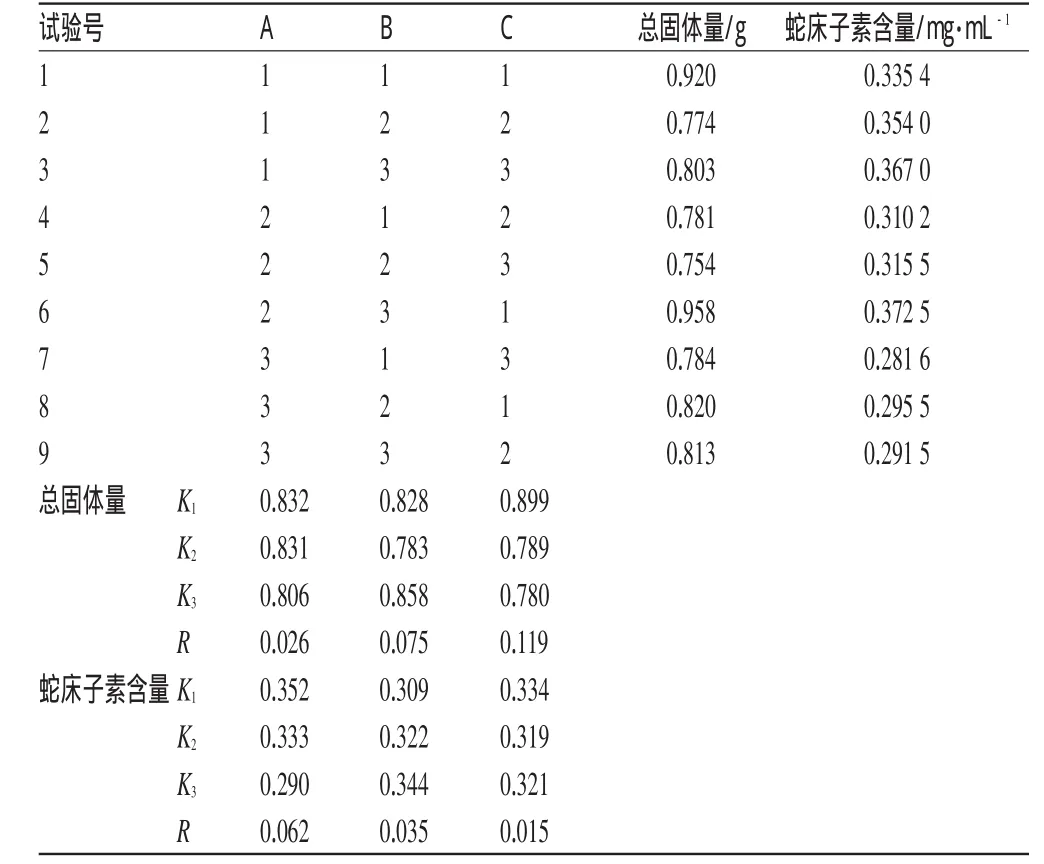
表7 正交试验结果Tab 7Results of orthogonal test
由表7、表8可知,以总固体量为指标,最佳工艺条件为A1B3C1;以蛇床子素含量为指标,最佳工艺条件仍为A1B3C1。各因素影响总固体量大小的顺序为C>B>A,影响蛇床子素含量的顺序为A>B>C。C因素对总固体量有显著性影响(P<0.05),而各因素对蛇床子素含量无显著性影响,这可能与浸渍时间长、渗漉速度慢有关。当浸渍时间足够长、渗漉速度较慢时,一定量的提取溶剂已最大限度地提取出蛇床子素,增大提取溶剂的量也无法提高蛇床子素含量。提取最佳工艺条件为A1B3C1,即用乙醇-冰乙酸(4∶1,V/V)为溶剂,浸渍时间为56 h,渗漉液收集速度为0.2 mL·min-1。
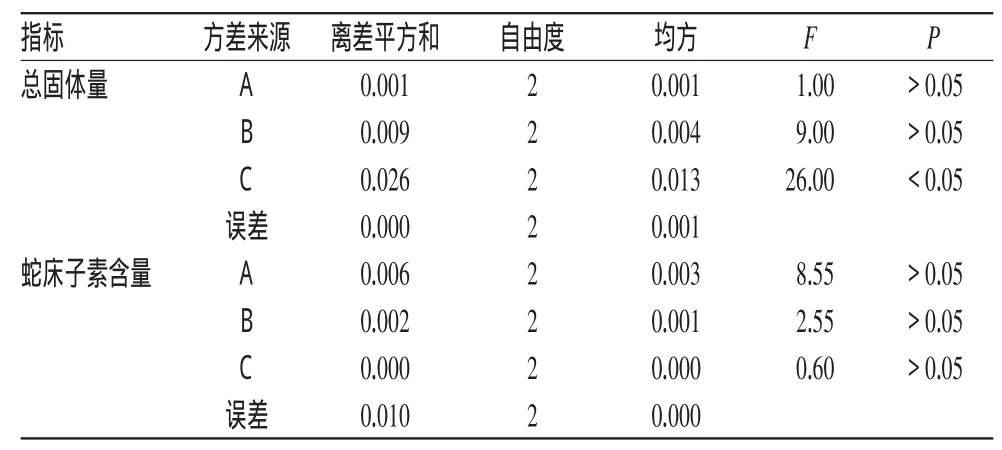
表8 方差分析结果Tab 8 Results of analysis of variance
2.4 工艺稳定性试验
为考察工艺稳定性与合理性,以100倍处方量投料3批,按上述最佳工艺制备3批癣湿凝胶,并测定样品的醋酸含量、总固体量和蛇床子素含量,结果见表9。

表9 验证试验结果Tab 9Results of verification test
由表9可知,醋酸含量在18.50%~19.45%范围内,总固体量均高于0.80g,蛇床子素含量在0.2017~0.3849mg·mL-1范围内,与正交试验结果相当,表明优选工艺合理、可行。
2.5 癣湿凝胶和癣湿药水稳定性对比试验
取处方量药材10份,按“2.1”项下方法操作,收集得渗漉液10000 mL。取5份渗漉液,按上述最佳工艺制成癣湿凝胶;取5份渗漉液,按2010年版《中国药典》(一部)癣灵药水制备方法[3]制成癣湿药水,于室温下避光放置,于0、1、3、6、12月时考察蛇床子素含量、颜色、澄清度的变化情况。不同剂型的癣湿制剂稳定性比较见表10。

表10 不同剂型的癣湿制剂稳定性比较Tab 10 Comparison of the stability of different dosage forms of Xuanshi gelatin
由表10可知,放置12个月后,癣湿药水和癣湿凝胶中的蛇床子素含量没有明显的变化,但癣湿药水的颜色在放置过程中会产生变化,从暗黄绿色逐渐变为棕黄色,且在放置6个月后会产生少量的沉淀。由此可见,癣湿凝胶较癣湿药水更为稳定。
3 讨论
癣湿凝胶中土荆皮的主要成分为土荆皮酸;吴茱萸主含挥发油、内酯等成分;防风、当归、蛇床子、大风子仁、花椒等的主要有效成分为挥发油;斑蝥主要成分为斑蝥素;侧柏叶含挥发油、黄酮等成分;百部主含生物碱。上述药材的成分多为脂溶性成分,易溶于乙醇。制备工艺中采用一定比例的乙醇进行渗漉提取效果较好,且在提取工艺中,不同比例的乙醇-冰乙酸对有效成分蛇床子素的溶出影响较大。
渗漉一般以每分钟1~5 mL·kg-1的速度收集渗漉液。癣湿凝胶处方中药材总量为187.25 g,折算为渗漉速度应为每分钟0.2~1.0 mL。本试验以不同的渗漉速度进行试验,考察渗漉速度对总固体量、蛇床子素溶出的影响,按渗漉法[6,7]操作要求,收集渗漉液,先收集药材量85%的最初渗漉液,另器存放。继续渗漉,收集继得液约为药材量的3~7倍。本处方药材总量为187.25 g,按上述操作要求,先收集最初渗漉液液量约160mL(187.25×85%),再收集续得液约560~1300mL。本处方制成量为1000 mL,试验中分步收集渗漉液,分别测定其总固体量、蛇床子素含量,结果当渗漉速度为0.2~1.0 mL· min-1时,总固体量、蛇床子素含量均无明显差异,但渗漉速度为1.5~2.5mL·min-1时,总固体量、蛇床子素含量均明显减少。因此,渗漉速度应为0.2~1.0mL·min-1,即每分钟1~5 mL·kg-1较为合适。
[1]孟楣,倪晓燕,马格非.癣湿特效药水质量标准研究[J].中药新药与临床药理,2007,18(3):230.
[2]王金凤,蔡兴东.中药凝胶剂研究近况[J].中国当代医药,2011,18(2):14.
[3]国家药典委员会.中华人民共和国药典(一部)[S].2010年版.北京:中国医药科技出版社,2010:附录11、附录51、1239.
[4]黄美兰,王希,黄荣林.高效液相色谱法测定癣湿药水中蛇床子素的含量[J].广东药学,2003,113(3):4.
[5]高春,高恒莹,姚瑛,等.高效液相色谱法测定醋酸奥曲肽中醋酸含量[J].中国生化药物杂志,2004,25(4):237.
[6]韩强,吕冬梅,王来成.正交试验优选淫羊藿总黄酮的提取工艺.[J].中国药房,2008,19(30):2347.
[7]黄泰康.中成药学[M].北京:中国医药科技出版社,1999:218.
Optimization of the Preparation Technology of Xuanshi Gelatin
DENG Yan-fen,PANG Ting-yuan,CHENG Guo-hua(The Affiliated Tumor Hospital of Guangzhou Medical College,Guangzhou 510095,China)
OBJECTIVE:To optimize the preparation technology of Xuanshi gelatin.METHODS:Based on single factor test,the preparation technology was optimized by orthogonal design with the ratio of ethanol to glacial acetic acid,maceration time and percolation velocity as factors using the contents of osthole and total solid matters as index.RESULTS:The optimal conditions for preparation was ratio of ethanol to glacial acetic acid of 4∶1(V/V),maceration time of 56h,percolation velocity of 0.2mL·min-1. CONCLUSION:The optimal technology is simple and stable,which can be used for the prepartion of Xuanshi gelatin.
Xuanshi gelatin;Osthole;Preparation technology
R284.2;R283.6
A
1001-0408(2012)27-2523-04
2012-03-15
2012-05-20)
DOI10.6039/j.issn.1001-0408.2012.27.10

