动物组织中莱克多巴胺残留胶体金免疫层析和LC-MS/MS检测方法的比较
赵彦岭 张宁 胡自然 陈宝明 万宇平(河北省兽药监察所 石家庄 050051 河北省畜牧兽医研究所 保定 河北省动物疫病预防控制中心 ④北京勤邦生物技术有限公司)
动物组织中莱克多巴胺残留胶体金免疫层析和LC-MS/MS检测方法的比较
赵彦岭①张宁②胡自然③陈宝明①万宇平④*(①河北省兽药监察所 石家庄 050051 ②河北省畜牧兽医研究所 保定 ③河北省动物疫病预防控制中心 ④北京勤邦生物技术有限公司)
采用胶体金试纸卡法和LC-MS/MS法分别对猪肉、猪肝样品进行检测,鉴定胶体金试纸卡法和LC-MS/MS法检测结果的符合率。结果表明:应用胶体金试纸卡法检测样品中莱克多巴胺的最低检测限为5.0μg/kg,LC-MS/MS检测方法的检测限为0.25μg/kg;2种方法的检测结果一致。胶体金试纸卡法特异性较高,样品前处理简单,检测快速,成本低,适用于动物组织中莱克多巴胺残留的定性筛查;LC-MS/MS灵敏度高,适合于阳性样品的确证和精确定量。
莱克多巴胺 动物组织 胶体金试纸卡 液相色谱-串联质谱法(LC-MS/MS)
莱克多巴胺(Ractopamine, RAC),化学名称为1-(4-羟基苯基)-2[1-甲基-3-(4-羟基苯基)-丙氨基]-乙醇盐酸盐,与克伦特罗(瘦肉精)均为β2受体兴奋剂,在临床上普遍用于治疗支气管炎和哮喘病。近几年的研究表明,RAC具有控制动物营养代谢路径、增强饲料转化率等作用,因此被用作新型促生长添加剂。但由于莱克多巴胺在猪等动物的体内具有残留并可以通过生物链方式进入人体,当积累超过一定量时表现出毒副反应,出现心动过速、心律失常及肌肉疼痛等症状[1-3]。近年来,RAC被不法商贩作为“瘦肉精”替代品应用于猪养殖业中。我国农业部2002年176号公告将RAC规定为违禁药物。相应地,对于莱克多巴胺的检测技术的研究提出了更高的要求。简单、快速、准确、灵敏的莱克多巴胺检测技术也越来越受到食品企业、检测机构的广泛关注。目前动物组织中莱克多巴胺残留分析主要采用免疫分析法[4]、气相色谱-质谱法(GC-MS)[5]、高效液相色谱-质谱法(HPLC-MS)[6]、液相色谱-串联质谱法(LC-MS/MS)[7]等方法。胶体金免疫层析法作为一种现场快速筛选方法已受到广泛重视。为考察目前RAC的快速检测技术和实验室大型精密仪器检测技术的检测效果,本实验采用胶体金免疫层析法和LC-MS/MS法对动物组织中莱克多巴胺残留进行检测,并对不同两种检测方法的检测结果进行了比较。
1 材料与方法
1.1 材料与仪器
1.1.1 材料 莱克多巴胺标准品(美国Sigma公司),纯度99%以上;β-葡萄糖醛苷酶/芳基硫酸酯酶(美国Sigma公司),β-葡萄糖醛苷酶含量≥85000units/ml,芳基硫酸酯酶含量≥7500units/ml;莱克多巴胺胶体金试纸卡(北京勤邦生物技术有限公司);乙酸铵、高氯酸、氢氧化钠、乙酸乙酯、叔丁基醚、甲酸、氨水(北京化学试剂公司),分析纯;甲醇、乙腈(美国Sigma公司),色谱纯。
1.1.2 仪器 2000SBL电子天平(美国Setra公司);微量移液器 单道20~200ml和100~1000ml、多道50~300ml(美国Thermo);8010S匀浆机(上海斯伯明仪器设备有限公司);QL-90漩涡混合器(海门市其林贝尔仪器制造有限公司);HH-S8恒温水浴锅(常州菲普实验仪器厂);LC-MS/MS液相色谱-串联质谱仪 配有电喷雾离子源(ESI)及Xcalibur1.2数据处理系统(美国Waters公司)。
1.1.3 试验用猪肉和猪肝 样品均为市购,取适量新鲜或冷冻的猪肉、猪肝样品,结冻,试验所用猪肉和猪肝搅碎制成均质物,前处理用。
1.2 方法
1.2.1 试验条件 (1)色谱条件:色谱柱为BEH C18 (100×2.1mm,1.7μm),柱温为30℃;流动相A:0.1%甲酸和0.05%氨水溶液,B相:乙腈;流速0.4ml/min;进样量5μl。(2)质谱条件:离子源为电喷雾离子源;扫描方式为正离子扫描;检测方式为多反应监测;电离电压3KV;离子源温度150℃;脱溶剂温度400℃;碰撞气流速 0.15ml/min;锥孔气流速50L/h;脱溶剂气流速550L/h。
1.2.2 样品前处理方法 (1)胶体金试纸卡法:称取1.0g均质过的猪肉或猪肝样品于10ml离心管中,加入1ml 0.02mol/L pH为7.4的磷酸盐缓冲液作为样品提取液,涡动1min。放入80℃水中水浴15min,取出冷却至室温,待检。(2)LC-MS/MS法:样品前处理方法参考《农业部1025号公告-18-2008 动物源性食品中β-受体激动剂残留检测液相色谱-串联质谱法》中的酶解、提取和净化步骤进行操作[8]。
1.2.3 测定方法 (1)胶体金试纸卡法:取阳性的猪肉和猪肝样品分别进行质量浓度为1.0、5.0、10.0μg/L莱克多巴胺标准品的添加,判定胶体金试纸卡的检测限,每个浓度作3个平行。检测方法为用吸管吸取待检样品溶液垂直滴加3滴于加样孔中,从液体流动时开始计时,反应5~10min判定结果。(2)LC-MS/MS法:取标准品用LC-MS/MS检测条件进行分析,检测时间及流动相梯度洗脱情况见表1。

表1 流动相及梯度洗脱条件
1.2.4 结果计算 (1)胶体金试纸卡:用试纸卡检测样品时,当样品为阴性时,试纸卡的T线和C线都显色,表示样品中莱克多巴胺浓度低于检测限;当样品为阳性时,T线不显色,表示样品中莱克多巴胺浓度高于检测限;当试纸卡为无效时,则C线不会出现。胶体金试纸卡检测结果判定如图1所示:(2)LC-MS/MS法:采用外标法对样品中莱克多巴胺残留量进行定量分析,以莱克多巴胺标准品的峰面积为轴,以莱克多巴胺标准品质量浓度(μg/L)为轴,分别测定质量浓度为0.0、1.0、5.0和10.0μg/L的莱克多巴胺标准溶液的峰面积,绘制标准曲线。将样品中峰面积代入标准曲线中,从标准曲线上读出对应的莱克多巴胺的质量浓度,即为样品中莱克多巴胺实际残留量。标准曲线为A=aC+b,求得a和b,则C=(A-b)/a,式中:A—标准品或样品中莱克多巴胺峰面积;C—标准品或样品中莱克多巴胺峰浓度。
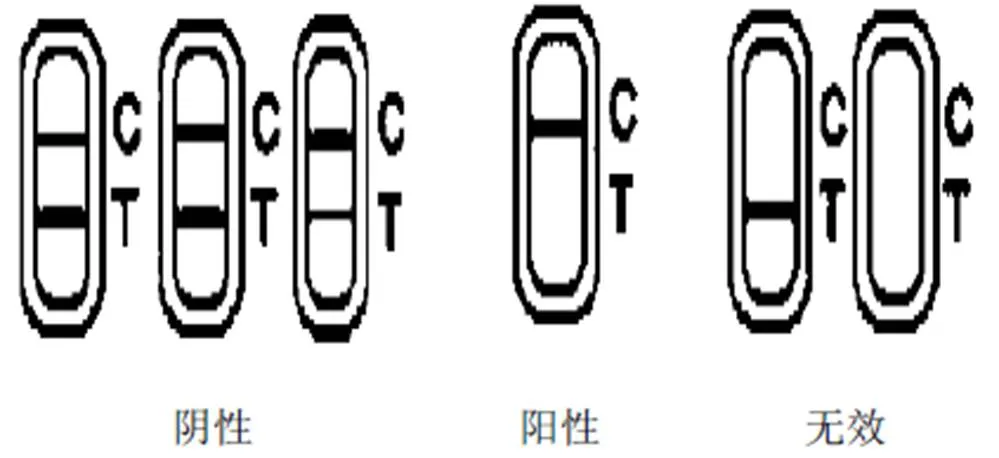
图1 胶体金试纸卡检测结果判定示意图
2 结果与讨论
2.1 LC-MS/MS标准曲线
取0.5、1.0、2.0、5.0、10.0和20.0μg/L的莱克多巴胺标准品溶液于50ml离心管中,按照规定步骤操作,经LC-MS/MS分析,得到标准曲线,如图2所示。试验表明莱克多巴胺在0.5~20.0μg/L的范围内具有良好的线性关系,当以莱克多巴胺的峰面积比对其质量浓度进行线性回归,得到莱克多巴胺线性方程为A=1301.4C+0.03,相关指数R2=0.998916。
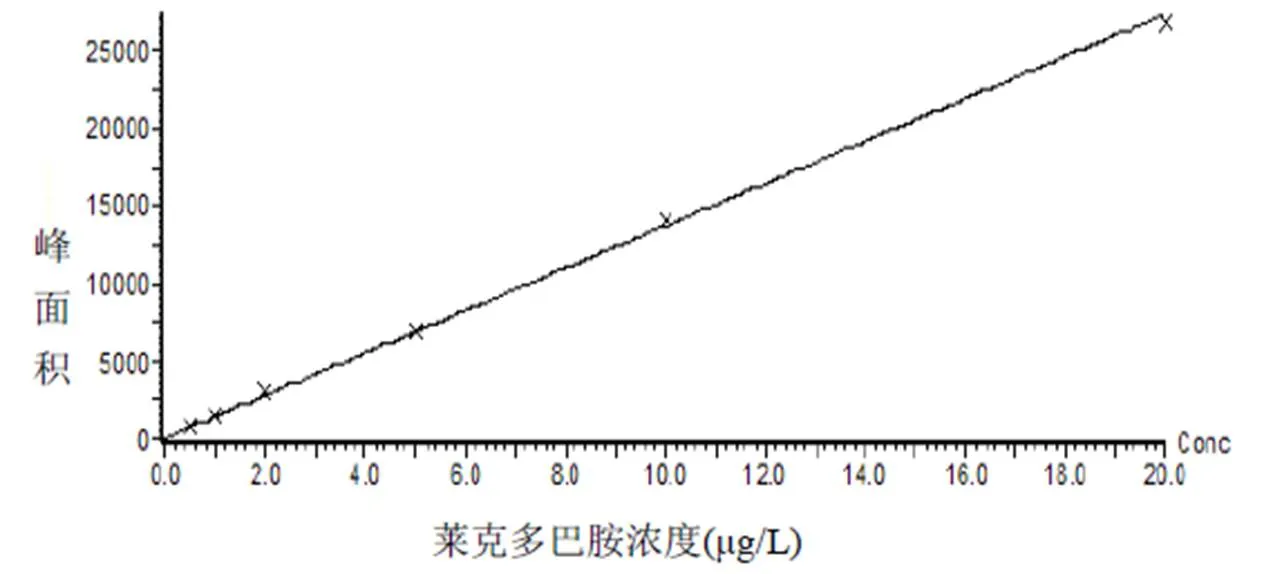
图2 莱克多巴胺LC-MS/MS标准曲线
2.2 检测限
2.2.1 胶体金试纸卡法 胶体金试纸卡的检测限是通过对添加了多个水平浓度的莱克多巴胺标准品的样品检测而确定的。对添加浓度为1.0、5.0和10.0μg/kg的50份猪肉样品和50份猪肝样品的测定结果见表2。由于胶体金试纸卡对猪肉和猪肝样品在莱克多巴胺的添加浓度为1.0μg/kg时的检测结果均为阴性,在添加浓度等于或高于5.0μg/kg时的检测结果均为阳性,可判断胶体金试纸卡对猪肉和猪肝样品的检测限为5.0μg/kg。

表2 莱克多巴胺胶体金试纸卡检测限判定结果(n=3) (µg/kg)
2.2.2 LC-MS/MS法 在空白猪肉和猪肝样品中添加0.1、0.25、0.5、1.0μg/kg质量浓度的莱克多巴胺标准品,进行3次平行测定,最低检测限按照信噪比为3:1计算,得到该方法检测限为0.25μg/kg。
2.3 实际样品检测结果的比较
分别抽取30份猪肉样品和30份猪肝样品,采用胶体金试纸卡与LC-MS/MS检测方法进行对比检测,结果如表3所示。检测结果表示:LC-MS/MS法测定阴性结果用“ND”表示,阳性结果以实际检测结果表示。以5μg/kg检测限为猪肉和猪肝样品的阳性判定线,即莱克多巴胺在样品中的含量低于5μg/kg判定为阴性,含量高于5μg/kg样品判定为阳性。
通过表3可知,利用胶体金试纸卡和LC-MS/MS法共检测出1份阳性猪肉样品和1份阳性猪肝样品,图3为胶体金试纸卡测定的样品结果判断,其中图3-a和3-b中的检测线(T)和质控线(C)同时出现红色条带,表示胶体金试纸卡对该猪肉样品和猪肝样品的检测结果均为阴性;图3-c和3-b中的质控线(C)出现红色条带,而检测线(T)的红色条带均消失,表示胶体金试纸卡对该猪肉样品和猪肝样品的检测结果均为阳性。图4~7为阳性样品的LC-MS/MS测定的质量色谱图。图4表示采用LC-MS/MS法检测阴性猪肉样品中莱克多巴胺含量的质量色谱图;图5表示采用LC-MS/MS法检测阴性猪肝样品中莱克多巴胺含量的质量色谱图;图6表示采用LC-MS/MS法检测猪肉样品中的莱克多巴胺含量为14.2μg/kg;图7表示采用LC-MS/MS法检测猪肝样品中的莱克多巴胺含量为8.2μg/kg两种方法测定的阳性样品和阴性样品的检测结果基本一致,可得出胶体金试纸卡的假阳性率为0,假阴性率为0,该方法适用于动物组织中莱克多巴胺残留量的测定。
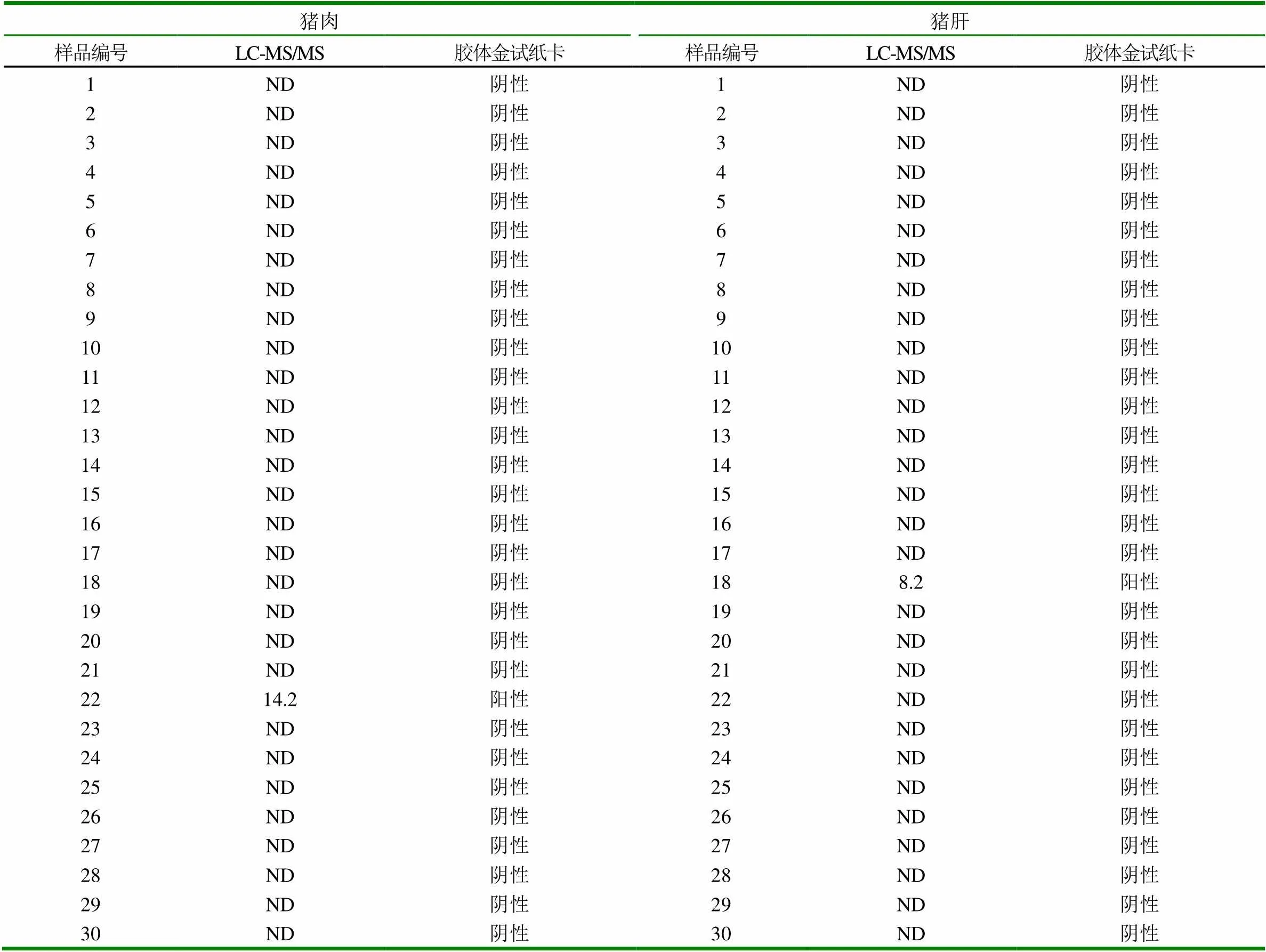
表3 胶体金试纸卡和LC-MS/MS对猪肉和猪肝样品的检测结果的比较(μg/kg)

图3 胶体金试纸卡测定的猪肉、猪肝样品结果判断图
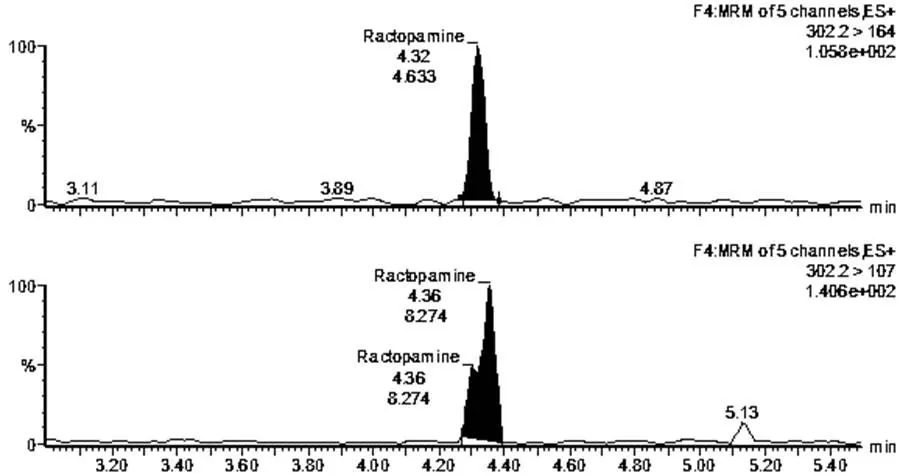
图4 阴性猪肉样品中莱克多巴胺含量的质量色谱图
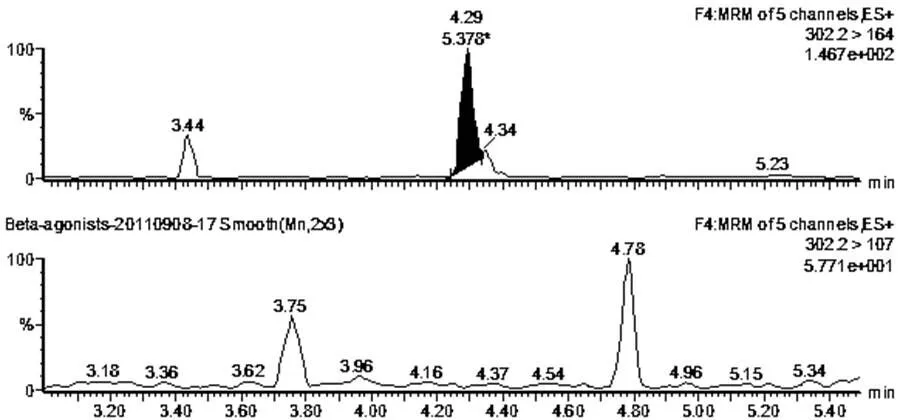
图5 阴性猪肝样品中莱克多巴胺含量的质量色谱图
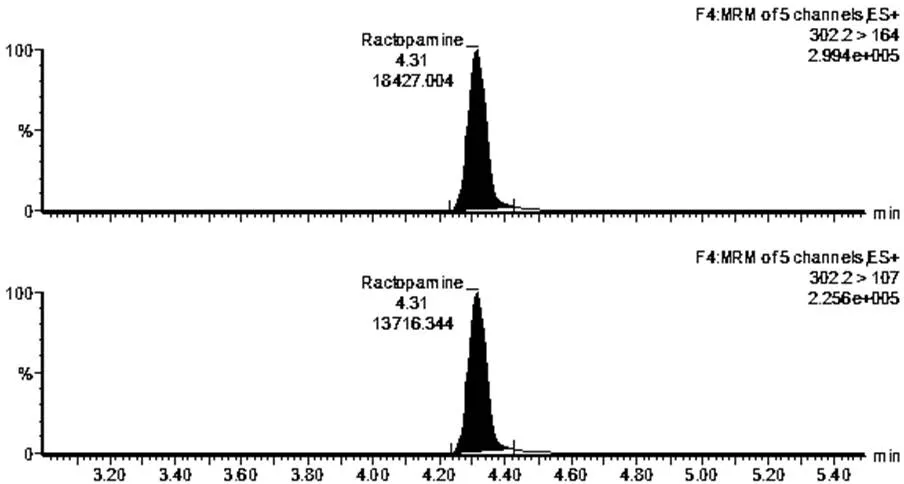
图6 22#猪肉样品中莱克多巴胺含量的质量色谱图
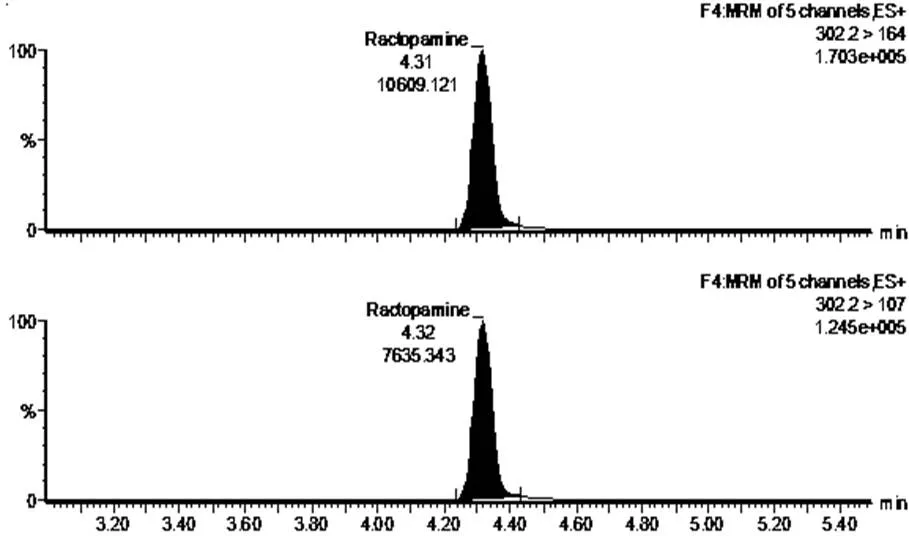
图7 18#猪肝样品中莱克多巴胺含量的质量色谱图
3 结论
本试验采用胶体金试纸卡和LC-MS/MS法对动物组织中的莱克多巴胺残留量进行检测,对猪肉和猪肝样品进行1.0、5.0和10.0μg/kg浓度的添加,得到胶体金试纸卡法的检测限为5μg/kg,对猪肉和猪肝样品进行0.1、0.25、0.5、1.0μg/kg浓度的添加,得到LC-MS/MS法检测限为0.25μg/kg;通过对实际样品的检测,两种方法测定结果基本一致,和LC-MS/MS法进行复核验证,得到胶体金试纸卡的假阳性率为0,假阴性率为0。
LC-MS/MS法检测灵敏度高,准确度高,但样品的前处理方法复杂,仪器操作时间比较长,设备昂贵,检测成本高;利用胶体金试纸卡法检测,特异性较高,不需要复杂的样品处理及大型的配套仪器,检测时间短,检测结果直观,检测成本低,但由于试纸卡的灵敏度会受到一定的限制,所以该方法特别适合在现场大规模样品抽查中使用,用于定性初筛。LC-MS/MS灵敏度高,适合于阳性样品的确证和精确定量。
[1] 许梓荣, 陈洪亮, 肖日进. Ractopamine 对肥育猪营养再分配作用机制的研究[J]. 中国农业科学, 1998, 31(6): 1-5.
[2] Kuiper H A, Noordam M Y, Van Dooren-Flipsen MM, et al. Illegal use of beta-adrenergic agonists: European Community[J]. Anim Sci, 1998, 76(1): 195-207.
[3] 郭荷梅, 杜红丽, 刘文生等. 莱克多巴胺胶体金免疫层析快速检测试纸条的研制[J]. 广东农业科学, 2009, 2(2): 82-84.
[4] Kunakar P, Huy O, Albert A. Combined immunoextraction approach coupled to chemiluminescence enzyme immunoassay for the determination of trace levels of salbutamol and clenbuterol in tissue samples[J]. Analyst, 1994, 119(12): 2659-2662.
[5] Abukhalaf IK, Von Deutsch DA, et al. Comparative analytical quantitation of clenbuterol in biological matrices using GC-MS and EIA[J]. Biomed Chromatogr, 2000, 14(2): 99-105.
[6] 单吉浩, 姜艳彬, 蔡英华等. 农业部958号公告-3-2007动物源食品中莱克多巴胺残留量的测定高效液相色谱法-质谱法[S]. 中华人民共和国农业部, 2007.
[7] Fesser AC, Dickson LC, Macneil JD, et al. Determination of beta-agonists in liver and retina by liquid chromatography-tandem mass spectrometry[J]. J AOAC Int, 2005, 88(1): 61-69.
[8] 王树槐, 孙雷, 朱永林等. 农业部1025号公告-18-2008 动物源性食品中β-受体激动剂残留检测液相色谱-串联质谱法[S]. 北京: 中华人民共和国农业部, 2008.
(2011–11–08)
通讯联系人
S859.84
A
1007-1733(2012)01-0001-04
——猪肝泥

