抗念珠菌药物的耐药特性分析
曾昭瑛 苏建荣
(首都医科大学附属北京友谊医院临床检验中心,北京 100050)
随着广谱抗生素和免疫抑制剂的广泛使用,免疫功能缺陷患者的不断增多及有创性诊断和治疗技术的大量应用,导致侵袭性真菌感染日益增多[1-2]。念珠菌菌属是最常见的致病真菌,它能引起的感染是多种多样的,可累及全身各个脏器,从皮肤黏膜感染直至危及生命的系统性感染[3]。与此同时,由于抗真菌药大量和长期的预防性及治疗性应用,念珠菌耐药菌株相继出现,给临床治疗带来了一定的困难[4]。为此,本文旨在介绍抗念珠菌药物的特点、药物敏感性试验方法和要求、国内外耐药现状及念珠菌感染治疗选药推荐等内容。
1 抗念珠菌药物与耐药表型检测
目前常用的抗念珠菌的药物,按结构类型的不同可分为以下几类:①多烯类:这类药物通过与真菌细胞膜上的麦角固醇结合,使细胞膜形成微孔,改变膜的通透性,从而引起细胞内物质的外渗,导致真菌死亡[5]。该类临床常用药包括两性霉素B及其脂质体。两性霉素B为最重要的广谱抗真菌药物之一,几乎对所有真菌都有较强的抗菌活性,目前仍是治疗多种深部真菌病的首选药物[6]。② 唑类:这类药物通过抑制细胞色素P450依赖酶,使麦角固醇合成受阻从而破坏了真菌细胞的完整性[7]。代表药物有氟康唑、伊曲康唑、伏立康唑等。氟康唑主要用于全身性和黏膜念珠菌病,也可用于那些由于免疫功能低下而容易发生念珠菌病的患者的预防治疗[8],氟康唑具有口服吸收好、抗菌谱广,无严重不良反应等特点,目前成为公认安全有效的抗真菌药[9]。③ 嘧啶类:这类药物通过选择性地进入细胞内,在胞嘧啶脱氨酶的作用下转化为氟尿嘧啶进而取代RNA中的尿嘧啶,干扰了念珠菌正常蛋白质的合成,从而达到抗念珠菌的作用。5-氟胞嘧啶单独使用易产生耐药性[10],宜与两性霉素B同时使用,两者联合应用治疗念珠菌及隐球菌感染[11]可起协同作用,尤以白色念珠菌感染时这种协同作用更为明显[12]。④ 棘白菌素类:该类药物为β-(1,3)葡聚糖合成酶抑制剂,通过抑制或干扰β-(1,3)葡聚糖的合成可以有效地抑制和杀灭念珠菌,由于哺乳动物没有细胞壁,因此,这类药物可选择性作用于念珠菌。卡泊芬净是第一个被美国食品及药物管理局批准上市的作用于真菌细胞壁的药物,主要用于发热、中性粒细胞减少患者真菌感染的经验性治疗[13]。
随着念珠菌感染的增多及抗真菌药物的广泛使用,念珠菌的耐药现象日趋严重[4]。因此,快速而准确地对念珠菌进行药物敏感性试验,筛选出敏感药物以指导临床合理用药,减少耐药发生为目前临床所急需。目前用来评价药物敏感性的基本方法之一,就是测定药物的最小抑菌浓度(minimum inhibitory concentration,MIC),其标准化方面已取得很大进展。
1.1 美国临床实验室标准化委员会(Clinical Laboratory Standards Institute,CLSI)药物敏感性试验方案[14]
美国临床实验室标准化委员会于1982年成立了真菌药物敏感性试验分会,选择了液体培养基稀释法对念珠菌和新型隐球菌进行标准化药物敏感性试验(简称药敏试验)研究。1992年,起草了《酵母菌的液体培养基稀释法抗真菌药物敏感试验参考方案》,即M27-P,用于检测引起深部感染的酵母菌,包括念珠菌和新生隐球菌等菌对两性霉素B、5-氟胞嘧啶和唑类药物(氟康唑、酮康唑及伊曲康唑)的敏感性。1995年,该草案进行了修订,增加了经济、简便的微量稀释法,即M27-T,随后的2年中,又对药物的MIC临界点判定方法进行了修订,形成M27-A,确定了念珠菌对氟康唑、伊曲康唑、5-氟胞嘧啶的MIC折点。2002年,CLSI就微量稀释法中24 h及48 h的MIC判定试验方法进行了统一,同时增加了新的抗真菌药物泊沙康唑、雷夫康唑和伏立康唑的试验方法及 MIC参考范围,并将该方案修订出版,即M27-A2。2008年,CLSI又发表了真菌体外药物敏感性试验的标准,即M27-A3和M27-S3文件,增加了对伏立康唑、卡泊芬净、米卡芬净、阿尼芬净体外药物敏感性试验的判定折点。新指南也公布了念珠菌属对常见抗真菌药物的敏感性。
CLSI M27-A3方案的肉汤微量稀释法目前应用的比较广泛,故简单介绍以下其具体操作过程:
(1)RPMI1640培养基配制:L-谷氨酰胺及酚红指示剂,不含碳酸氢钠,0.2%葡萄糖,以0.165 mol/L吗啉丙烷磺酸为缓冲液调整pH值到7.0。加热溶解后经0.22 μm微孔滤膜过滤除菌,再往此 RPMI1640液体中加入高压灭菌已融化的琼脂溶液,使最终琼脂含量0.5 g/L,以备微量稀释法测定MIC用。
(2)接种菌液准备:取在沙保罗培养基上转种48 h的念珠菌菌落,用0.85%无菌0.9%氯化钠注射液制成约0.5麦氏比浊度的菌悬液,约1×106~5×106CFU/mL。
(3)药物敏感性试验操作流程:无菌96孔U型塑料板每排第1~11孔加入100 μL用RPMI1640培养基倍比稀释的2倍于待测抗真菌药物浓度的药液,每排最后1孔(第12孔)只加100 μL培养基不加药作为生长对照孔。取0.5麦氏比浊度的菌悬液用RPMI1640培养基1 000倍稀释后作为待接种物,此时接种物浓度为1×103~5×103CFU/mL。取此接种物加至微孔板中,每孔100 μL,使得最终浓度达到0.5×103~2.5×103CFU/mL。将试验板放置35℃,孵育48 h。
(4)结果判读:24 h和48 h判读,与对照孔按下列标准比较,0:肉眼观察清晰;1:轻度模糊;2:浊度显著减低(约50%被抑制);3:浊度轻度减低;4:浊度不减低。两性霉素B以肉眼观察清晰不混浊,即生长完全受抑制为MIC判定终点;5-氟胞嘧啶、唑类药物以及棘白菌素类药物以浊度显著减低(约50%被抑制)孔(2分)为MIC判断终点。具体的MIC判读标准详见表1。

表1 念珠菌体外药物敏感性试验的MIC判读标准Tab.1 Interpretive guidelines for in vitro susceptibility testing of candida spp(μg·mL-1)
(5)用质控菌株进行对照:克柔假丝酵母菌 ATC- C®6258、近平滑假丝酵母菌 ATCC®22019。质控菌株的MIC允许范围详见表2[15]。
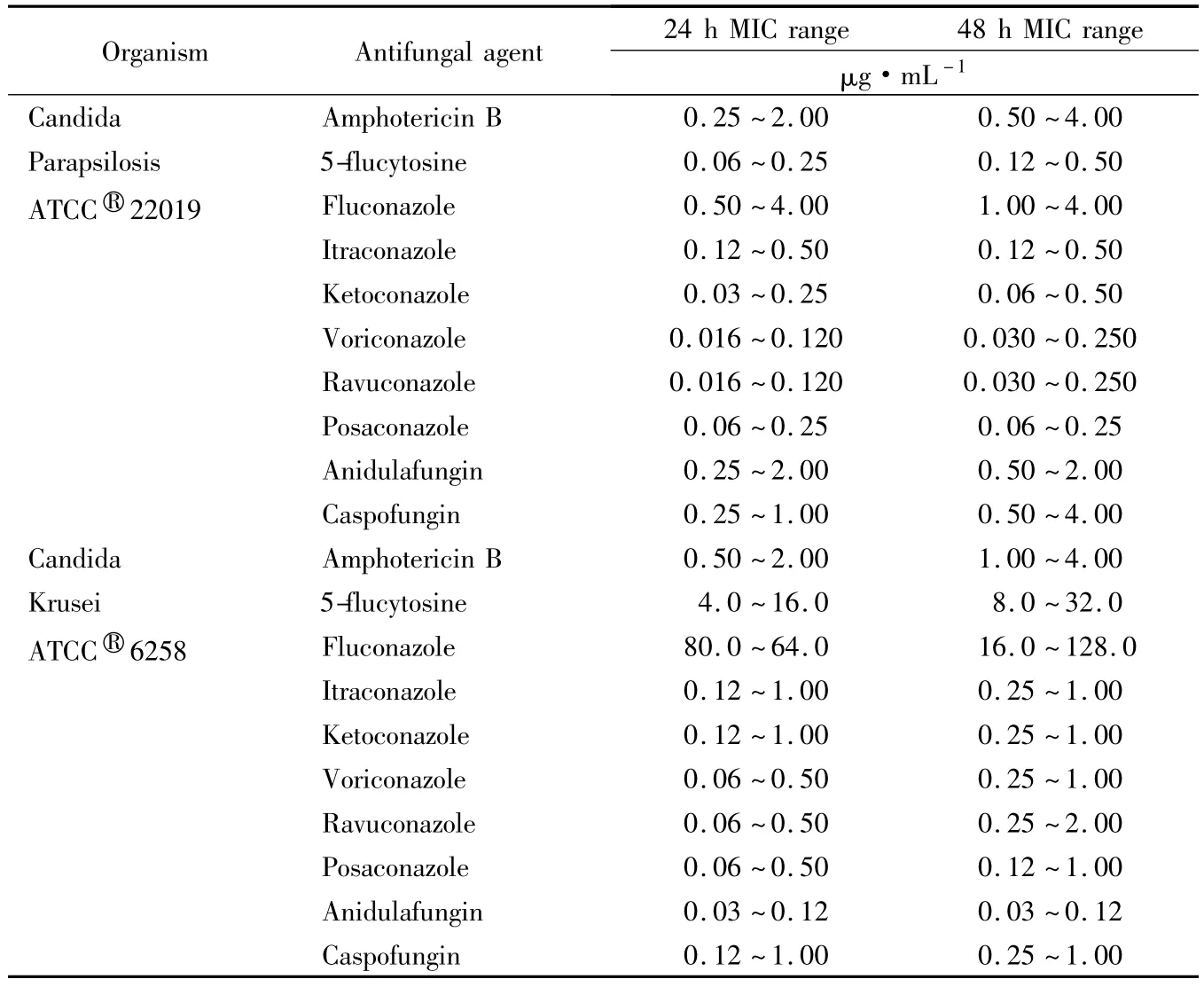
表2 2株质量控制菌株用于肉汤微量稀释法质量控制24和48 h MIC允许范围Tab.2 Recommended 24 and 48 h MIC limits for two quality control strains for broth microbilution
值得注意的是,克柔假丝酵母菌对氟康唑天然耐药[16],故在判读结果时不应采用CLSI给出的判读标准,在报告药敏时,直接报告氟康唑耐药。目前的CLSI文件没有给出两性霉素B的折点,临床研究利用CLSI提供的念珠菌参考药敏方法所得出的MIC值密集于 0.25 ~1.00 μg/mL[17],若 MIC >1 μg/mL,则考虑两性霉素B耐药。棘白菌素类药物的MIC值必须在24 h读取。
1.2 欧洲药物敏感性试验委员会(European Committee on Antimicrobial Susceptibility Testing,EUCAST)真菌药物敏感性试验方案
欧洲药物敏感性试验委员会真菌药物敏感性试验方案与 CLSI M27-A3相比略有差别[18],但基本操作流程相同。存在区别的地方是:EUCAST所用的RPMI1640培养基所含葡萄糖的量为2%,CLSI为0.2%;EUCAST采用的微量稀释药敏板为平底,CLSI为U型;EUCAST接种时的菌量为0.5×105~2.5×105CFU/mL,CLSI为 1×103~5×103CFU/mL;EUCAST的MIC判读时间为24 h,CLSI为24 h和48 h;EUCAST的结果判读借助分光光度计于波长530~550 nm下进行,而CLSI靠肉眼观察。EUCAST采用2%的葡萄糖使得生长对照空的浊度更明显,而MIC值可在24 h内获得。一项比较EUCAST和CLSI真菌药物敏感性试验的多中心研究[19]指出:EUCAST真菌药物敏感性试验所得的三唑类药物的MIC值要低于CLSI参考方法。因此,不能用CLSI的真菌药敏折点去评价EUCAST方法所得的MIC值。
1.3 E-试验法[20]
E-试验法是一种改良的琼脂扩散法,以试剂条的形式定量读出MIC值。比传统的纸片扩散法测量抑菌圈的大小精确可靠,易于操作。其原理和方法是先将药物按log2梯度递减稀释成不同浓度,并固定于特制的5 mm×50 mm的塑料条上,塑料条反面标记相应的药物浓度数字,试验时用无菌棉棒蘸0.5麦氏浊度定量菌悬液均匀涂布于含有1.5%RPMI1640琼脂平板表面,干燥15 min后,再将试剂条含药面贴在琼脂平面。经35℃孵育48 h。孵育后,由于药物在琼脂内的弥散作用和对真菌的抑制活性,可在试剂条周围形成一个圆形或椭圆形的抑菌圈,其边缘与试剂条交界处可定量读出MIC值[21]。
1.4 生物梅里埃ATB-Fungus微量稀释法
该法目前在各大临床实验室应用广泛。其操作过程为[22]:将念珠菌菌落混悬于无菌0.9%氯化钠注射液中,使其浓度为2麦氏比浊度。取20 μL菌悬液加入ATB培养基中混匀,再用微量移液器将此菌液加入药敏板中,每孔135 μL,盖上塑料盖,置35℃孵育24~48 h。以生长对照孔生长良好,而含药最高稀释孔不生长者为最小抑菌浓度。该法采用的是CLSI M27-A2方案规定的耐药菌株判定标准:氟康唑≤0.125 μg/mL 为敏感,≥1 μg/mL 为耐药;伊曲康唑≤0.125 μg/mL 为敏感,0.25 ~0.5 μg/mL 为剂量依赖性敏感,≥1 μg/mL 为耐药;5-氟胞嘧啶≤4 μg/mL为敏感,8 ~16 μg/mL 为剂量依赖性敏感,≥32 μg/mL为耐药。
1.5 丹麦 Rosco纸片法[23]
将改良的Shadomy琼脂培养基加热熔解后倒入直径为90 mm的无菌培养皿中,35℃干燥20~30 min。用无菌棉签将0.5麦氏比浊度的菌悬液均匀涂布于Shadomy琼脂平板上经35℃干燥10 min后贴上丹麦Rosco公司生产的真菌药敏纸片,35℃孵育24 h用游标卡尺测量抑菌圈大小(抑菌环边缘少量菌落生长忽略不计)。Rosco纸片扩散法参考标准敏感≥21 mm,耐药≤10 mm,10 mm<中介<21 mm。
2 国内外抗念珠菌药物的耐药现状
2008~2009年SENTRY社区和医院感染念珠菌血症菌种分布及耐药性监测报告[24]显示,2 085株来自亚太地区、拉丁美洲、欧洲和北美洲的念珠菌中,阿尼芬净的耐药率为2.4%,米卡芬净为1.9%,而唑类药物的耐药率为3.5% ~5.6%,且多发生于光滑假丝酵母菌。念珠菌对抗真菌药物耐药机制主要有:①药物作用靶位改变;②念珠菌细胞内药物累积减少;③代谢途径改变;④念珠菌生物膜形成。各种耐药机制既可以单独起作用,又可以两种或多种机制同时作用。菌株呈高度耐药常常为多种耐药机制共同作用的结果[25]。Perea S等[26]对耐药白色念珠菌的流行病学调查发现:85%的耐药株为外排泵过度表达;65%和35%的耐药株为药物靶向酶改变或过度表达;75%的耐药株为多因素联合耐药。下面将对临床常用的一些抗真菌药的耐药现状进行简单介绍。
2.1 多烯类抗念珠菌药:两性霉素B
若念珠菌胞膜上麦角甾醇的量和/或质发生改变,或被其他甾醇所代替,则两性霉素B不能发挥作用。如酿酒酵母菌变异后菌膜中固醇成分减少,也可产生耐药,但多烯类临床应用30多年来,耐药的仍较少见[27]。
2.2 唑类抗念珠菌药
2.2.1 药物作用靶位改变
与细胞色素 P450 相关的 C-14-α2-去甲基化酶(P450-14DM)是唑类药物的靶向酶。该靶向酶是念珠菌细胞膜成分麦角固醇合成的必需酶,唑类药物对其具有很强的亲和力,从而抑制酶的催化活性,使得麦角固醇合成受阻,细胞膜结构破坏,念珠菌生长受抑制。靶向酶结构改变以及靶向酶过度表达均可导致念珠菌耐药[28-29]。
2.2.2 胞内药物累积减少
药物在真菌细胞内聚集的减少是真菌产生耐药性的一个重要机制。一是因为膜通透性降低使进入的药物减少;二是细胞内的药物外排增强。具有药物外排功能的膜蛋白,作为一类镶嵌在细胞膜上的蛋白,在抗真菌药的作用下可被诱导表达,将细胞内的多种药物等转运到细胞外使细胞呈现耐药性,这类膜蛋因此被称之为多药耐药蛋白(multi-drug resistant associate protein,MRP)。在白色念珠菌中与耐药有关的MRP主要分为两大类:ABC转运蛋白超家族-ATP结合盒转运蛋白 (ATP binding cassette transporters,BCT)和易化扩散载体超家族(major facilitator superfamily,MFS)[30-31]。
2.2.3 生物合成途径的改变
唑类药物通过抑制P450-14DM的活性,使得羊毛甾醇不能转换为14-α2-去甲基羊毛甾醇。后者在erg3基因编码的△5,6脂肪酸脱氢酶催化下生成14-α2-3,2-二醇从而阻断麦角甾醇的合成,并使甲基化固醇在真菌胞质内积蓄,从而抑制了细胞的生长。部分真菌由于erg3基因的突变,不能产生有活性的△5,6脂肪酸脱氢酶,致使在细胞内累积的是14-α2-甲基类固醇而不是 14-α2 甲基-3,2-二醇,而 14-α2-甲基类固醇能部分替代麦角甾醇的功能,持真菌细胞生长,从而对唑类耐药[32-33]。
2.3 嘧啶类抗念珠菌药:5-氟胞嘧啶
念珠菌对5-氟胞嘧啶产生耐药性的主要机制是药物的吸收降低或是由于基因突变导致胞嘧啶脱氨酶或尿嘧啶磷酸核糖基转移酶缺乏,使5-氟胞嘧啶不能转化为5-氟鸟苷酸,故而不能干扰真菌DNA的合成。已有研究[34-35]表明5-氟胞嘧啶的耐药机制产生可能与fcy2、fcy1和fur1基因突变相关,而 Papon N等[36]所作的关于fcy2和fcy1的研究提示,这两种基因的突变除了导致念珠菌对5-氟胞嘧啶耐药,还会引起氟康唑的交叉耐药。
2.4 棘白菌素类抗念珠菌药
目前念珠菌对棘白菌素类药物耐药的报道极少。仅有部分国外研究[37-38]表明棘白菌素类药物的靶基因fks1在Ser645位点的点突变会导致体外药物敏感性试验中部分念珠菌对棘白菌素类药物产生耐药,进而导致临床治疗失败。
2.5 生物被膜的形成与耐药
生物被膜是指真菌细胞通过分泌一些胞外的多糖蛋白质复合物,将自身包裹其中而在表面形成的膜状物。真菌可借此天然屏障抵御抗生素从而产生持续性感染。研究[39-40]显示,一些内置医疗材料如植入牙体、人工心脏瓣膜、中央静脉导管、尿道插管等易引起念珠菌病,正是由于这些内置材料可作为念珠菌生物被膜形成的基质。生物被膜内真菌常表现出高度的耐药性。其耐药机制可能与下列因素有关:① 膜内真菌代谢率较低,生长速率减慢;②胞外聚合物基质所形成的膜屏障作用[41-42];③ 表面诱导性耐药基因的表达[43]。
3 临床治疗选药推荐
美国感染性疾病学会(Infectious Diseases Society of America,IDSA)专家组在2009年制定了新的念珠菌病诊疗指南[44],该版指南主要针对侵袭性念珠菌病和黏膜念珠菌病,并于2009年发表在Clinical Infectious Diseases杂志上用于替换该刊2004年发表的版本。该指南以指导医师对该类患者或有感染此类疾病风险的人群进行治疗或预防,故被医务工作者广泛地应用于临床实际工作中。
3.1 念珠菌血症的治疗推荐
3.1.1 无中性粒细胞缺乏者
对多数成人患者的初始治疗,推荐氟康唑或棘白菌素类。对中重度感染或近期有唑类药物暴露史的患者,推荐棘白菌素类;对轻中度感染且近期无唑类药物暴露史患者,推荐氟康唑。儿童方案与成人相同(调整剂量)。
若培养结果为对唑类敏感的念珠菌(如白念珠菌)且患者病情稳定,可用氟康唑替代棘白菌素类。
对光滑念珠菌感染,推荐棘白菌素类。若无药物敏感性试验证实,不推荐用氟康唑或伏立康唑。对初始治疗采用氟康唑或伏立康唑的患者,若临床症状改善,复查血培养阴性,可继续用唑类药物完成疗程。
对近平滑念珠菌感染,推荐用氟康唑。对初始治疗采用棘白菌素类的患者,若临床症状改善,复查血培养阴性,可继续用此类药物完成疗程。
若患者不耐受或得不到上述药物,可用两性霉素B或其脂质体。若培养结果为对唑类敏感的念珠菌(如白念珠菌)且患者病情稳定,可用氟康唑替代两性霉素B或其脂质体。
伏立康唑对念珠菌血症有效,但不优于氟康唑。仅对克柔念珠菌或伏立康唑敏感光滑念珠菌感染患者,才选用伏立康唑作为口服维持治疗。
对无明显合并症的念珠菌血症患者,疗程为血培养阴性且临床症状明显缓解后维持2周。
强烈推荐拔除中央静脉插管。
3.1.2 中性粒细胞缺乏者
对多数患者推荐棘白菌素类。
对轻中度感染且近期无唑类药物暴露史的患者,可选用氟康唑。
对光滑念珠菌感染,推荐用棘白菌素类。脂质体两性霉素B同样有效,但价格较高并有潜在毒性。对已采用伏立康唑或氟康唑的患者,若临床症状改善,复查血培养阴性,可用唑类药物完成疗程。
对近平滑念珠菌感染,推荐初始治疗用氟康唑或脂质体两性霉素B。对已采用棘白菌素类的患者,若临床状况稳定,复查血培养阴性,可用该类药物完成疗程。对克柔念珠菌感染,可选用棘白菌素类、脂质体两性霉素B或伏立康唑。
对无明显合并症的念珠菌血症患者,疗程为血培养阴性且临床症状明显缓解、粒细胞缺乏缓解后维持2周。
推荐将中央静脉插管拔除。
3.2 可疑侵袭性念珠菌病经验性治疗方案
3.2.1 无中性粒细胞缺乏者
经验性治疗与确诊治疗相同。初始治疗推荐氟康唑或棘白菌素类。对中重度感染、或近期有唑类药物暴露史、或光滑念珠菌/克柔念珠菌感染患者,推荐用棘白菌素类药物。
若患者不耐受或得不到上述药物,可用两性霉素B或其脂质体。
经验性治疗应只针对存在侵袭性念珠菌病危险因素、伴无已知原因所致发热的重症患者,且应基于对危险因素的临床评价、侵袭性念珠菌病血清学标志物和(或)非无菌部位的培养结果。
3.2.2 中性粒细胞缺乏者
推荐脂质体两性霉素、卡泊芬净或伏立康唑。
氟康唑和伊曲康唑可作为替代。
还可选择两性霉素B,但毒性较大。
若唑类药物曾被用于预防性治疗,则不宜用于经验性治疗。
3.3 念珠菌病高危者的预防性治疗
对肝、胰腺和小肠移植患者,推荐在术后预防性选用氟康唑或脂质体两性霉素B,至少用7~14 d。
对重症监护患者,推荐预防性应用氟康唑。
对化学治疗导致粒细胞缺乏患者,在化疗后粒细胞缺乏期推荐预防性使用氟康唑、泊沙康唑或卡泊芬净。口服伊曲康唑也可作替代,但患者耐受性较差。对接受干细胞移植的患者,在粒细胞缺乏期推荐预防性使用氟康唑、泊沙康唑或米卡芬净。
3.4 气道分泌物分离出念珠菌的意义
气道分泌物有念珠菌生长很少提示侵袭性念珠菌病,因此对此类患者不应行抗真菌治疗。大量前瞻性和回顾性研究包括尸检均表明,对于侵袭性念珠菌病,呼吸道分泌物(包括支气管肺泡灌洗液)培养有念珠菌生长的预测价值极低,不应作为开始抗真菌治疗的依据。
[1]Kontoyiannis D P,Marr K A,Park B J,et al.Prospective surveillance for invasive fungal infections in hematopoietic stem cell transplant recipients,2001-2006:overview of the Transplant-Associated Infection Surveillance Network(TRANSNET)Database[J].Clin Infect Dis,2010,50(8):1091-1100.
[2]Pfaller M A,Diekema D J.Epidemiology of invasive mycoses in North America[J].Crit Rev Microbiol,2010,36(1):1-53.
[3]Pfaller M A,Diekema D J.Epidemiology of invasive candidiasis:a persistent public health problem[J].Clin Microbiol Rev,2007,20(1):133-163.
[4]Pfaller M A,Diekema D J,Gibbs D L,et al.Results from the ARTEMIS DISK Global Antifungal Surveillance Study,1997 to 2007:a 10.5-year analysis of susceptibilities of Candida Species to fluconazole and voriconazole as determined by CLSI standardized disk diffusion[J].J Clin Microbiol,2010,48(4):1366-1377.
[5]Slisz M,Cybulska B,Grzybowska J,et al.The mechanism of overcoming multidrug resistance(MDR)of fungi by amphotericin B and its derivatives[J].J Antibiot(Tokyo),2007,60(7):436-446.
[6]Agarwal R,Singh N.Amphotericin B is still the drug of choice for invasive aspergillosis[J].Am J Respir Crit Care Med,2006,174(1):102.
[7]Heimark L,Shipkova P,Greene J,et al.Mechanism of azole antifungal activity as determined by liquid chromatographic/mass spectrometric monitoring of ergosterol biosynthesis[J].J Mass Spectrom,2002,37(3):265-269.
[8]Charlier C,Hart E,Lefort A,et al.Fluconazole for the management of invasive candidiasis:where do we stand after 15 years?[J].J Antimicrob Chemother,2006,57(3):384-410.
[9]Guinea J,Peláez T,Rodriguez-Créixems M,et al.Empirical treatment of candidemia in intensive care units:fluconazole or broad-spectrum antifungal agents?[J].Med Mycol,2009,47(5):515-520.
[10]Schwarz P,Janbon G,Dromer F,et al.Combination of amphotericin B with flucytosine is active in vitro against flucytosine-resistant isolates of Cryptococcus neoformans[J].Antimicrob Agents Chemother,2007,51(1):383-385.
[11]Dromer F,Bernede-Bauduin C,Guillemot D,et al.Major role for amphotericin B-flucytosine combination in severe cryptococcosis[J].PLoS One,2008,3(8):e2870.
[12]Hope W W,Warn P A,Sharp A,et al.Surface response modeling to examine the combination of amphotericin B deoxycholate and 5-fluorocytosine for treatment of invasive candidiasis[J].J Infect Dis,2005,192(4):673-680.
[13]Perlin D S.Current perspectives on echinocandin class drugs[J].Future Microbiol,2011,6(4):441-457.
[14]Clinical and Laboratory Standards Institute.CLSI document M27-S3.Reference method for broth dilution antifungal susceptibility testing of yeasts;approved standard-third edition[S].Wayne:CLSI,2008.
[15]Clinical and Laboratory Standards Institute.CLSI document M27-S3.Reference method for broth dilution antifungal susceptibility testing of yeasts;informational supplement[S].Wayne:CLSI,2008.
[16]Guinea J,Sanchez-Somolinos M,Cuevas O,et al.Fluconazole resistance mechanisms in Candida krusei:the contribution of efflux-pumps[J].Med Mycol,2006,44(6):575-578.
[17]Claudino A L,Peixoto R F,Jr,Melhem M S,et al.Correlation between CLSI,EUCAST and Etest methodologies for amphotericin B and fluconazole antifungal susceptibility testing of Candida spp.clinical isolates[J].Pharmazie,2008,63(4):286-289.
[18]Pfaller M A,Castanheira M,Diekema D J,et al.Comparison of European Committee on Antimicrobial Susceptibility Testing(EUCAST)and Etest methods with the CLSI broth microdilution method for echinocandin susceptibility testing of Candida species[J].J Clin Microbiol,2010,48(5):1592-1599.
[19]Espinel-Ingroff A,Barchiesi F,Cuenca-Estrella M,et al.International and multicenter comparison of EUCAST and CLSI M27-A2 broth microdilution methods for testing susceptibilities of Candida spp.to fluconazole,itraconazole,posaconazole,and voriconazole[J].J Clin Microbiol,2005,43(8):3884-3889.
[20]Pfaller M A,Boyken L,Messer S A,et al.Evaluation of the etest method using Mueller-Hinton agar with glucose and methylene blue for determining amphotericin B MICs for 4,936 clinical isolates of Candida species[J].J Clin Microbiol,2004,42(11):4977-4979.
[21]Ozcan S K,Mutlu B,Dundar D,et al.Comparison of broth microdilution and E-test methods for the antifungal susceptibility testing of Candida spp.strains isolated from blood cultures[J].Mikrobiyol Bul,2010,44(2):263-271.
[22]Eraso E,Ruesga M,Villar-Vidal M,et al.Comparative evaluation of ATB Fungus 2 and Sensititre Yeast One panels for testing in vitro Candida antifungal susceptibility[J].Rev Iberoam Micol,2008,25(1):3-6.
[23]Lopez J,Dalle F,Mantelin P,et al.Rapid identification of Candida glabrata based on trehalose and sucrose assimilation using Rosco diagnostic tablets[J].J Clin Microbiol,2001,39(3):1172-1174.
[24]Pfaller M A,Moet G J,Messer S A,et al.Geographic variations in species distribution and echinocandin and azole antifungal resistance rates among Candida bloodstream infection isolates:report from the SENTRY Antimicrobial Surveillance Program(2008 to 2009)[J].J Clin Microbiol,2011,49(1):396-399.
[25]Mishra N N,Prasad T,Sharma N,et al.Pathogenicity and drug resistance in Candida albicans and other yeast species.A review[J].Acta Microbiol Immunol Hung,2007,54(3):201-235.
[26]Perea S,Patterson T F.Antifungal resistance in pathogenic fungi[J].Clin Infect Dis,2002,35(9):1073-1080.
[27]Ellis D.Amphotericin B:spectrum and resistance[J].J Antimicrob Chemother,2002,49(Suppl 1):7-10.
[28]Asai K,Tsuchimori N,Okonogi K,et al.Formation of azole-resistant Candida albicans by mutation of sterol 14-demethylase P450[J].Antimicrob Agents Chemother,1999,43(5):1163-1169.
[29]Kakeya H,Miyazaki T,Miyazaki Y,et al.Azole resistance in Candida spp[J].Nihon Ishinkin Gakkai Zasshi,2003,44(2):87-92.
[30]Looi C Y,D'Silva E C,Seow H F,et al.Increased expression and hotspot mutations of the multidrug efflux transporter,CDR1 in azole-resistant Candida albicans isolates from vaginitis patients[J].FEMS Microbiol Lett,2005,249(2):283-289.
[31]Niimi K,Maki K,Ikeda F,et al.Overexpression of Candida albicans CDR1,CDR2,or MDR1 does not produce significant changes in echinocandin susceptibility[J].Antimicrob Agents Chemother,2006,50(4):1148-1155.
[32]Martel C M,Parker J E,Bader O,et al.Identification and characterization of four azole-resistant erg3 mutants of Candida albicans[J].Antimicrob Agents Chemother,2010,54(11):4527-4533.
[33]Brumfield K M,Moroney J V,Moore T S,et al.Functional characterization of the Chlamydomonas reinhardtii ERG3 ortholog,a gene involved in the biosynthesis of ergosterol[J].PLoS One,2010,5(1):e8659.
[34]Edlind T D,Katiyar S K.Mutational analysis of flucytosine resistance in Candida glabrata[J].Antimicrob Agents Chemother,2010,54(11):4733-4738.
[35]Florent M,Noël T,Ruprich-Robert G,et al.Nonsense and missense mutations in FCY2 and FCY1 genes are responsible for flucytosine resistance and flucytosine-fluconazole cross-resistance in clinical isolates of Candida lusitaniae[J].Antimicrob Agents Chemother,2009,53(7):2982-2990.
[36]Papon N,Noël T,Florent M,et al.Molecular mechanism of flucytosine resistance in Candida lusitaniae:contribution of the FCY2,FCY1,and FUR1 genes to 5-fluorouracil and fluconazole cross-resistance[J].Antimicrob Agents Chemother,2007,51(1):369-371.
[37]Ben-Ami R,Garcia-Effron G,Lewis R E,et al.Fitness and virulence costs of Candida albicans FKS1 hot spot mutations associated with echinocandin resistance[J].J Infect Dis,2011,204(4):626-635.
[38]Slater J L,Howard S J,Sharp A,et al.Disseminated Candidiasis caused by Candida albicans with amino acid substitutions in Fks1 at position Ser645 cannot be successfully treated with micafungin[J].Antimicrob Agents Chemother,2011,55(7):3075-3083.
[39]Chandra J,Kuhn D M,Mukherjee P K,et al.Biofilm formation by the fungal pathogen Candida albicans:development,architecture,and drug resistance[J].J Bacteriol,2001,183(18):5385-5394.
[40]Mukherjee P K,Chandra J.Candida biofilm resistance[J].Drug Resist Updat,2004,7(4-5):301-309.
[41]Nett J E,Sanchez H,Cain M T,et al.Interface of Candida albicans biofilm matrix-associated drug resistance and cell wall integrity regulation[J].Eukaryot Cell,2011,10(12):1660-1669.
[42]Mukherjee P K,Chandra J,Kuhn D M,et al.Mechanism of fluconazole resistance in Candida albicans biofilms:phase-specific role of efflux pumps and membrane sterols[J].Infect Immun,2003,71(8):4333-4340.
[43]Yu L H,Wei X,Ma M,et al.Possible inhibitory molecular mechanism of farnesol on the development of fluconazole resistance in Candida albicans biofilm[J].Antimicrob A-gents Chemother,2012,56(2):770-775.
[44]Pappas P G,Kauffman C A,Andes D,et al.Clinical practice guidelines for the management of candidiasis:2009 update by the Infectious Diseases Society of America[J].Clin Infect Dis,2009,48(5):503-535.

