血清CXCL16浓度与脑卒中患者颈动脉粥样硬化的相关性研究
王克迪 刘志忠 王瑞珉 康熙雄*
(1.首都医科大学附属北京友谊医院临床检验中心,北京 100050;2.首都医科大学附属北京天坛医院实验诊断中心,北京 100050)
动脉粥样硬化不仅仅是脂质的堆积,而是一种炎性反应性疾病。趋化因子(chemokine)与炎性反应细胞表面受体相互作用,在炎性反应细胞定向迁移至炎性反应部位中发挥了关键作用。趋化因子CXC配体16(CXC ligand 16,CXCL16)是2000年发现的一种趋化因子[1-3],能激活其唯一受体CXCR6,从而介导T细胞活化,同时,作为清道夫受体,具有结合氧化低密度脂蛋白(oxidized low density lipoprotein,Ox-LDL)和磷脂酰丝氨酸的作用。颈动脉粥样硬化是全身血管硬化的一个反映,同时与缺血性脑卒中的发生发展密切相关[4-5]。本研究对急性动脉粥样硬化性脑卒中患者行颈部血管超声检查,用颈动脉内-中膜厚度(intimamedian thickness,IMT)、斑块稳定性和斑块面积(carotid plaque area,CPA)评价颈动脉硬化情况,探讨血清CXCL16浓度与颈动脉粥样硬化的相关性。
1 材料与方法
1.1 研究对象
自2008年9月到2009年4月在首都医科大学附属北京天坛医院神经内科住院的患者,共135名,其中男性85例,女性50例,年龄在40~70岁之间,平均年龄(58.90±10.40)岁。诊断标准参照中华医学会第四届脑血管病会议修订的各类脑血管疾病诊断要点[6],均经临床和影像学(CT和/或MRI)、超声等辅助检查确诊,符合动脉粥样硬化性脑卒中。排除患有其他原因所致的各类脑梗死、既往有脑出血病史者,无严重心、肺、脑疾病、恶性肿瘤及炎性反应性疾病。
1.2 方法
1)标本采集:取入组者晨起空腹静脉血2~3 mL,离心分离血清,采用生物化学法测定血糖、血脂和肝肾功能。
2)血清CXCL16浓度测定:采用美国R&D公司生产的人CXCL16定量测定试剂盒,操作严格按照试剂盒说明进行。
3)颈部血管超声:受检者取仰卧位,颈下垫薄枕,头部偏向检查对侧,充分暴露颈部,依次检查右侧和左侧颈动脉,记录颈动脉长轴和短轴图像,观察颈动脉内膜是否光滑、有无增厚、斑块部位、斑块大小和回声特点。测量指标包括IMT、斑块稳定性和CPA。本实验中IMT为左右两侧颈总动脉IMT中的较大值,以1.0 mm作为临界值,IMT>1.0 mm者为IMT增厚组,IMT≤1.0 mm者为IMT正常组。斑块稳定性评价参照美国心脏病协会 (American Heart Association,AHA)标准[7],分为无斑块组、稳定斑块组和不稳定斑块组。CPA定义为颈动脉(包括颈总动脉、颈内动脉、颈外动脉和球部)所有斑块的横截面积之和,依CPA四分位数间距值分为4组。
1.3 统计学方法
采用SPSS 13.0软件进行数据分析。应用onesample Kolmgorov-Smirnov检验所有计量数据是否服从正态性分布,服从正态性分布者,以均数±标准差(±s)表示,两均数的比较采用t检验分析,多组均数比较采用one-way ANOVA;不服从正态分布者,采用中位数(四分位数间距)[M(Q)]表示。计数资料采用χ2检验。以Logistic进行相关性分析。以P<0.05为差异有统计学意义。
2 结果
2.1 研究对象临床资料
研究对象的年龄、性别,有无高血压、糖尿病、吸烟、饮酒史等及生化测量指标如血糖、血脂等资料,详见表1。
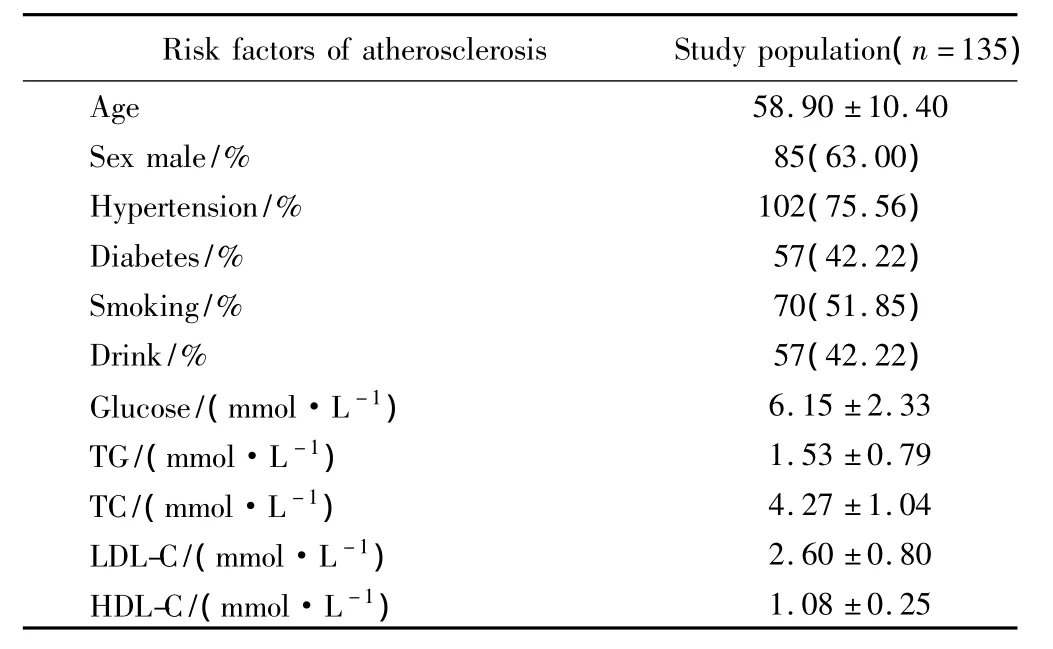
表1 研究对象临床资料Tab.1 Clinical characteristics of the study population
2.2 IMT、颈动脉斑块稳定性和CPA与血清 CXCL16浓度的相关性
与正常IMT组相比较,IMT增高组血清CXCL16浓度显著升高,差异有统计学意义(P<0.05);不稳定斑块组中血清CXCL16浓度显著高于稳定斑块组和无斑块组;依据 CPA四分位数间距分为4组:0.00 ~0.140 cm2(n=34),0.141 ~ 0.512 cm2(n=33),0.513 ~1.126 cm2(n=35)和 1.127 ~5.148 cm2(n=33)。4 组中 M(Q)值分别为 0(0),0.337(0.245),0.736(0.301)和 1.671(1.177)cm2,血清CXCL16水平与CPA密切相关,详见表2。
2.3 血清CXCL16浓度与颈动脉粥样硬化危险因素的相关性
以IMT、斑块稳定性和CPA分别作为因变量,年龄、性别、三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、空腹血糖、高血压病史、2型糖尿病病史、吸烟史和饮酒史作为自变量,进行Logistic回归分析,结果显示高水平CXCL16是高IMT、不稳定性斑块和高CPA的独立危险因素,详见表3。
3 讨论
本研究结果表明,高水平CXCL16是高IMT、不稳定斑块和高CPA的独立危险因素,其与脑卒中患者颈动脉粥样硬化程度密切相关。
目前,关于血清CXCL16浓度与颈动脉粥样硬化相关性研究报道甚少,但有研究[8-9]表明CXCL16及其受体CXCR6基因表达浓度与颈动脉粥样硬化密切相关,应用定量rt-PCR检测到颈动脉硬化斑块中CXCL16 mRNA大量表达,而肉眼观察未见病变的血管显示CXCL16的低转录,免疫组化染色显示CXCL16和CXCR6蛋白存在于单核细胞、T细胞富集区及平滑肌细胞,与本实验结果一致,提示CXCL16与动脉粥样硬化密切相关。
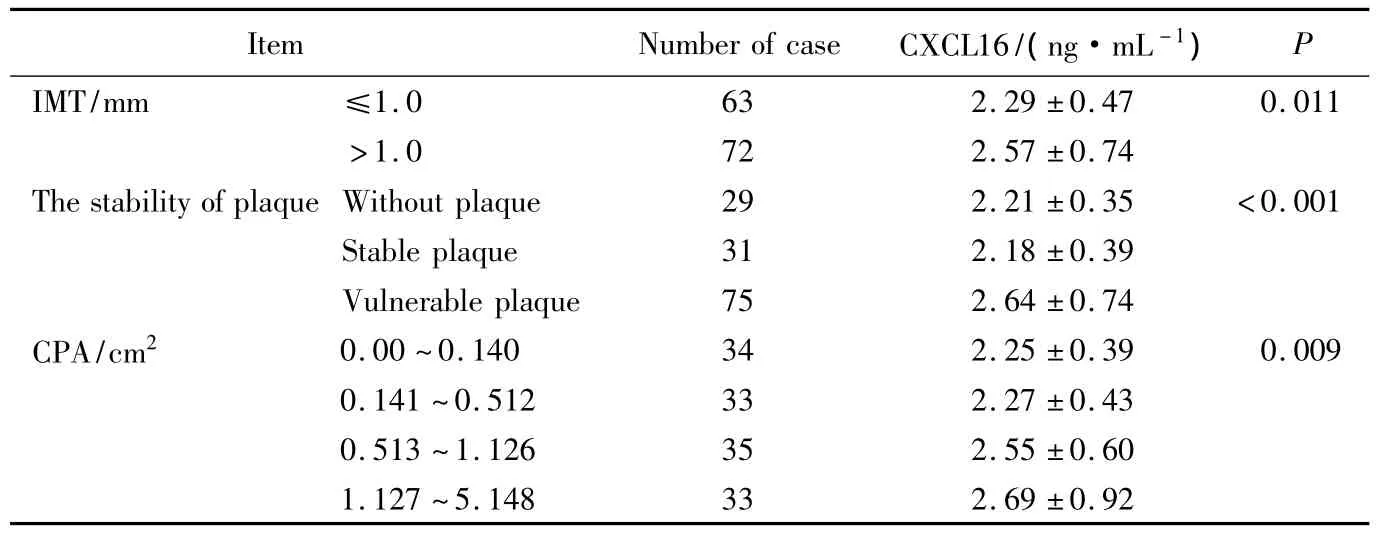
表2 IMT、颈动脉斑块稳定性和CPA与血清CXCL16浓度的相关性Tab.2 Relationship of the stability of carotid plaque,IMT,carotid plaque area and serum CXCL16 concentration
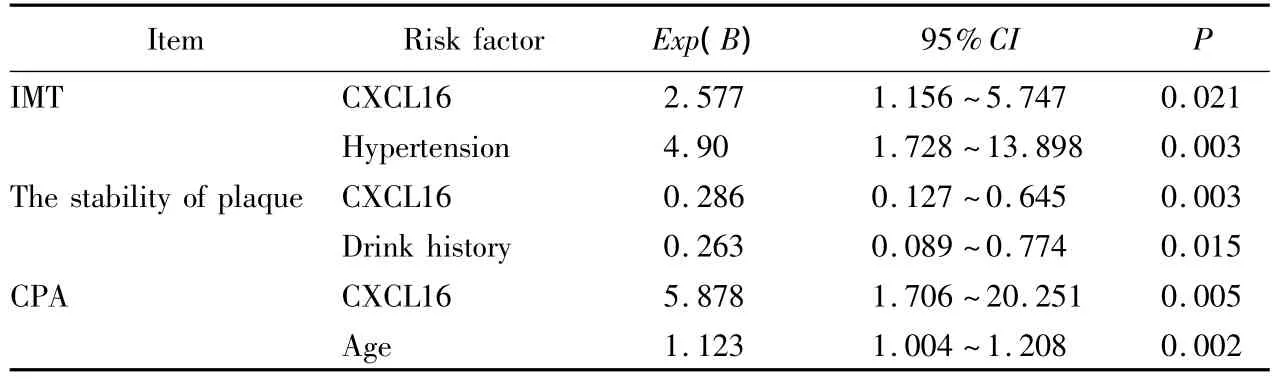
表3 血清CXCL16浓度与颈动脉粥样硬化危险因素的相关性Tab.3 The relationship between serum CXCL16 concentration and carotid atherosclerosis risk factors
然而,Aslanian和Charo应用双重标记免疫组织化学方法研究LDL受体缺陷(LDLR-/-)和cxcl16基因敲除(CXCL16-/-)小鼠,发现与单纯LDLR-/-的小鼠相比,CXCL16-/-LDLR-/-的小鼠主动脉弓部及根部有更大的动脉粥样硬化斑块,且斑块区凋亡细胞数量增加,伴有CD68、CCL2、γ-干扰素 mRNA表达增加,CXCR6+细胞数有减少趋势。可见,cxcl16基因缺陷并没有减轻As,反而伴有As的加重。此外一项研究[10]表明,单核细胞结合和摄取OxLDL的能力在CXCL16表达缺陷的小鼠较野生型下降,上述研究进一步表明了CXCL16的动脉硬化保护作用,推测可能与CXCL16作为清道夫受体,可以从血管壁清除有害物质,起到血管保护作用相关。当然,上述研究仅提示膜结合型CXCL16可能的动脉粥样硬化保护作用,而分泌型CXCL16与膜结合型CXCL16的功能不完全一致,因此,与本实验结果并不矛盾。
颈动脉粥样硬化是全身动脉粥样硬化的可靠标志,且与脑卒中的发生密切相关,多项临床指南[11]已经将高IMT和不稳定斑块作为脑卒中的危险因素。分泌型CXCL16在动脉粥样硬化斑块中高表达,可趋化炎性反应细胞向斑块迁移,加速前炎性反应因子,如γ-干扰素的合成、分泌,而γ-干扰素是CXCL16最有效的诱导物,可以增加 CXCL16及其受体的表达[12-13],如此形成一个正反馈调节,加剧斑块的不稳定性。此外,CXCL16作为血管生成因子[14],诱导血管形成,而新生血管在斑块破裂中是一个核心事件。可见,CXCL16与动脉粥样硬化斑块的发生和不稳定性密切相关。
本文也存在一定的局限性,样本量较小,统计学效力不足,另外尚有一些动脉粥样硬化相关因素未考虑,应在进一步试验中积极完善。
[1]Shimaoka T,Kume N,Minami M,et al.Molecular cloning of a novel scavenger receptor for oxidized low density lipoprotein,SR-PSOX,on macrophages[J].J Biol Chem,2000,275(52):40663-40666.
[2]Matloubian M,David A,Engel S,et al.A transmembrane CXC chemokine is a ligand for HIV-coreceptor Bonzo[J].Nat Immunol,2000,1(4):298-304.
[3]Wilbanks A,Zondlo S C,Murphy K,et al.Expression cloning of the STRL33/BONZO/TYMSTR ligand reveals elements of CC,CXC,and CX3C chemokines[J].J Immunol,2001,166(8):5145-5154.
[4]Nowaczenko M,Sarzynska-Dlugosz I,Czlonkowska A.Prevalence of carotid arteries atherosclerotic changes in ischemic stroke patients[J].Neurol Neurochir Pol,2003,37(1):27-36.
[5]李晶玮,杜凤和,徐秀英.老年高血压患者颈动脉粥样硬化与超敏C反应蛋白的关系[J].首都医科大学学报,2010,31(2):268-271.
[6]陈清棠.脑卒中患者临床神经功能缺损程度评分标准(全国第四届脑血管病学术会议通过)[J].中华神经科杂志,1996,29(6):381-383.
[7]Stary H C,Chandler A B,Dinsmore R E,et al.A definition of advanced types of atherosclerotic lesions and a histological classification of atherosclerosis:a report from the Committee on Vascular Lesions of the Council on Arteriosclerosis,American Heart Association[J].Circulation,1995,15(9):1512-1531.
[8]吕永青,卜培莉.CXCL16与动脉粥样硬化的关系研究[J].中国实用医药,2009,4(9):60-62.
[9]Wuttge D M,Zhou X,Sheikine Y,et al.CXCL16/SRPSOX is an interferon-gamma-regulated chemokine and scavenger receptor expressed in atherosclerotic lesions[J].Arterioscler Thromb Vasc Biol,2004,24(4):750-755.
[10]Aslanian A M,Charo I F.Targeted disruption of the scavenger receptor and chemokine CXCL16 accelerates atherosclerosis[J].Circulation,2006,114(6):583-590.
[11]Blaser T,Hofmann K,Buerger T,et al.Risk of stroke,transient ischemic attack,and vessel occlusion before endarterectomy in patients with symptomatic severe carotid stenosis[J].Stroke,2002,33(4):1057-1062.
[12]Chandrasekar B,Bysani S,Mummidi S.CXCL16 signals via Gi,phosphatidylinositol3-kinase,Akt,I kappaB kinase,and nuclear factor-kappa B and induces cell-cell adhesion and aortic smooth muscle cell proliferation[J].J Biol Chem,2004,279(5):3188-3196.
[13]Ludwig A,Weber C.Transmembrane chemokines:versatile‘special agents’in vascular inflammation[J].Thromb Haemost,2007,97(5):694-703.
[14]Zhuge X,Murayama T,Arai H,et al.CXCL16 is a novel angiogenic factor for human umbilical vein endothelial cells[J].Biochem Biophys Res Commun,2005,331(4):1295-1300.

