抗番茄灰霉病优良菌株的筛选与鉴定
张 鹏,李 莉,王智学,王 萍,李晓旭,柴林山,孙丽梅
(1.沈阳农业大学土地与环境学院,辽宁 沈阳 110861;2.辽宁省微生物科学研究院,辽宁 朝阳 122000)
灰霉病已经导致世界范围内200多种农作物严重减产,危害对象从葡萄、番茄、草莓等浆果到蔬菜及果核类作物[1]。随着现代农业设施的改进,我国番茄种植规模不断扩大,提高了灰霉病发生发生的几率。番茄灰霉病是由灰葡萄孢菌引起的重要植物病害,是我国重点防治的蔬菜病害之一。目前对灰霉病的防治主要以化学药剂为主,长期施用不但使灰葡萄孢菌产生一定的抗药性,而且由此带来的农药残留及环境污染问题日趋严重。利用拮抗微生物防治植物病害是具有发展潜力的防治方法,一些细菌和真菌相继被应用于生物农药的生产,如枯草芽胞杆菌、多粘芽胞杆菌及哈茨木霉等[2],国内外许多学者已经进行了灰霉病生物防治研究工作,并取得了一定的进展。本实验室选用辽宁省朝阳地区番茄大棚根际土壤和发病植株样本进行生防菌株的分离、筛选,旨在为生物农药的研发提供实验材料。
1 材料与方法
1.1 材料
1.1.1 菌株 来自辽宁省朝阳县、喀左、北票不同地区番茄大棚根际土壤和发病植株。所用植物病原真菌番茄灰霉病菌(Botrytis cinerea)由辽宁省微生物科学研究院提供。
1.1.2 培养基 PDA培养基、牛肉膏蛋白胨培养基、KB培养基,液体培养基不加琼脂。
1.1.3 主要仪器和试剂 高速冷冻离心机(Sigma 3K15型)、PCR仪(Systerm2700)、紫外可见分光光度计等,PCR反应需要的试剂(分析纯)均购于TaKaRa公司。
1.2 方法
1.2.1 灰霉病拮抗菌的分离与初筛 采用指示平板法分离拮抗菌株。取1 g根际土壤依次稀释至 10-2、10-3、10-4、10-5、10-6、10-7,取 10-6、10-72个梯度各100 μL分别与孢子菌悬液(1×108/mL)等体积混合涂NA平板,25℃培养48~72 h,观察抑菌现象,用十字交叉法测量抑菌圈直径(d1)和菌落直径(d2),计算d1/d2,挑取具有明显透明圈的菌株,进行分离纯化,4℃试管保藏。植物组织拮抗细菌的分离采用研磨稀释分离法[3],筛选方法同上。
1.2.2 拮抗菌复筛 采用平板对峙培养法[4],25℃培养4~5 d,观察抑菌效果,记录2菌中心点连线上拮抗菌落中心到边缘距离(R2)及其到病原菌边缘的距离(R1)(可参见图1标注),用R1/R2表示抑菌活性的强弱。每个处理3次重复。选择活性较强的菌株进行遗传稳定性测试,连续传代12次,测定抑菌活性的变化。
1.2.3 拮抗菌株的鉴定 挑取筛选菌株TS30分别在NA和KB平板上划线,32℃培养24 h观察菌落形态,并进行革兰染色,继续培养24 h进行芽胞染色。生理生化特征鉴定:根据《常见细菌系统鉴定手册》和《伯杰细菌鉴定手册》(第8版)进行形态和生理生化鉴定[5]。16S rDNA序列分析:CTAB法提取细菌DNA[6]。利用细菌通用引物 50F(5'-AACACATGCAAGTCGAACG-3')、1492R(5'-GGTTACCTTGTTACGACTT-3')进行PCR扩增。PCR反应条件:95℃预变性5 min;然后94℃变性45 s,55℃退火45 s,72℃延伸1.5 min,35个循环后,72℃延伸10 min,终止反应。回收PCR产物,得到1.5 kb左右的片段,送至上海生物工程有限公司进行测序。将测得的序列用BLAST软件与GenBank中已知序列进行同源性比较,然后利用MEGA4.1软件构建系统发育树。
1.2.4 菌株生长曲线及抑菌最适培养时间 ①种子液的制备:菌株TS30在NA平板上32℃培养24 h活化,挑取菌落接入100 mL(250 mL)三角瓶的液体培养基中,28℃,170 r/min培养12 h,获得种子液;②发酵液的制备:将种子液以2%(体积比)接入200 mL(500 mL)三角瓶KB液体培养基中,28℃,170 r/min培养48 h,用培养基稀释到一定的倍数,使吸光度值维持在0.1~0.65之间,无菌培养基作空白对照,初始间隔6 h,后期间隔12 h取样测吸光度值(OD625),绘制生长曲线。分别取培养24、48、72和96 h的发酵液,4℃,8000 r/min离心20 min去除菌体,得到无菌上清液。采用抑菌圈法[7]测定发酵代谢物抑菌活性,每个牛津杯加样150 μL,25℃培养4 d,对照组为无菌水。每组处理3次重复。
2 结果与分析
2.1 拮抗细菌的分离与筛选
经分离共获得139株细菌菌株,有93株来自根际土壤(TS),其余菌株分别来自健康番茄的根、茎、叶组织,菌种编号分别是(TG)、(TJ)、(TY)。经观察发现35株细菌具有清晰、透明的抑菌圈(比值大于1.5),其中12株拮抗细菌(比值大于2.5者),透明圈较为明显,见表1。
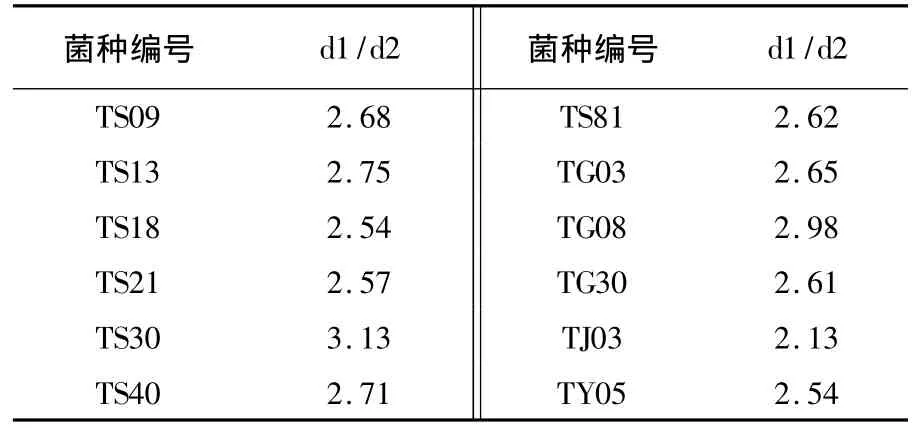
表1 抗番茄灰霉初筛结果Table 1 Primary screening of antagonistic strains against Botrytis cinerea
采用平板对峙法研究菌株TS18、TS21、TS30、TG08等上述10株拮抗菌对番茄灰霉病菌的抑菌活性,菌株TS30与TG08的抗真菌活性大小R1/R2值分别为3.64(12.0/3.3)与3.35(9.4/2.7)。经12次传代后菌株TS30对灰霉病菌的抑菌活性仍维持在3.15以上,抑菌作用的稳定性较好,而TG08从第7代开始抑菌作用明显减弱。因此选择菌株TS30作为本试验的生防菌进行后续研究。
2.2 菌株TS30的鉴定
菌株TS30在NA培养基上培养24 h后,菌落呈乳白色略微带红,不透明,表明湿润光滑,边缘规则。在显微镜下观察,菌体短杆状,大小(0.6~0.7)μm ×(2.0 ~3.0)μm,革兰染色为阴性,不形成芽胞,在KB培养基上生长可产生荧光色素(图2c)。菌株TS30可耐受一定范围内的盐度,在4~37℃条件下能够生长,41℃不生长。可以发酵葡萄糖、果糖等常见糖类物质,并且能以多种醇类物质作为碳源,甲基红试验、接触酶反应和硝酸盐反应均呈阳性,不能利用乙醇、L-鼠李糖等,见表2。根据第8版《伯杰氏细菌鉴定手册》、《常见细菌系统分类手册》可初步鉴定其属于假单胞菌属。
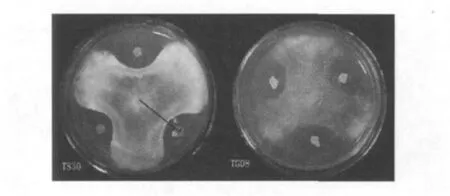
图1 2株拮抗菌对灰霉的作用Fig.1 Two antagonistic result of isolates TS30 and TG08 against Botrytis cinerea

图2 菌株TS30形态观察Fig.2 Strains TS30 form observation
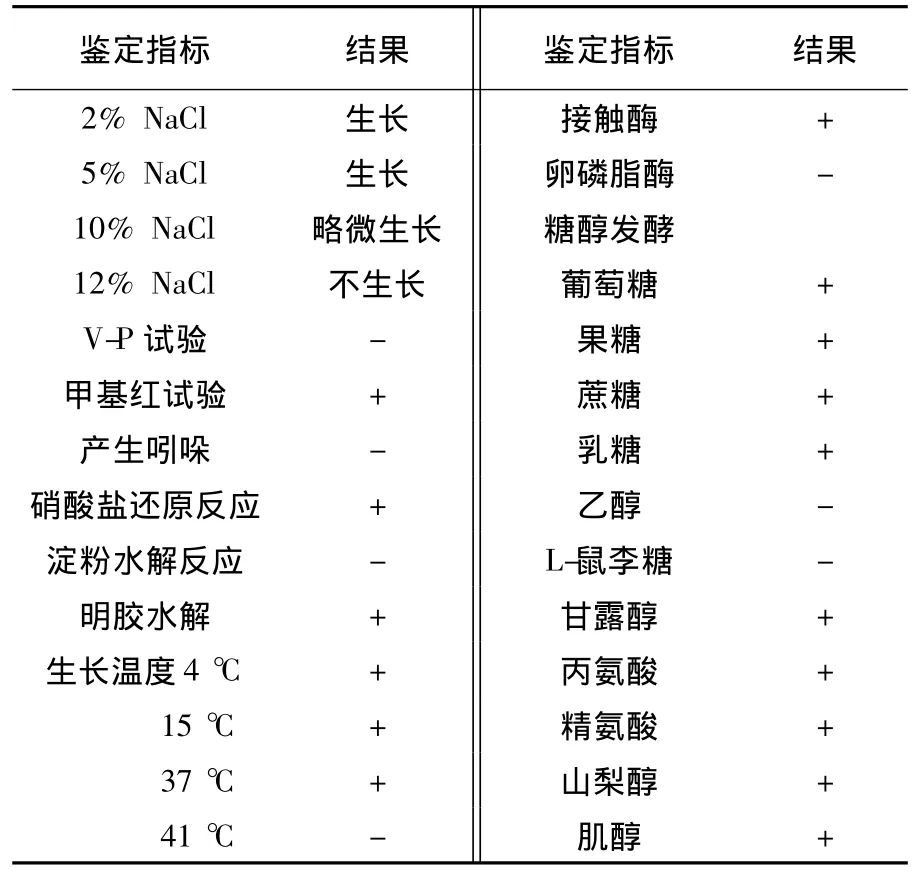
表2 生理生化指标Table 2 Physiological and biochemical properties of strain TS30
菌株TS30基因组DNA经PCR扩增得到的16S rDNA部分序列,长度为1398 bp,已提交序列至GenBank(登录号:JX173182)。通过序列比对发现该菌株与假单胞菌属存在较高同源性,相似率达到99%。如图3所示,系统树显示TS30与 P.fluorescens LRB3W1和 P.fluorescens MPF25在同一个分支,与前者亲缘关系最近,结合细菌形态和生理生化特征可鉴定该菌为荧光假单胞菌。
2.3 菌株TS30生长曲线及抑菌效果最适培养时间
由图4可知,菌株TS30的生长周期大于96 h,6~18 h进入对数生长期,18 h后进入稳定期。培养72 h发酵上清液的抑菌直径可达24.5 mm,24、48、96 h的发酵上清液抑菌活性较弱,透明圈直径分别为 11.2、15.3、18.6 mm,结合生长曲线,可确定72 h为该产生抑菌活性物质最适培养时 间,分别见图4和图5。
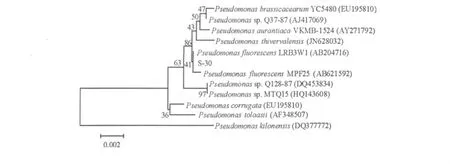
图3 分离菌株16S rDNA序列系统发育树Fig.3 Phylogenetic tree based on 16S rDNA sequence from isolate
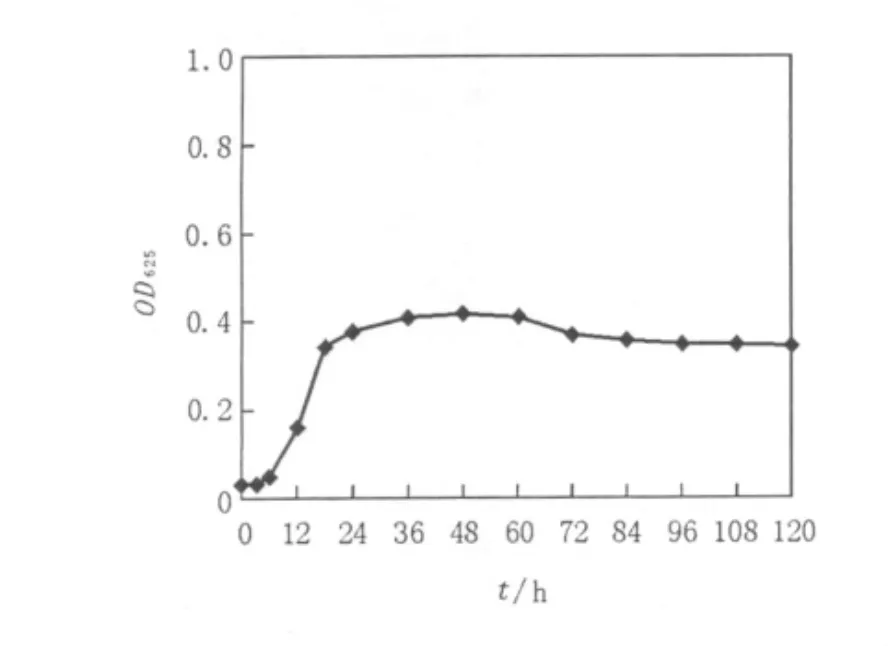
图4 菌株TS30生长曲线Fig.4 The growth of curve of strain TS30
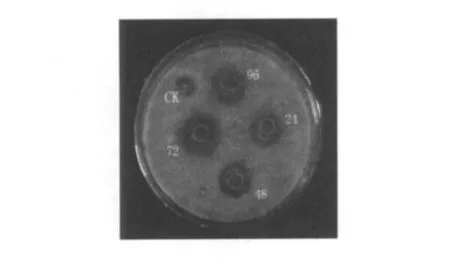
图5 不同培养时间抑菌效果的比较Fig.5 The comparison of antagonistic effect with different time
3 讨论
由灰葡萄孢菌引起的灰霉病,是一种世界性真菌病害,具有发病条件适宜、腐生性强、寄主范围广泛等特点。目前,已在世界各地引起多种常见经济作物发病,如番茄(Lycopersicon esculentum Mill)、黄瓜(Cucumis sativus Linn)、葡萄(Vitis vinifera)、辣椒(Capsicum annuum)、甜菜(Beta vulgaris)、莴苣(Lactuca sativa)、洋葱(Allium cepa linn)等产量和质量都受到严重影响。化学农药的大量使用对环境保护和人体安全已造成威胁,并且病原菌随之产生了一定的抗药性。利用生物手段开发选育优良生防菌株并研制生防菌剂已成为国内外研究的热点。
本试验从发病植株根、茎、叶组织及不同地区根际土样中分离筛选生防菌株,通过试验结果可以看出拮抗菌株较多集中在根际土壤和番茄根部组织,本试验筛选得到TS30和TG082株抗性较强菌株。可能由于菌体最适生长的环境不同,G-08抗性遗传稳定性较差,抑菌活性随传代次数增多而明显减弱,而TS30抑菌效果较稳定,故选取TS30进行后续深入研究。通过对菌株TS30进行形态学、生理生化特征鉴定,初步鉴定其为假单胞菌属,利用16S rDNA基因测序和系统发育树进一步分析,发现其与多株假单胞菌同源性高达99%,并且与Pseudomonas fluorescens处于同一分支,可鉴定其为荧光假单胞菌。通过生长曲线的测定和不同时间段代谢产物抑菌活性研究,可知菌株TS30的抑菌活性与菌体生物量的产生并不完全成正比,产生最大量抗菌物质的培养时间为72 h。
荧光假单胞菌产生多种抗真菌物质,如2,4-二乙酰基间苯三酚(DAPG)、吩嗪-1-羧酸(PCA)、哨吡咯菌素(Prn)、嗜铁素、氢氰酸[8]等。近年来,国内外均有人报道分离到可抗植物真菌病害的荧光假单胞菌,Howell-CR(1980)分离到 P.fluorescens Pf-5[9];美国华盛顿州立大学的 Thomashow L.S.等(1986)从小麦根际分离出P.fluorescens 2-79;周洪友等[10]分离到的 CPF-10,对小麦全蚀病、番茄青枯病等有较好的防治效果,但P.fluorescens在番茄灰霉病研究的报道很少。本试验研究发现菌株TS30抗灰霉菌能力强、作用效果稳定并且培养条件较适宜,但其抑菌机理、抗菌物质分离纯化、发酵工艺优化及实践应用等方面还有待研究。
[1]Brian Willamson,Bettina Tudzynski,et al.Botrytis cinerea:the cause of grey mould disease[J].Molecular Plant Pathology,2007,8(5):561-580.
[2]童蕴慧,纪兆林,徐敬友,等.灰霉病生物防治研究进展[J].中国生物防治,2003,19(3):131-135.
[3]李艳琴,申泉,刘彬彬,等.番茄内生菌分离及其ERIC-PCR指纹图谱分析[J].微生物学通报,2003,30(5):89-92.
[4]Iván Petatán-Sagahón,Miguel Angel,Anducho-Reyes,et al.Isolation of Bacteria with Antifungal Activity against the Phytopathogenic Fungi Stenocarpella maydis and Stenocarpella macrospore[J].Molecular Sciences,2011,12(9):5522-5537.
[5]Buchanan RE,Gibbons NE.中国科学院微生物研究所伯杰细菌鉴定手册翻译组译.伯杰细菌鉴定手册(第8版)[M].北京:科学出版社,1984:855-865.
[6]F.奥斯特伯(美),R.布伦特(美),等.精编分子生物学实验指南[M].北京:科学出版社,1999.
[7]童蕴慧,徐敬友,陈夕军,等.番茄灰霉病菌拮抗菌的筛选和应用[J].江苏农业学报,2001,22(4):25-28.
[8]Maurhofer M,Keel C,Schnider U.Influence of enhanced antibiotic production in Pseudomonas fluorescens strain CHA0 on its disease suppressive capacity[J].Phytopathology,1992,82(2):190-195.
[9]Haas D,Blumer C,Keel C.Biocontrol ability of Fluorescent pseudomonads genetically dissected:importance of positive feedback regulation[J].Current Opinion in Biotechnology,2000,11(3):290-297.
[10]Howell CR,Stipanovic RD.Suspension of Pythium ultimuminduced damping-off of cotton seedlings by Pseudomonas fluorescens and its antibiotic,pyoluteorin[J].Phytopathology,1980,70(8):712-715.

