不同时间缺氧对脂肪细胞炎症因子表达的影响
胡立娟,牛文彦
(天津医科大学免疫学教研室,天津300070)
肥胖患者脂肪组织过度肥大,且先于血管生成造成局部脂肪组织缺氧,因此脂肪细胞处于慢性缺氧状态。肥胖的脂肪组织伴有巨噬细胞浸润,脂肪细胞自身及浸润的巨噬细胞可释放大量炎症因子,如白细胞介素-1(IL-1)、白细胞介素-6(IL-6)、单核细胞趋化因子(MCP)、肿瘤坏死因子-α(TNF-α)等[1],因此肥胖可视为一种慢性炎症。慢性炎症已成为2型糖尿病发病病因主要学说。最近有研究认为缺氧是造成脂肪组织慢性炎症的因素,本研究用1%O2、5%CO2、94%N2孵育脂肪细胞不同时间,检测脂肪细胞表达的炎症因子水平的变化。
1 材料与方法
1.1 材料 3T3-L1脂肪细胞株 (由加拿大Amira Klip教授提供),Hanks液、DMEM高糖(天润善达公司),胎牛血清(以色列 Bioind公司),胰岛素、1-甲基-3-异丁基-黄嘌呤(IBMX)、地塞米松溶液(美国Sigma公司),偶联HRP的山羊抗兔抗体(美国Jackson Immuno Research公司),增强化学发光底物检测试剂盒(美国PerkinElmer公司),高纯总RNA提取试剂盒(北京百泰克公司)、cDNA合成试剂盒(北京天根公司)、Premix ExTaq酶、TaqDNA聚合酶、dNTPMixture、荧光实时定量PCR试剂盒(Takara宝生物工程公司),引物合成(北京奥科生物技术公司)。
1.2 方法
1.2.1 细胞培养 3T3-L1前脂肪细胞用含有10%胎牛血清的高糖DMEM培养基,在37℃5%CO2条件下培养至融合达80%,按密度为5×104/mL将细胞接种在培养板中,待生长至完全融合后再生长2 d进行诱导分化,以下诱导分化培养基均用高糖DMEM培养基配制,用含0.5mmol/L IBMX、lμmol/L地塞米松、5mg/L胰岛素的诱导分化培养基培养2 d,再用含5mg/L胰岛素的诱导分化培养基培养2 d,之后每2 d换含有10%胎牛血清的高糖DMEM培养基1次,约第14天达到90%以上为成熟脂肪细胞,此时细胞中出现串状的脂肪滴。将细胞分为常氧组37℃1%O 5%CO 94%N2下孵育时间为4、8和16 h。
1.2.2 免疫印迹检测葡萄糖转运子1(GLUT1)的表达 常氧或缺氧培养脂肪细胞后,裂解细胞,测蛋白后取40μg裂解液,65℃加热15min,7.5%(v/v)SDS-PAGE电泳,免疫印迹检测GLUT1,一抗用抗GLUT1的兔抗体,二抗用偶联HRP的山羊抗兔抗体,以Actinin1作内参,增强化学发光底物试剂盒检测,曝光,应用NIH Image J软件分析定量。
1.2.3 Real-time PCR法测定脂肪细胞 TNF-α、MCP-1mRNA水平 提取总RNA,取2μg合成cDNA第一链,取2μg cDNA产物及相应上下游引物加入 12.5μLSYBR誖PremixEx Taq TM(2×)体系内扩增,条件为 95 ℃ 30 s,95 ℃ 5 s,57 ℃ 10 s,72 ℃34 s,40个循环,β-actin为内参。TNF-α 上游引物为5′-CGTCGTAGCAAACCACCAA-3′;下游引物为 5′-GAGAACCTGGGAGTAGACAAGG-3′。MCP-1 上游引物为 5′-GCAGTTAACGCCCCACTCA-3′,下游引物为 5′-CCCAGCCTACTCATTGGGATCA-3′。β-actin上游引物为 5′-GGCTGTATTCCCCTCCATCG-3′;下游引物为 5′-CCAGTTGGTAACAATGCCATGT-3′。
1.3 统计学处理 采用SPSS13.0统计软件包进行统计学分析。所有实验数据均以平均值±标准差表示,组间比较采用单因素方差分析(One-Way ANOVA),两组之间比较采用t检验,以P<0.05认为有统计意义。
2 结果
2.1 缺氧脂肪细胞GLUT1的表达 与常氧培养组相比,脂肪细胞不同时间缺氧培养后缺氧应答基因GLUT1蛋白表达升高,4 h缺氧组为常氧组的(2.10±0.20)倍,8 h 缺氧组为常氧组的(4.20±0.30)倍,16 h缺氧组为常氧组的(5.57±0.68)倍,表明缺氧培养成功,见图1。
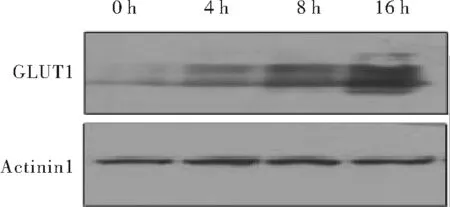
图1 不同时间缺氧培养脂肪细胞后GLUT1的表达Fig 1 Different incubation timeof hypoxia on theexp resion of GLUT1 in adipocytes
2.2 脂肪细胞TNF-α、MCP-1mRNA的表达 与常氧培养组相比,缺氧培养的脂肪细胞TNF-α mRNA表达升高,并且随着缺氧时间的延长而升高,4 h缺氧组为常氧组的(1.88±0.23)倍,8 h缺氧组为常氧组的(2.34±0.26)倍,16 h缺氧组为常氧组的(3.54±0.0.94)倍,不同时间的缺氧组与常氧组相比差异均有统计学意义(P=0.002)。其中8 h缺氧组与4 h缺氧组相比,TNF-αmRNA表达升高,但差异却无统计学意义(P=0.296),16 h缺氧组与4 h缺氧组相比,TNF-αmRNA表达明显升高,差异有统计学意义(P<0.05),16 h缺氧组与8 h缺氧组相比,差异有统计学意义(P<0.05),见图2。缺氧脂肪细胞比常氧脂肪细胞MCP-1mRNA表达升高,4 h缺氧组为常氧组的(2.24±0.52)倍,8 h缺氧组为常氧组的(2.43±0.35)倍,16 h缺氧组为常氧组的(3.66±0.77)倍,不同时间的缺氧组与常氧组相比差异均有统计学意义(P=0.016)。其中8 h缺氧组与4 h缺氧组相比MCP-1mRNA表达无差异,16 h缺氧组与4 h缺氧组相比,MCP-1mRNA表达明显升高,差异有统计学意义(P<0.01),16 h缺氧组与8 h缺氧组相比,差异有统计学意义(P<0.05),见图3。

图2 不同时间缺氧孵育后脂肪细胞TNF-α的基因表达Fig 2 Different incubation tim eof hypoxia on theexpresion of TNF-αin adipocytes

图3 不同时间缺氧孵育后脂肪细胞MCP-1的基因表达Fig3 Different incubation tim eof hypoxia on theexpresion of MCP-1 in adipocytes
3 讨论
肥胖是一种慢性低度炎症,与糖尿病、动脉粥样硬化、高胰岛素血症、心血管疾病等密切相关。肥胖相关性炎症的发生与血清中炎症因子,包括脂肪因子的异常密切相关。新近发现在肥胖小鼠的脂肪组织中存在局部缺氧和巨噬细胞浸润增加,并且与炎症因子的升高密切相关[2]。脂肪组织内脂肪细胞及定居在其中的巨噬细胞分泌的IL-1、IL-6、MCP-1、TNF-α等炎症因子释放入血液可影响胰岛素在其它靶组织中的作用。本研究用1%O2孵育脂肪细胞不同时间,造成脂肪细胞缺氧,研究缺氧孵育不同时间后脂肪细胞表达炎症因子的变化。
GLUT1为基础状态下摄取葡萄糖的主要转运子,缺氧状态下表达增高[3]。本研究通过检测GLUT1蛋白的表达变化,验证缺氧处理的效果。缺氧4 h GLUT1蛋白的表达较常氧组明显升高,并且缺氧时间越长,升高越明显,表明造成缺氧模型。肥胖动物的脂肪组织在增长的过程中,肥大的脂肪细胞的氧供应相对减少,导致脂肪细胞缺氧。在肥胖小鼠的脂肪组织,炎症因子(TNF-α、IL-1、IL-6等)和巨噬细胞标志分子的基因表达增加,同时伴有缺氧反应基因的增加,说明在肥胖小鼠的脂肪组织中存在慢性炎症且与缺氧有关。本课题组前期研究发现缺氧孵育4 h的脂肪细胞与常氧培养的脂肪细胞相比,游离脂肪酸(FFA)、TNF-α、MCP-1、IL-6明显升高,脂联素降低,证明缺氧导致脂肪细胞的炎症发生。炎症引起脂肪细胞自身胰岛素抵抗,分泌FFA和多种炎症因子,进而影响其它胰岛素靶组织骨骼肌和肝脏的胰岛素敏感性,造成周身胰岛素抵抗(insulin resistance,IR),最终导致2型糖尿病。因为缺氧造成的是慢性炎症,因此本研究延长缺氧时间,检测长时间的缺氧对脂肪细胞炎症因子的影响。
TNF-α是具有多种生物活性的细胞因子,适量的TNF-α能杀伤和抑制肿瘤细胞,促进中性粒细胞吞噬,抗感染,促进细胞增殖和分化等,是机体免疫防护的重要介质,对机体有利;而过量的TNF-α与其他炎症因子一起产生多种病理损伤,脂源性和肌源性的TNF-α在肥胖所致外周胰岛素抵抗的病理过程中起重要作用[4]。肥胖、胰岛素抵抗的动物脂肪组织TNF-α增高,中和TNF-α后,可以逆转动物的胰岛素抵抗[5]。研究表明,伴IR的肥胖个体脂肪组织TNF-αmRNA表达及TNF-α分泌均增加,且与空腹血浆胰岛素水平及体重指数呈正相关[6-7],当体重下降时,其表达水平随之下降。本研究发现缺氧处理的脂肪细胞TNF-α水平明显升高,并且缺氧时间越长,升高越明显,说明长时间缺氧比短时间缺氧造成脂肪细胞更严重的炎性反应。
单核细胞趋化因子MCP-1在招募单核细胞和T淋巴细胞中发挥关键作用。在饮食导致的肥胖早期MCP-1表达增加,因此MCP-1被认为是招募巨噬细胞进入脂肪组织的因子。高脂喂养MCP-1缺陷小鼠,脂肪组织的巨噬细胞浸润在一定程度上部分减少,并且胰岛素敏感性得到改善[8]。本课题组已往的研究发现缺氧培养4 h的脂肪细胞条件培养基比常氧的脂肪细胞条件培养基造成更严重的骨骼肌胰岛素抵抗,并吸引更多的巨噬细胞浸润[9]。本研究在此基础之上,延长缺氧孵育时间,发现16 h缺氧孵育的脂肪细胞MCP-1表达增加比4 h、8 h的升高更加明显,与TNF-α表达水平相一致,因此笔者推测,长时间的缺氧可引起脂肪细胞条件培养基含有更多的炎性因子。后续研究将延长缺氧孵育脂肪细胞时间,收集条件培养基,检测该条件培养基是否造成更严重的骨骼肌细胞胰岛素抵抗。
综上所述,缺氧处理的脂肪细胞比常氧条件下的脂肪细胞TNF-α和MCP-1的表达升高,并且缺氧时间越长,升高越明显。
[1]Kundu JK,Surh Y J.Inflammation:Gearing the journey to cancer[J].MutatRes,2008,659(1/2):15
[2]Ye J,Gao Z,Yin J,et al.Hypoxia is a potential risk factor for chronic inflammation and adiponectin reduction in adipose tissue ofob/ob and dietaryobesemice[J].Am JPhysiol EndocrinolMetab,2007,293(4):1118
[3]Peansukmanee S,Vaughan-Thomas A,Carter SD,etal.Effects of hypoxia on glucose transport in primary equine chondrocytes in vitroand evidenceof reduced GLUT1 geneexpression in pathologic cartilage in vivo[J].Orthop Res,2009,27(4):529
[4]Ranganathan S,Davidson M B.Effectof tumor necrosis factor-alpha on basal and insulin-stimulated glucose transport in cultured muscleand fatcells[J].Metabolism,1996,45(9):1089
[5]QiC,Pekala PH.Tumor necrosis factor-alpha induced insulin resistance[J].Proc Soc Exp BiolMed,2000,223(2):128
[6]Samy N,Hashim M,Sayed M,et al.Clinical significance of inflammatorymarkers in polycystic ovary syndrome:their relationship to insulin resistance and bodymass index[J].DisMarkers,2009,26(4):163
[7]Won JC,Park CY,LeeW Y,etal.Association ofplasma levelsof resistin with subcuaneous fatmass and markers of inflammation butnotmetabolicdeterminantsorinsulin resistance[J].JKoreanMed Sci,2009,24(4):695
[8]Kanda H,Tateya S,Tamori Y,et al.MCP-1 contributes to macrophage infitration into adipose tissue,insulin resistance,and hepatic steatosis in obesity[J].JClin Invest,2006,116(6):1494
[9]Yu J,Shi L,Wang H,et al.Conditioned medium from hypoxiatreated adipocytes rendersmuscle cells insulin resistant[J/OL].Eur JCellBiol,2011,http://www.elsevier.de/ejcb.

